Микробиологическая диагностика возбудителя холеры (V. cholerae)
Лабораторная диагностика холеры включает два метода исследования: бактериологический (основной) и серологический, имеющий, как правило, дополнительное значение и лишь в отдельных случаях являющийся решающим для ретроспективной диагностики заболеваний или вибриононосительства.
Бактериологический метод исследования с целью обнаружения холерного вибриона в материале от больного или в воде поверхностного водоема уходит своими корнями в 1883-1884 гг., когда этим методом Робертом Кохом был выявлен и получен в чистой культуре холерный вибрион. Методика, которой пользовался Р. Кох, получила название «классической» и используется с небольшими модификациями до настоящего времени во всех странах мира.
Цель бактериологического исследования:
- выявление больных холерой и вибриононосителей;
- установление окончательного диагноза при вскрытии трупов лиц, погибших от подозрительного на холеру заболевания;
- бактериологический контроль за эффективностью лечения больных холерой и вибриононосителей;
- бактериологический контроль за зараженностью объектов внешней среды;
- бактериологический контроль за эффективностью обеззараживания в очаге инфекции.
Материалом для бактериологического анализа служат испражнения, рвотные массы, желчь, трупный материал (отрезки тонкого кишечника и желчный пузырь), предметы, загрязненные испражнениями или рвотными массами (постельное и нательное белье и др.); вода, ил, гидробионты, сточные воды, смывы с объектов внешней среды, пищевые продукты, мухи и др.
Успех бактериологического исследования зависит от правильности взятия материала, своевременности доставки его в лабораторию. Необходимо учитывать также высокую чувствительность холерных вибрионов к дезинфицирующим средствам и кислотам, возможность антагонистического действия сопутствующей микрофлоры и концентрацию возбудителя в исследуемом материале. Так, если в материале от больных алгидной формы холеры концентрация возбудителя достигает 107-109 КОЕ в 1 мл, то в испражнениях больных легкой формой, вибриононосителей, реконвалесцентов количество их обычно не превышает 102-104 КОЕ в 1г (1 мл).
Для сбора проб используют чистую стерильную посуду, не содержащую даже следов дезинфицирующих растворов. Стерилизацию посуды для забора материала проводят автоклавированием, сухим жаром или кипячением в 2%-ном содовом растворе.
Материал для исследования доставляют в лабораторию не позже чем через 2 ч после его взятия. В случае удлинения сроков доставки (до 24 ч и более) используют транспортные среды: 1%-ную пептонную воду pH 9,0-9,5 или, при исследовании внешней среды, — 1%-ную пептонную воду pH 7,8-8,0 с добавлением теллурита калия из расчета 1:100 000 — 1:200 000, а также 1%-ную пептонную воду pH 9,0-9,5.
Испражнения и рвотные массы в количестве 10-20 мл собирают в стерильную посуду (банку 0,25 л) ложками или стеклянными трубками с резиновой грушей из индивидуального судна. Затем материал направляют в лабораторию в нативном виде или в 1%-ной пептонной воде, куда вносят 1-2 мл испражнений (флакон на 100 мл с 50 мл 1%-ной пептонной воды или пробирка с 5-6 мл 1%-ной пептонной воды).
Материал от больных, у которых отсутствует диарея, реконвалесцентов и лиц, обследуемых на вибриононосителъство, забирают из прямой кишки ватными тампонами или петлями из алюминиевой проволоки и помещают в пробирки с 5-6 мл 1% пептонной воды или во флакон с 50 мл 1%-ной пептонной воды.
При поступлении в стационар материал у обследуемых лиц забирают трехкратно (с промежутками между заборами 3 ч), а перед выпиской — 3 дня подряд после окончания курса антибактериальной терапии.
Желчь берут при дуоденальном зондировании в лечебном учреждении. В отдельные пробирки собирают две порции: из желчного пузыря и желчных протоков (В и С). Материал доставляют нативным.
От умерших с подозрением на холеру берут отрезки верхней, средней и нижней частей тонкого кишечника длиной около 10 см. Отрезки вырезают между двойными лигатурами, наложенными на оба конца изымаемого участка кишечника. Желчный пузырь после перевязки протока извлекают целиком. Взятые образцы органов трупа укладывают раздельно в стерильные банки емкостью 0,5 л.
Воду (питьевую, из поверхностных водоемов) для исследования берут в количестве 1 л на одну пробу в двух объемах по 0,5 л в стерильную посуду (флакон, бутылки) с непромокаемой пробкой. Водопроводную воду забирают из предварительно обожженных спиртовым факелом кранов и спуска воды в течение 10 мин при полном открытии крана.
Воду из плавательных бассейнов собирают при помощи металлических черпаков, которые обжигают на спиртовом факеле.
Сточные воды отбирают для исследования двумя способами: в объеме 1 л в двух емкостях по 0,5 л или тампонами, приготовленными из марлевых салфеток размером 10x15 в 10-15 слоев. Последние закрепляют у места забора воды на сутки, затем помещают в стерильные банки и доставляют в лабораторию.
Гидробионтов (рыб, лягушек, раков и т.д.) отлавливают из водоемов любым способом и в закрытых банках, ведрах и других сосудах доставляют в лабораторию.
Смывы с объектов окружающей среды берут ватным или марлевым тампоном, смоченным 1%-ной пептонной водой с поверхности площадью 0,5х0,5м2. Тампон опускают во флакон или пробирку с 1%-ной пептонной водой.
Остатки пищи в очаге и пищевые продукты по показаниям отбирают по 200 г сухих и 0,5 л жидких.
Исследование на холеру проводят в следующей последовательности.
Плановые исследования на холеру при осуществлении эпиднадзора проводят в бактериологических и специализированных лабораториях центров гигиены и эпидемиологии, лечебно-профилактических и противочумных учреждений по обычному графику работы. В очаге холеры лаборатории работают круглосуточно.
Для выделения холерных вибрионов используются следующие питательные среды: 1%-ная пептонная вода, щелочной агар, TCBS, СЭДХ. Применяют сухие среды производственного выпуска, имеющие контрольный номер ОБК или среды, приготовленные по рецептуре и технологии, предусмотренной действующей нормативно-методической документацией. Приготовленные в лаборатории питательные среды и ингибиторы посторонней микрофлоры, используемые для диагностики холеры, подлежат бактериологическому контролю в специализированных лабораториях в установленном порядке.
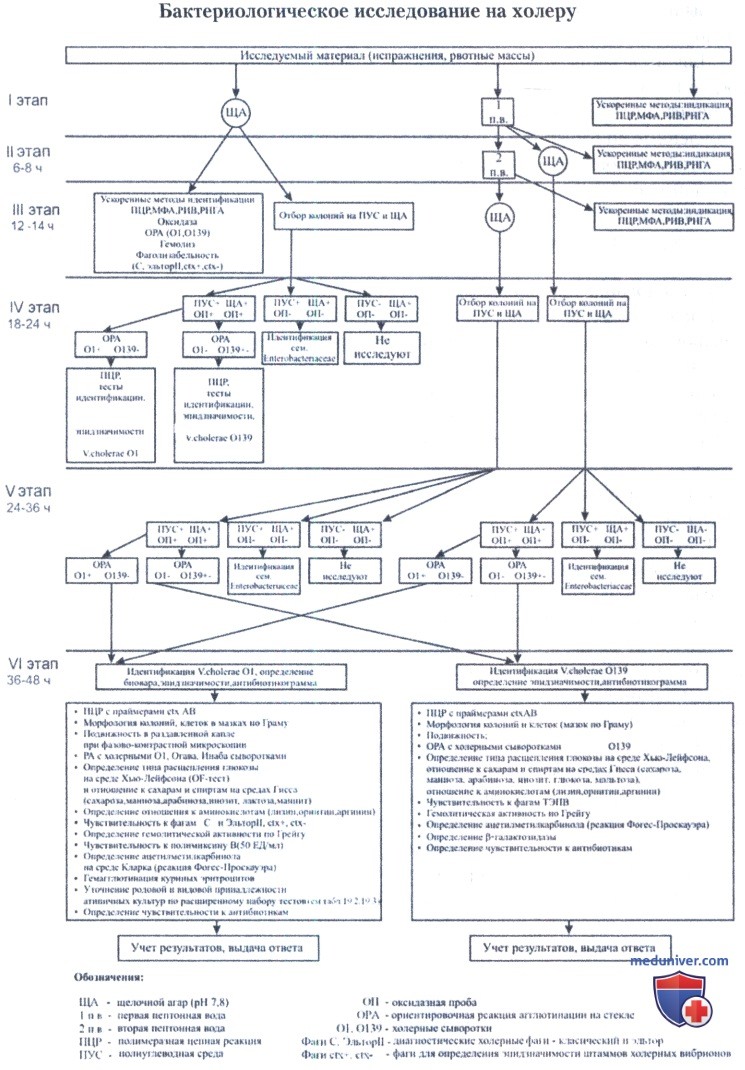
а) Исследование клинического (секционного) материала:
I этап. Материал (испражнения, рвотные массы, содержимое кишечника или желчного пузыря, суспензия слизистой тонкого кишечника трупа) в количестве 0,5-1,0 мл засевают в 50-100 мл 1%-ной пептонной воды (первая среда накопления), бактериологической петлей на щелочной агар и одну из элективно-дифференциальных сред (TCBS или СЭДХ). Посевы инкубируют при температуре 37°С в течение 6-8 ч для пептонной воды, 14-16 ч — для щелочного агара и 18-20 ч — для СЭДХ, TCBS.
При исследовании нативного материала от больных с подозрением на холеру применяют экспрессные и ускоренные методы диагностики:
1. МФА (метод флуоресцирующих антител). Из нативного материала бактериологической петлей (d 2 мм) на предметном стекле готовят мазок, высушивают на воздухе и фиксируют в 96°-ном этиловом спирте 20 минут. Затем фиксированный и высушенный мазок помещают во влажную камеру — чашку 11етри с кусочком смоченной в воде ваты, пастеровской пипеткой наносят на него каплю рабочего разведения холерных 01 и 0139 флуоресцирующих антител на 20 мин, после чего мазок ополаскивают в дистиллированной воде и погружают на 10-15 мин в 0,9%-ный раствор хлорида натрия pH 7,3(±0,1). После этого препарат вновь ополаскивают дистиллированной водой и высушивают на воздухе.
Перед просмотром в люминесцентном микроскопе на мазок наносят каплю раствора глицерина (9 объемных частей глицерина и 1 часть фосфатного буферного раствора, pH 7,0±0), накладывают покровное стекло и просматривают с применением иммерсионного масла (на 1 мл иммерсионного масла добавляют 0,3 мл нитробензола). При учете результатов просматривают не менее 20 полей зрения. Специфическим считается свечение с яркостью на 4 и 3 креста, свечение с яркостью на 2 или 1 крест принято считать неспецифическим:
- 4 креста — яркая флуоресценция но периферии микробной клетки, четко контрастируемая с темным телом клетки;
- 3 креста — умеренная флуоресценция периферии микробной клетки;
- 2 или 1 крест — слабое свечение периферии клетки, не контрастируемое с телом клетки.
Обнаружение светящегося ореола (на 3-4 креста) хотя бы у 3-5 клеток в каждом поле зрения свидетельствует о наличии в исследуемом материале холерных вибрионов.
Отрицательный результат (1-2 креста) свидетельствует о полном отсутствии возбудителя холеры или о содержании его в исследуемом материале в низкой концентрации, не выявляемой иммунолюминесцентным методом при прямом исследовании пробы без обогащения или подращивания.
2. РИВ (реакция иммобилизации вибрионов) специфической O1 и O139 сывороткой. На дно чашки Петри пипеткой или петлей наносят раздельно 2 капли жидкого исследуемого материала (испражнения, рвотные массы или поверхностный слой среды обогащения), к одной из них добавляют каплю холерной сыворотки O1 в рабочем разведении и накрывают покровными стеклами. Раздавленную каплю изучают под микроскопом при увеличении х400-600, используя фазово-контрастное устройство или конденсор темного поля. При наличии в исследуемом образце холерных вибрионов 01 в контрольной капле (без сыворотки) наблюдают характерную подвижность, во второй — иммобилизацию отдельных микробных клеток и образование неподвижных микроагглютинатов сразу же или в течение 1-2 мин. В случае неспецифического взаимодействия с диагностическими сыворотками наблюдается образование мелких подвижных конгломератов при активной подвижности отдельных клеток. Реакция иммобилизации специфична и позволяет дать первый сигнальный ответ через 15-20 мин. При отрицательном результате исследование повторяют после подращивания в 1%-ной пептонной воде.
В случае отрицательного результата проводят аналогичное исследование с холерной сывороткой 0139 серогруппы в разведении 1:5.
3. РНГА (реакция непрямой гемагглютинации) с использованием диагностикумов эритроцитарных или полимерных холерных иммуноглобулиновых O1 или 0139 ставится в соответствии с наставлением к применению препаратов.
4. ПЦР (полимеразная цепная реакция) для обнаружения ctx-гена ставится в соответствии с наставлением к применению тест-систем.
II этап — через 6-8 ч от начала исследования. Производят высев с первой среды накопления на щелочной агар и в 5-8 мл второй среды накопления. Пересевы в жидкие и плотные среды делают с поверхности пептонной воды большой бактериологической петлей диаметром 5 мм. При отрицательных результатах исследования нативного материала МФА, ПЦР, РИВ, РНГА повторяют на данном этапе, используя для этого первую пептонную воду.
III этап — через 12-14 ч от начала исследования. Делают высев со второй пептонной воды на плотные питательные среды (щелочной агар). При исследовании нативного материала, посеянного на щелочной агар в начале исследования, отбирают подозрительные колонии для первичной идентификации на полиуглеводные среды (лактозосахарозную, Олькеницкого, Клиглера, МС и т.д.) и секторы щелочного агара. Если колоний всего 1-2, то этим и ограничиваются. Если колоний много (сливной рост чистой культуры микроорганизмов), то проводят тест на оксидазу, слайд-агглютинацию с холерными O1, Огава, Инаба, 0139 сыворотками, применяют МФА и ПЦР.
При отсутствии подозрительных колоний и положительных предварительных результатов в ГЩР, МФА, РИВ, РИГА проводят исследование второй пептонной воды этими же методами.
IV этап — через 18-24 ч от начала исследования. Производят отбор подозрительных на холерный вибрион колоний в посевах на плотные среды нативного материала, а также в высевах на щелочной агар из первой и второй пептонных вод.
Чашки с посевами просматривают в проходящем свете и под стереоскопическим микроскопом в косо проходящем свете, отбирают подозрительные на вибрионы колонии для выделения и идентификации культуры. Выросшие в типичной S-форме на щелочном агаре колонии холерных вибрионов — круглые, плоские, гладкие, голубоватые, гомогенные, с ровными краями, прозрачные в проходящем свете и светло-серые с голубым оттенком — под стереоскопическим микроскопом. Колонии холерных вибрионов на элективных средах TCBS и СЭДХ имеют ярко-желтую окраску на зеленом или синем фоне среды. Размеры не превышают 1 мм, а к 18-24 ч инкубации достигают 2-3 мм в диаметре.
Подозрительные колонии на щелочном агаре проверяют в слайд-агглютинации с сыворотками холерными O1 и O139 в рабочем разведении. При положительной реакции с холерной O1 сывороткой и достаточном количестве подозрительных колоний ставят слайд-агглютинацию с вариантоспецифическими сыворотками Инаба и Огава в рабочем разведении, окрашивают мазки флюоресцирующими холерными иммуноглобулинами и по Граму. При отрицательных результатах колонии, обнаруженные в посевах материала от больных, проверяют в слайд-агглютинации с холерной сывороткой РО (RO) в рабочем разведении. Вибрионы, выросшие на элективных средах нередко слабо агглютинируются специфическими сыворотками.
Положительная ориентировочная реакция агглютинации с холерной O1 сывороткой в разведении 1:100 и вариантоспецифической в разведении 1:50 или положительная реакция с флюоресцирующими иммуноглобулинами в сочетании с морфологическими, культуральными признаками и специфической иммобилизацией позволяют выдать предварительный ответ об обнаружении в исследуемом материале холерного вибриона O1, а в случае положительной реакции с сывороткой O139 — холерного вибриона O139 серогруппы.
Подозрительные на вибрионы колонии, агглютинирующиеся и не агглютинирующиеся холерными O1 и O139 сыворотками, отсевают на одну из двууглеводных сред (лактозосахарозную, глюкозолактозную, Клиглера, маннозосахарозную — МС) и на сектор пластинки щелочного агара для выделения чистой культуры, ее идентификации и определения чувствительности к антибиотикам.
V этап — через 24-36 ч от начала исследования.
Отбирают культуры для идентификации. На полиуглеводных средах отбирают культуры с типичными для вибрионов характером роста и изменениями. На двууглеводных средах (лактозосахарозной, глюкозолактозной и Клиглера) наблюдается характерное для кислой реакции изменение цвета столбика при сохранении цвета скошенной поверхности без образования газа и сероводорода. В маннозо-сахарозной среде за счет ферментации обоих углеводов окрашивается и столбик, и скошенная поверхность.
Культуры, выросшие на секторах щелочного агара, отбирают для идентификации по наличию индофенолоксидазной активности. На поверхность культуры, выросшей на щелочном агаре, наносят 1 каплю 1%-ного водного раствора диметилпарафенилендиамина, тетраметилпарафенилендиамина (гидрохлорида), этилоксиэтилпарафенилендиамина сернокислого или 1%-ного водного раствора парааминодиметиланилина (гидрохлорида или оксалата) в сочетании с 1%-ным спиртовым раствором а-нафтола или без него. Положительная реакция на индофенолоксидазу проявляется в ярко-красном окрашивании культуры в течение 20-30 с. При использовании реактива с α-нафтолом в положительных случаях наблюдается синее окрашивание культуры.
Для постановки пробы на оксидазу можно воспользоваться специальными бумажками из набора СИБ (система индикаторная бумажная) или пропитать помещенную в чашку Петри полоску фильтровальной бумаги 2-3 каплями 1%-ного водного раствора одного из упомянутых выше реактивов. Культуру наносят на полоску смоченной реактивом бумаги платиновой (но не хромоникелевой) петлей, стеклянной или деревянной палочкой и размазывают в виде небольшого пятнышка. О положительной реакции на индофенолоксидазу свидетельствует пурпурно-красное окрашивание пятна микробной массы через 20-30 с.
Проводят идентификацию культур по принадлежности их к роду Vibrio, виду V. cholerae, определяют биовар, антибактериальную чувствительность и эпидемическую значимость.
1. Определяют морфологию микроорганизмов и чистоту отобранных культур, выросших на щелочном агаре и полиуглеводных средах, при помощи окрашенных по Граму мазков.
2. Культуры, дающие характерные изменения на полиуглеводных средах и положительные в пробе на оксидазу, проверяют в ориентировочной реакции агглютинации (слайд-агглютинации) с холерными сыворотками O1, РО (UO), Огава, Инаба и 0139.
3. В случае положительного результата в слайд-агглютинации и при достаточном количестве бактериальной массы ставят развернутую реакцию агглютинации и учитывают по общепринятой методике в соответствии с инструкцией по применению диагностических сывороток O1, Огава, Инаба, РО (RO). Цельную сухую агглютинирующую холерную сыворотку предварительно растворяют дистиллированной водой, объем которой указан на этикетке ампулы, и титруют физиологическим раствором, начиная с разведения 1:50.
Предварительный учет результатов производят через 2 ч содержания при 37°С, окончательный — через 20 ч при комнатной температуре.
Для исключения спонтанной агглютинации рекомендуется ставить развернутую реакцию в 0,3%-ном растворе NaCl.
4. Производят посевы:
а) в жидкие или полужидкие среды Гисса с сахарозой, маннозой, арабинозой, маннитом, инозитом для выявления способности вибрионов ферментировать углеводы и многоатомные спирты, инкубируют при 37,0(±0,5)°С, результаты учитывают через 6-18 ч;
б) в пробирки со средой Хью-Лейфсона для определения типа расщепления глюкозы (культуру засевают уколом в столбик в 2 пробирки со средой Хью-Лейфсона, в одну из пробирок добавляют 0,5-1 мл стерильного вазелинового масла), инкубируют при температуре 37,0(±0,5)°С. Окисление определяют по желтой окраске среды только в аэробных условиях, ферментацию — в аэробных и анаэробных условиях роста. Вибрионы расщепляют глюкозу по ферментативному типу;
в) в пробирки со средой Меллера или приготовленной по другой прописи, содержащие лизин, орнитин, аргинин для определения декарбоксилазной и дигидролазной активности. В пробирки с аминокислотами и контрольную (без аминокислоты) засевают по полной петле 18-часовой агаровой культуры, заливают 0,5-1мл стерильного вазелинового масла. Инкубируют при температуре 37,0(±0,5)°С в течение 3 сут. Учет проводят ежедневно. В результате ферментации глюкозы вначале (в первые сутки) происходит сдвиг pH в кислую сторону, а в дальнейшем при декарбоксилировании аминокислот накапливаются амины и происходит защелачивание среды. Возбудители холеры декарбоксилируют лизин и орнитин через 18-24 ч и не обладают дигидролазой аргинина;
г) в среду Кодама или Гисса с крахмалом для определения диастатической активности вибрионов, инкубируют при 37,0(±0,5)"С 18 ч, затем в посев добавляют 2-3 капли раствора Люголя. При разложении крахмала среда не окрашивается;
д) в столбик желатины уколом для определения протеолитической активности вибрионов, инкубируют при 37,0(±0,5)°С 18-20 ч. Перед учетом результатов пробирки помещают в холодильник на 20 мин. При положительном результате желатина остается жидкой, а при отрицательном (и в контрольной пробирке) — затвердевает;
е) в пробирки с мясопептонным бульоном или бульоном Хоттингера с индикаторными бумажками для определения образования сероводорода, инкубируют 18 ч при 37,0(±0,5)°С. При образовании сероводорода индикаторные бумажки чернеют;
ж) в пробирки с 1%-ной пептонной водой, бульоном Хоттингера или мясопептонным бульоном с индикаторными бумажками для выявления индола, инкубируют 18 ч при 37,0(±0,5)°С. При наличии индола индикаторные бумажки розовеют;
з) в 4-5 мл мясопептонного бульона или сердечно-мозгового настоя для последующей постановки пробы Грейга с 18-24-часовой культурой;
и) в 3 мл мясопептонного бульона для постановки пробы с фагами, определения чувствительности к полимиксину В с 3-часовой культурой;
к) в столбики полужидкого агара для хранения и передачи в регламентированном порядке выделенных штаммов холерных вибрионов, а также высева с целью повторения сомнительных тестов или дополнительного изучения культур.
5. Ставят тесты дифференциации биоваров V. cholerae O1 серогруппы:
а) определяют чувствительность к диагностическим холерным фагам, классическому и эльтор (по методу Грациа). При оценке результатов проб с фагами ориентируются на диагностический рабочий титр (ДРТ) фагов. Определение чувствительности к фагам проводят как с цельными препаратами, так и с их 10-кратными разведениями до ДРТ в мясопептонном бульоне. Для постановки реакции в чашки разливают щелочной агар. После застывания агара и подсушивания его в течение 30 мин при температуре 37°С дно чашек делят на квадраты по количеству образцов фагов и их 10-кратных разведений. В пробирку с 5 мл 0,5-0,7%-ного питательного агара, расплавленного и охлажденного до 45°С, добавляют 0,1-0,2 мл 3-4-часовой бульонной культуры, тщательно смешивают и выливают на поверхность агара.
Чашки оставляют при комнатной температуре с приоткрытыми крышками на 30 мин. В центр квадратов наносят штампом-репликатором, стандартной петлей или тонко оттянутой пастеровской пипеткой по капле фагов в соответствующих разведениях. После подсыхания капель чашки переворачивают вверх дном и помещают в термостат при температуре 37,0(±0,5)°С. Результаты учитывают через 3-4 и 18-20 ч. Наличие лизиса в виде одного «стерильного» пятна или группы мелких негативных колоний оценивается как положительный результат;
б) определяют чувствительность к полимиксину В. В расплавленный и остуженный до 45°С питательный агар pH 7,2(±0,1) добавляют полимиксин В из расчета 50 единиц на 1 мл среды. После тщательного перемешивания среду разливают в чашки Петри. На застывшие агаровые пластинки наносят обычной бактериологической петлей 18- или 3-часовую бульонную культуру. Результаты учитывают после инкубирования посевов при температуре 37°С в течение 18 ч. Холерные вибрионы биовара cholerae не растут на полимиксиновом агаре, для холерных вибрионов биовара eltor признак вариабелен;
в) ставят реакцию гемагглютинации. На предметное стекло в чашке Петри помещают каплю 0,9%-ного раствора хлорида натрия и суспендируют в ней петлей 18-часовую агаровую культуру. Затем добавляют каплю 2,5%-ной взвеси куриных эритроцитов, трижды отмытых 0,9%-ным раствором хлорида натрия. Стекло покачивают до смешивания взвеси эритроцитов и вибрионов. При положительной реакции в течение 1 мин наступает склеивание эритроцитов. Реакцию сопровождают двумя контролями: капля 0,9%-ного раствора хлорида натрия + капля 2,5%-ной взвеси эритроцитов; капля 0,9%-ного раствора хлорида натрия + испытуемая культура. Контроли должны быть отрицательны. Для постановки пробы могут быть использованы эритроциты морской свинки;
г) ставят реакцию Фогес-Проскауэра (на ацетилметилкарбинол). Испытуемую культуру засевают в глюкозофосфатный бульон Кларка и инкубируют при температуре 37,0(±0,5)°С в течение 1-3 сут. Затем к 1 мл культуры добавляют 0,6 мл 6%-ного спиртового раствора альфа-нафтола и 0,4 мл 40%-ного раствора едкого калия. Пробирки встряхивают и помещают в термостат на 1 ч. При положительной реакции среда окрашивается в розовый или ярко-красный цвет.
6. Определяют эпидемическую значимость холерных вибрионов:
а) определяют гемолитическую активность по Грейгу. К 1 мл 18-24-часовой культуры, выращенной в 4-5 мл мясопептонного бульона или сердечно-мозгового настоя, добавляют 1 мл 1%-ной взвеси трижды отмытых эритроцитов барана в физиологическом растворе. Смесь микробов и эритроцитов осторожно перемешивают встряхиванием и помещают на 2 ч в термостат при температуре 37,0(±0,5)°С, затем в холодильник на 16-18 ч. Предварительный учет результатов проводят через 2 ч, окончательный — на следующий день. При положительной реакции наступает полный или частичный лизис эритроцитов (лаковая кровь). В контроле (1 мл бульона + 1 мл взвеси эритроцитов) и при отрицательной реакции гемолиз отсутствует, эритроциты в виде пуговки оседают на дно пробирки;
б) определяют эпидемическую значимость холерных вибрионов эльтор комплексным методом (ориентировочно). По лизису фагами вирулентности ctx+ и ctx— и гемолитической активности в пробе Грейга холерные вибрионы можно отнести к эпидемически опасным, эпидемически неопасным или к требующим дополнительных исследований для заключения об их эпидемической значимости. Последние подлежат изучению на наличие генов ctx, tcp методом ПЦР или определению токсигенности методом биотестирования на кроликах-сосунках. Методика постановки пробы с фагами ctx+ и ctx- и критерии оценки результатов описаны в инструкции к ним;
в) ПЦР с целью выявления ctx гена, кодирующего выработку холерного энтеротоксина, проводят в соответствии с инструкцией к применению тест-систем. Ее постановка возможна на различных этапах выделения культуры, что позволяет дать соответствующее заключение в отведенные для исследования клинического материала сроки;
г) определение токсигенности холерных вибрионов на модели кроликов-сосунков проводят лаборатории, имеющие разрешение на экспериментальную работу с возбудителем холеры.
7. Определяют антибиотикочувствительность. Для этой цели используют дискодиффузионный метод и метод серийных разведений. Для постановки пробы с антибиотиками используют специально определенные для этой цели питательные среды — агар Мюллера-Хинтона или среду АГВ. Для определения антибиотикограммы культур холерного вибриона следует использовать диски не менее 4 групп антибактериальных препаратов: фторхинолоны — ципрофлоксацин, офлоксацин, ломефлоксацин; левомицетин (хлорамфеникол); рифампицин; тетрациклин, доксициклин. Постановку и учет результатов проводят в соответствии с действующими методическими документами.
VI этап — через 36-48 ч от начала исследования. Учитывают результаты идентификации и выдают окончательный ответ о выделении культуры холерного вибриона с указанием серогруппы, биовара, серотипа, эпидзначимости (по результатам ПЦР) и антибиотикограммы.
Культуры, определенные как грамотрицательные, аспорогенные, полиморфные палочки, слегка изогнутые или прямые, активно подвижные, с одним полярно расположенным жгутиком, образующие индофенолоксидазу, ферментирующие глюкозу в аэробных и анаэробных условиях до кислоты (без газа), расщепляющие маннит, маннозу, сахарозу, но не активные в отношении к арабинозе, лактозе, инозиту, декарбоксилирующие лизин и орнитин, но не обладающие дигидролазой аргинина, образующие индол и не продуцирующие сероводород, агглютинирующиеся Ol, Огава или Инаба холерными сыворотками в диагностических титрах, чувствительные к 50 ЕД полимиксина В и классическому монофагу С, не агглютинирующие куриные эритроциты и не образующие ацетилметилкарбинол, идентифицируются как Vibrio cholerae 01, biotype cholerae, Ogawa (Inaba, Hikojima).
Культуры, соответствующие критериям вида Vibrio cholerae O1, агглютинирующиеся O1 сыворотками, но не чувствительные (реже чувствительные) к 50 ЕД полимиксина В, лизирующиеся бактериофагом эльтор II, агглютинирующие куриные эритроциты и образующие ацетилметилкарбинол, идентифицируются как Vibrio cholerae O1, biotype eltor, Ogawa (Inaba, Hikojima).
Культуры, соответствующие виду V. cholerae и агглютинирующиеся холерной сывороткой O139 серогруппы, идентифицируют как Vibrio cholerae O139 «Бенгал».
Холерные вибрионы O1 (эльтор) и O139 серологических групп оцениваются по их эпидемической значимости: холерные вибрионы эльтор и O139 «Бенгал» являются эпидемически значимыми (эпидемическими), если они гемолитически не активны (Н1у-) по отношению к эритроцитам барана или козы в пробе Грейга и содержат, поданным ПЦР, в своем геноме ген, ответственный за продукцию энтеротоксина (ctx+).
Ориентировочно эпидемическую значимость холерных O1 вибрионов определяют комплексным методом с использованием пробы Грейга и холерных эльтор ctx+ и ctx- фагов, холерных вибрионов O139 — пробы Грейга.
Культуры вибрионов, соответствующие критериям рода и вида Vibrio cholerae, но не агглютинирующиеся холерными диагностическими сыворотками O1 и O139 серогрупп, идентифицируются как V. cholerae non 01/0139.
Определенные трудности для идентификации представляют штаммы холерных вибрионов, измененные: а) по культурально-морфологическим признакам: колонии шероховатые, мутные, пигментированные, карликовые; в мазках — удлиненные, спиралевидные, шаровидные клетки; б) по биохимическим свойствам (ослабление или утрата способности расщеплять углеводы и многоатомные спирты — маннит, маннозу, сахарозу, аминокислоты.
Во всех случаях выделения атипичных культур определяют признаки принадлежности микроорганизмов к роду Vibrio и виду V. cholerae (оксидаза +, лизин +, орнитин +, аргинин окисление-ферментация на среде Хью-Лейфсона).
Культуры вибрионов, обладающие признаками рода Vibrio и вида V. cholerae, агглютинирующиеся сыворотками O1 до S титра, лизирующиеся диагностическими фагами в ДРТ, следует относить к серовару O1; они исследуются в ПЦР для выявления ctx гена.
Признаки, позволяющие отдифференцировать род Vibrio от других родов семейства Vibrionaceae и некоторых семейств других бактерий, представлены в таблице ниже.
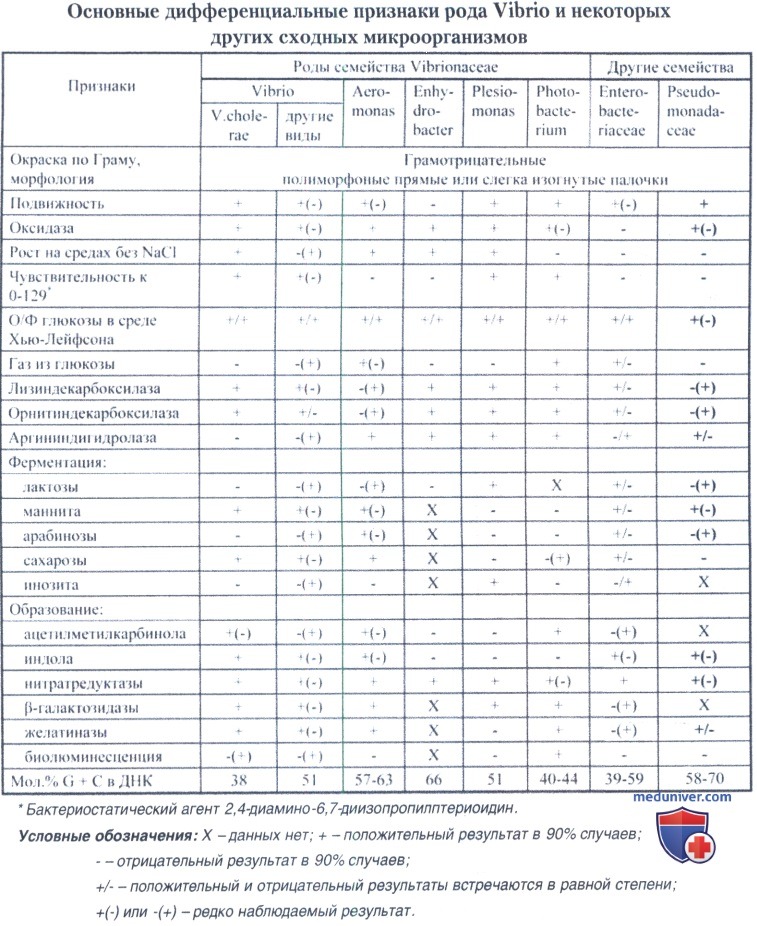
Наличие индофенолоксидазы позволяет отличать семейство Vibrionaceae, равно как и род Vibrio cholerae от семейства Enterobacteriaceae, а ферментация глюкозы без газа в анаэробных условиях — от семейства Pseudomonadaceae, отсутствие дигидрола-зы аргинина — от родов Aeromonas и Plesiomonas, а также от отдельных видов рода Vibrio.
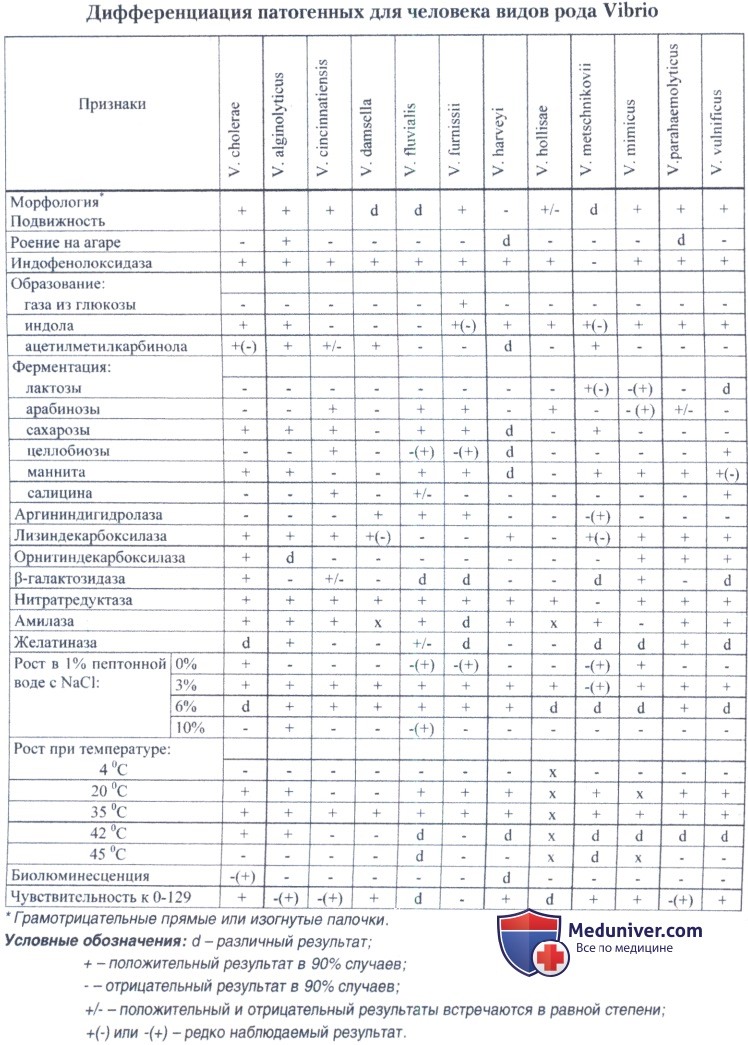
Дифференцирующие признаки вида Vibrio cholerae от других патогенных для человека вибрионов приведены в таблице 19.3.
б) Формулировка ответа. Положительный результат может быть предварительным и окончательным.
Положительный предварительный ответ выдают по результатам ускоренного исследования материала при помощи иммунофлуоресцентного метода, специфической иммобилизации, РИГА или по слайд-агглютинации сыворотками O1, O139 подозрительных на холерный вибрион колоний. Предварительный ответ сообщают устно, только в случаях проведения срочных анализов и совпадения результатов не менее 2 методов.
Положительный окончательный ответ выдают через 36-48 ч по результатам полной, сокращенной или ускоренной идентификации выделенной культуры с определением вида, серогруппы (и сероварианта для O1), биовара, эпидемической значимости и антибиотикограммы.
При проведении массовых исследований в очаге холерной инфекции, когда первые культуры холерных вибрионов уже были идентифицированы по расширенной схеме, ответ выдается по результатам слайд-агглютинации с холерными сыворотками O1, Огава, Инаба или 0139.
В общем ответ выглядит следующим образом:
При исследовании (испражнений, рвотных масс) больного (ФИО) выделены:
1) Vibrio cholerae O1, biotype cholerae (эпидемический штамм);
2) Vibrio cholerae O1, biotype eltor, Hly-, ctx+ (эпидемический штамм);
3) Vibrio cholerae O1, biotype eltor, Hly+, ctx- (неэпидемический штамм);
4) Vibrio cholerae 0139 Hly-, ctx+ (эпидемический штамм);
5) Vibrio cholerae 0139 Hly+, ctx- (неэпидемический штамм).
В ответе указывается также антибиотикограмма выделенного штамма холерных вибрионов.
Отрицательный результат выдают через 36-48 ч — только после окончания исследований по полной схеме.
в) Исследование объектов окружающей среды. Схема исследования объектов окружающей среды отличается от приведенной выше только на I этапе.
1. Вода. В зависимости от времени доставки пробы возможны варианты посевов:
а) к исследуемой воде добавляют основной раствор пептона (ОРИ) до 1%-ной концентрации, определяют pH, в случае необходимости подщелачивают 10%-ным раствором едкого натра до pH 8,4(±0,1). Время инкубации в первой среде накопления - 8-10 ч. Объем второй среды накопления — 10 мл 1%-ной пептонной воды; время инкубации в среде без теллурита калия 6 ч, а с теллуритом калия (1:100 000 — 1:200 000) для ингибиции посторонней микрофлоры — 18-20 ч;
б) в исследуемую воду добавляют ОРП до 1%-ной концентрации и теллурит калия из рабочего разведения 1:1000 до концентрации 1:100 000 или 1:200 000 в соответствии с данными проверки. Устанавливают pH 8,4(±0,1). Время инкубации — 18-24 ч. Вторая среда накопления — 10 мл 1%-ной пептонной воды без теллурита калия, время инкубации 6-8 ч. Исследование проб воды можно также проводить с использованием в качестве ингибитора посторонней микрофлоры моющего средства «Прогресс» в концентрации 0,1-0,2%;
в) после добавления основного раствора пептона до 1%-ной концентрации и установления щелочной реакции пробы сохраняют при комнатной температуре (не выше 25°С) до утра (первая среда накопления). В начале следующего дня засевают 5 мл поверхностного слоя в 100 мл 1%-ной пептонной воды (вторая среда накопления) и делают высев на щелочной агар; высев со второй среды накопления производят через 6-8 ч инкубации;
г) воду фильтруют через мембранные фильтры №2 или №3, смыв с которых высевают в накопительную среду (1%-ную пептонную воду) и на агаровые пластинки. Из смыва с фильтра можно делать мазки для окраски флюоресцирующими холерными иммуноглобулинами, ставить РИГА, ПЦР.
При интенсивном бактериальном загрязнении проб можно использовать третью среду накопления.
2. Хозяйственно-бытовые сточные воды при необходимости фильтруют через бумажный или матерчатый фильтр для освобождения от механических примесей, добавляют основной раствор пептона (ОРП) до 1%-ной концентрации, устанавливают pH 8,4(±0,1) и инкубируют в объемах до 500 мл 8-10 ч (первая среда накопления) или с добавлением теллурита калия 1:100 000 — 1:200 000 — 18-24 ч. При заборе сточных вод марлевыми тампонами последние помещают в широкогорлые колбы или банки с накопительной средой (500 мл 1%-ной пептонной воды) и далее пробы исследуют, как указано выше.
3. Пищевые продукты. Безалкогольные напитки исследуют тем же методом, что и воду.
Молоко в количестве 5 мл засевают в 50-100 мл среды накопления (1%-ную пептонную воду) или к 0,5 мл молока добавляют ОРП до 1%-ной концентрации его в молоке. Другие молочные продукты (кефир, сметану, творог, мороженое и т.д.) в количестве 5-10 мл засевают в 1%-ную пептонную воду.
Твердые пищевые продукты измельчают, растирают в ступке с физиологическим раствором, засевают в количестве 10,0 г в 100 мл накопительной среды и петлей на агаровые среды.
Масло засевают в жидкую среду накопления (1%-ную пептонную воду) в количестве 5-10,0 г, размягчив его в термостате, или делают посев смыва с поверхности его кусков.
После посева продукта устанавливают pH среды 8,4(+0,1).
4. Смывы с объектов внешней среды засевают в 1 %-ную пептонную воду и исследуют по обычной схеме.
5. Исследование материала от людей и объектов внешней среды можно проводить с использованием 1%-ной пептонной воды высокой щелочности — pH 9,5(±0,5). Пептонную воду подщелачивают до необходимого уровня pH при помощи 10-20%-ного раствора NaOH. ОРП и 1%-ную пептонную воду pH 9,5(±0,5) можно готовить впрок по общепринятой методике с подщелачиванием до необходимого уровня и последующей стерилизацией при 120°С 20 мин. Пептонную воду с повышенной pH в качестве накопительной среды рекомендуется использовать только на I этапе исследования с удлинением срока инкубации ее до 18-24 ч. Дальнейшее исследование проводят по схемам второго и последующего этапов.
г) Серологическая диагностика. Для серологической диагностики холеры используют иммунологические реакции, выявляющие в сыворотке больных, переболевших, вибриононосителей специфические антитела: агглютинины (ставится развернутая диагностическая реакция агглютинации с выявленными в данной эпидемической вспышке штаммами холерных вибрионов; РНГА с антигенным холерным диагностикумом; реакция нейтрализации антигена — РНАг для выявления антител в сыворотке крови с использованием холерного иммуноглобулинового эритроцитарного диагностикума); вибриоцидины (в реакции определения вибриоцидных антител — РВА); антитоксины (определяют токсин-нейтрализующие антитела в сыворотке крови в РНГА с эритроцитарным холерным энтеротоксическим диагностикумом — ЭХЭД).
Все эти методы разработаны в 70-80-х гг. прошлого столетия и являются вспомогательными для диагностики холеры, хотя в некоторых случаях дают ценную информацию для окончательной постановки диагноза.
Перспективными в настоящее время являются такие серологические методы диагностики холеры, как РНАг и определение токсин-нейтрализующих антител в сыворотке крови при помощи ЭХЭД и ЛХЭД (липосомальный холерный эритроцитарный диагностикум).
- Читать далее "Лечение и профилактика холеры"
Редактор: Искандер Милевски. Дата публикации: 9.1.2020
- Возбудитель холеры (Vibrio cholerae): таксономия
- Морфологические и культуральные свойства холерных вибрионов (V. cholerae)
- Антигены и факторы патогенности холерного вибриона (V. cholerae)
- Клинические проявления холеры и степени обезвоживания по Покровскому
- Эпидемиология холеры
- Микробиологическая диагностика возбудителя холеры (V. cholerae)
- Лечение и профилактика холеры
