Характеристика основных групп альфа-зеленящих стрептококков
Основные дифференциальные признаки альфа-зеленящих стрептококков, имеющих медицинское значение, представлены в таблице ниже.
а) Группа Sanguinis. Streptococcus sanguis — наиболее важный и вездесущий представитель стабилизирующей микрофлоры организма. Начиная с момента прорезывания зубов у ребёнка, S. sanguis постоянно выделяется из зубных отложений, где на долю этого вида приходится почти половина биомассы; несколько реже они высеваются из слюны, слизи глотки и фекалий человека. В других участках слизистой оболочки организма он обнаруживается реже и в меньших количествах. Имеется сообщение о выделении S. sanguis из почвы.
С помощью ДНК-ДНК-гибридизации выявлены две группы, проявляющие 85-100% внутригрупповой и 40-60% межгрупповой гомологии. Первоначально из-за отсутствия фенотипических различий большинство специалистов не поддержали предложение о выделении двух подвидов данного вида (subsp. sanguis и subsp. carlssonii). В последующем на основании фенотипических характеристик выявлено два кластера стрептококков, получивших самостоятельные видовые наименования: S. sanguis и S. gordonii. В первом из них (S. sanguis) по биохимическим и серологическим свойствам выявлены четыре биовара. У типового штамма, отнесенного к 1-му биовару, отсутствует способность ферментировать несколько углеводов, обычно расщепляемых этим видом. Биовар 4 обладает уникальным типом IgA1-протеазы. Высказано мнение, что он может быть рассмотрен как отдельный вид стрептококков.
S. sanguis образует длинные и средние цепочки из округлых или овальных клеток, чаще даёт а-, реже — (3-гемолиз на кровяном агаре. Редко встречаются негемолитические у-варианты.
Конечное значение pH при выращивании в бульоне с глюкозой — 4,6-5,2. Кислота образуется из глюкозы, мальтозы, сахарозы, салицина и, как правило, из трегалозы. Арабиноза, ксилоза, глицерин и маннит обычно не ферментируются.
Продуцирует внеклеточные нерастворимые и растворимые гликаны из сахарозы, что обеспечивает его прилипание к поверхности зубов. Кроме того, активно продуцирует кислоты из сахаров. Следовательно, можно сделать вывод, что S. sanguis обладает свойствами, аналогичными другому кариесогенному виду — S. mutans, однако, встречается в гораздо большем количестве. Некоторые исследователи оспаривают его кариесогенную роль, так как он не образует весь спектр резервных полисахаридов, свойственных S. mutans. Однако было показано, что S. sanguis способен вызывать кариес зубов в экспериментах на гнотобионтах.
Возрастание утилизации сахаров после приёма пищи, происходящее под действием кариесогенной микрофлоры, получило название метаболического взрыва. Именно это явление, сопряженное с двумя важнейшими микробными процессами — усилением синтеза органических кислот, с одной стороны, и резкой активацией поглощения фосфатов за счёт субстратного фосфорилирования, с другой — являются основным фактором дестабилизации гидроксиаппатита эмали (твёрдой кристаллической структуры, покрывающей поверхность зуба). Следует признать, что в силу значительной доли S. sanguis в биоплёнке зуба он вносит существенный вклад в процессы, сопряжённые с деминерализацией эмали зуба.
Данный вид занимает ведущее место в ассоциациях микроорганизмов, выделяемых из гнойного экссудата при воспалительных процессах, особенно челюстно-лицевой области, включая одонтогенные абсцессы мозга и других органов. Установлена связь L-форм этого вида с рецидивирующим афтозным стоматитом. Вместе с тем, S. sanguis могут быть выделены из крови и сердечных клапанов при инфекционных эндокардитах, со слизистой оболочки дыхательного тракта, из мокроты и бронхиального секрета при пневмонии, из ликвора при менингитах.
Среди других видов группы Sanguinis, имеющих медицинское значение, следует назвать: S. parasanguis (выделяют на основании ДНК/ДНК гибридизации и секвенирования последовательностей 16S рРНК), Streptococcus gordonii (отличается от S. sanguis отсутствием IgAl-протеазной активности, способностью ферментировать амигдалин, наличием b-глюкозамидазы, β-маннозидазы, a-L-фукозидазы и щелочной фосфатазы)
S. parasanguis изолируют из клинического материала от людей (при воспалительных процессах в глотке, из крови и мочи) в случае подострого эндокардита. S. gordonii входит в состав нормофлоры ротоглотки человека. Полагают, что S. gordonii может быть использован как носитель (вектор) антигенов при разработке вакцин для профилактики диареи путешественников. S. gordonii может вызывать инфекционный эндокардит, описан случай перитонита.
б) Группа Salivarius. S. salivarius — важнейший компонент микробиоценоза полости рта человека, который в небольшом количестве также может встречаться на слизистой оболочке дыхательного, урогенитального и желудочно-кишечного тракта.
Результаты анализа генов 16S рРНК и фенотипических характеристик свидетельствуют, что группа Streptococcus salivarius тесно связана с группой S. bovis-S. equinus-S. gallolyticus. Некоторые штаммы всех видов этой группы агглютинируются сывороткой серогруппы D. Эти стрептококки формируют отдельный гомогенный кластер, отдаленный от других видов стрептококков, обитающих в полости рта. С помощью ДНК-рРНК-гибридизации S. salivarius и S. thermophilus установлено, что эти виды не только тесно связаны между собой, но близкородственны с S. bonis и S. equinus.
Большинство штаммов S. salivarius на агаре с кровью не способны к гемолизу (гемолитические варианты выявляются редко). На плотных средах растут в виде гладких и шероховатых колоний; при пересевах в бульоне шероховатые варианты часто реверсируют в гладкие формы. На сахарозном агаре большинство колоний образуют растворимый фруктан (леван), в результате чего наблюдается формирование мукоидных колоний. Некоторые штаммы синтезируют также нерастворимые глюканы (декстраны). На агаре с сахарозой формируют гладкие или шероховатые колонии, что зависит от соотношения внеклеточных полисахаридов, синтезируемых микроорганизмами.
Конечное значение pH в бульоне с глюкозой — 4,0-4,4. Кислота образуется из глюкозы, сахарозы, мальтозы, раффинозы, инулина, салицина и обычно из трегалозы и лактозы, но не из глицерина, маннита, сорбита, ксилозы или арабинозы. Большинство штаммов гидролизуют эскулин и мочевину, но не аргинин.
S. salivarius подразделяют на два серовара по структуре К-антигена. Штаммы S. salivarius серовара I обычно реагируют с групповой сывороткой К и перекрестно — с сывороткой против S. anginosus или S. milleri. Штаммы S. salivarius типа II не реагируют ни с одной из этих сывороток. Приблизительно 50 % штаммов S. salivarius клинического происхождения агглютинируются групповой сывороткой К.
S. salivarius выделяют от человека и животных, особенно часто при анализе микрофлоры языка, слюны, фекалий человека. Редко высевают из крови при эндокардитах, септицемии, менингите.
К другим представителям данной группы, имеющим медицинское значение, следует отнести также S. vestibularis (гидролизуют эскулин, мочевину, крахмал, но не аргинин, образуют перекись водорода, обычно дают положительную реакцию Фогеса-Проскауэра, не образуют внеклеточный глюкан или фруктан из сахарозы), S. infantarius (негативные в тесте с эскулином), S. lutentiensis (позитивные в тесте с эскулином), S. thermophilus (выделяют из пастеризованного молока и выдерживают нагревание до 50-60°С). Роль данных видов в патологии не доказана. Они составляют часть нормальной микрофлоры человека и крупных млекопитающих (коровы, свиньи). В настоящее время S. thermophilus широко используется при терапии диарей различной этиологии в составе пробиотиков.
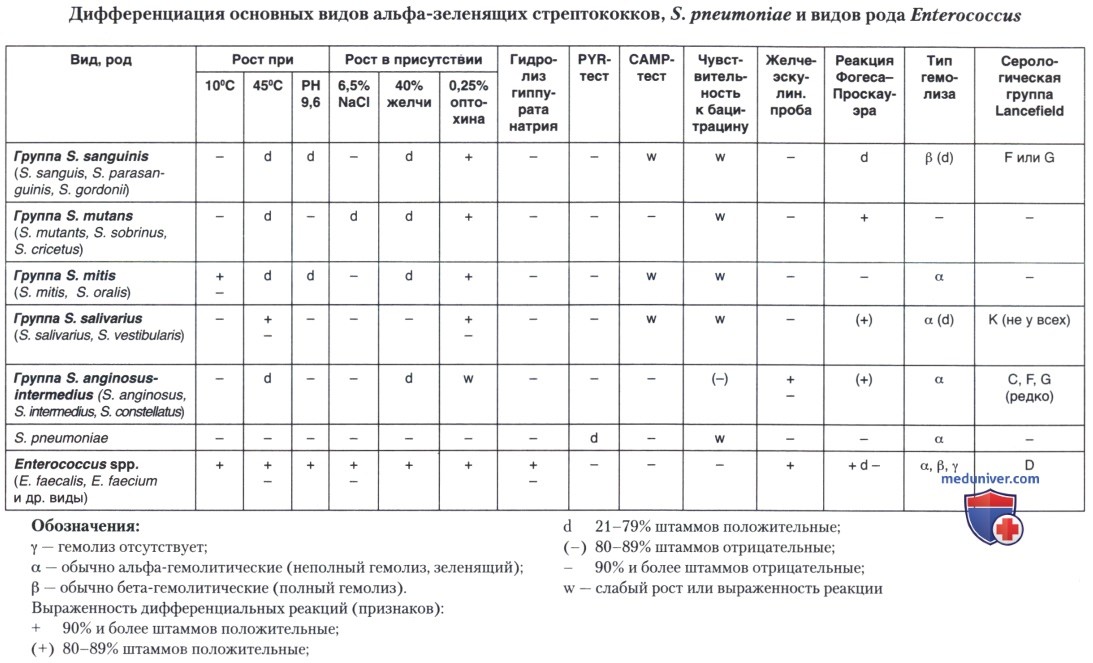
в) Группа Mutans. S. mutans впервые описан J. Kilian Clarke в 1924 г. Он был выделен из дентина кариозной полости. Выделяется с поверхности зубов и из фекалий.
Морфология: короткие или средние цепочки парных кокков, длину которых резко увеличивает добавление сахарозы к питательной среде.
На агаре с кровью обычно проявляют α-, очень редко — β-гемолиз. Большинство штаммов образуют кислоту из маннита, сорбита, раффинозы, лактозы, инулина, салицина, маннозы и трегалозы, но не арабинозы, ксилозы, глицерина или мелизитозы. Не образуют аммиак из аргинина, гидролизуют эскулин, но не гиппурат или желатину.
S. mutans — кариесогенный вид, потому что способен продуцировать огромное количество кислот (прежде всего, молочную кислоту) при метаболизме сахаров. Вызывает деминерализацию эмали зубов и их кариес. Он активно продуцирует растворимые и нерастворимые внеклеточные полимеры (глюкан, мутан, фруктан), играющие основную роль в адгезии микроба к эмали. До появления молочных зубов этот вид в полости рта не обнаруживается. Колонизации зубов способствует высокое содержание в диете сахарозы.
S. mutans как возбудитель кариозного процесса имеет широкий набор генетически детерминированных факторов патогенности, играющих роль как в адгезии к эмали зуба, так в процессах деминерализации и деструкции органической основы зуба.
С точки зрения развития кариеса особенно важны следующие два признака:
1) способность S. mutans образовывать из сахарозы пищи нерастворимые полимеры, способствующие постоянной колонизации твердых поверхностей (эмали зуба и реставрационных материалов — пломб);
2) выживание S. mutans в кислой среде, токсичной для большинства остальных микробов ротовой полости. Способность к адаптации в кислой среде — основа патогенного потенциала S. mutans.
S. mutans способен также метаболизировать ряд других сахаров с образованием органических кислот. При высокой концентрации углевода он продуцирует преимущественно молочную кислоту, которая быстро закисляет среду вокруг клетки. Если не удалять физически эти клетки, зубная бляшка будет расти (за счет роста S. mutans, привлечения других бактерий, белков слюны, остатков пищи) и повышать кислотообразование. Кариес характерен для индустриализированного общества, где наиболее выражено потребление сахара. Не удивительно, что в ходе эволюции этот микроорганизм стал своего рода «сахароперерабатывающей фабрикой» — его внеклеточные функции и метаболизм направлены на утилизацию привычного в питании субстрата (R. G. Quivey, Jr.).
Сероспецифические полисахаридные антигены S. mutans представляют собой основу полирамнозного скелета, идентичного рамнозо-глюкозному полисахаридному антигену близкородственного вида - S. sobrinus (см. ниже), а также и группоспецифическому полисахариду стрептококков серогрупп А, С или Е. У штаммов, выделяемых из полости рта людей, выявлены три серотипа S. mutans (с, е и f). Кроме того, молекулярно-биологическими методами установлено, что этот вид стрептококков имеет также 4 риботипа.
Являясь одним из основных этиологических агентов кариеса зубов, S. mutans может вызывать бактериемию и эндокардиты, подобно другим видам оральных стрептококков. Однако удельный вес таких инфекций невелик.
Аналогичное медицинское значение имеет прежде всего то, что этиологическую роль в развитии кариеса зубов играет еще один стрептококк этой группы, выделенный в самостоятельный вид — S. sobrinus. Ранее S. sobrinus рассматривали как биовар S. mutans. На агаре с кровью некоторые штаммы этого вида проявляют альфа-гемолитическую активность, другие гемолиз не вызывают. Образуют кислоту из маннита, инулина и лактозы, не образуют аммиак из аргинина, не гидролизуют эскулин. Штаммы, описанные как S. sobrinus, обычно реагируют с сыворотками типов d и g против S. mutans. Однако типовой штамм S. sobrinus SL1 не обладает ни d-, ни g-типовыми антигенами. К основным атрибутам вирулентности 5. sobrinus и других кариогенных видов стрептококков относят толерантность к кислоте.
Другие представители этой группы — S. ratti u S. cricetus (последний является представителем микрофлоры полости рта хомячков, диких крыс и транзиторным для человека) и ряд видов, характерных для микрофлоры полости рта обезьян (S. downei,
S. ferns и S. macacae), и медицинского значения, по-видимому, не имеют.
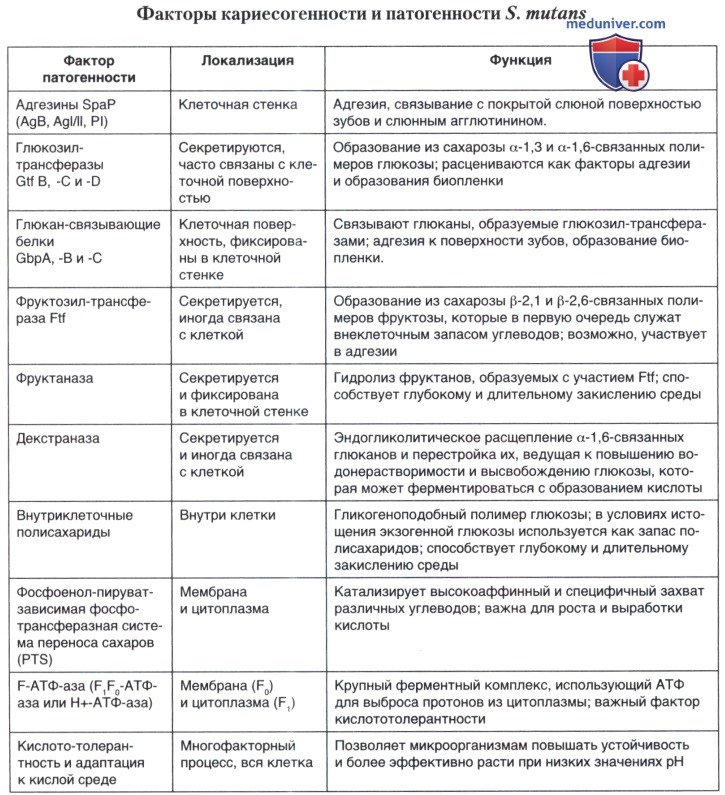
г) Группа Mitis. S. mitis на основании изучения физиологических, биохимических и серологических свойств соответствует характеристикам основного вида, стабилизирующего микрофлору полости рта — S. sanguis. Однако данные ДНК-ДНК-гибридизации показали, что этот штамм лишь частично гомологичен S. sanguis и представляет собой самостоятельный вид. На агаре микроорганизмы формируют гладкие и шероховатые колонии, при выращивании в аэробных условиях наблюдается альфа-гемолиз. Конечное значение pH в бульоне с глюкозой — 4,2-5,8, среднее значение — 4,5. Кислота образуется из глюкозы, мальтозы, сахарозы и, обычно, из лактозы и салицина. Не образуется кислота из инулина, маннита, сорбита, глицерина, арабинозы и ксилозы. По способности гидролизовать аргинин, синтезировать β-глюкозамидазу, β-глюкозидазу и а-маннозидазу выделены два биовара (1 и 2). Внеклеточный полисахарид не синтезирует.
S. mitis выделяют из слюны, мокроты и фекалий человека, верхних дыхательных путей, они могут вызывать различные виды госпитальных инфекций, включая эндокардит.
S. oralis — второй клинически важный вид данной группы. Является одним из основных компонентов биоплёнки зуба и подобно S. sanguis играет ведущую роль на первых этапах её формирования. S. oralis, синтезирует внеклеточный полисахарид, обладает нейраминидазной и IgA1-протеазной активностью, гидролизует аргинин, эскулин и ферментирует инулин. В ДНК-ДНК-гибридизации выявлена высокая степень родства представителей этой группы штаммов между собой и установлено, что ранее в вид S. oralis были включены отдельные штаммы, принадлежащие к S. mitior и S. sanguis II. Вместе с тем, S. oralis следует считать наиболее опасным патогеном из группы альфа-зеленящих стрептококков. Он способен вызывать инфекционный эндокардит, а у иммунодефицитных пациентов — септицемию.
На основании секвенирования генов 16S рРНК и ДНК-ДНК-гибридизации к данной группе отнесено ещё несколько видов — обитателей полости рта человека, медицинское значение которых не установлено: S. cristatus (каталазонегативные грамотрицательные кокки, на средах с сахарозой образуют глюкан непостоянно), S. infantis и S. peroris. Недавно, по данным ПЦР-исследований, было высказано предположение о способности S. cristatus вызывать септицемию и поражение клапанов сердца при инфекционном эндокардите.
д) Группа Anginosus-Intermedius. Штаммы стрептококков этой группы столь похожи по своим свойствам, что большинство исследователей ранее рекомендовали их рассматривать как один вид — S. milleri. Он был впервые выделен из полости рта в 1956 г. при инфекционном поражении. Однако, как впоследствии оказалось, по данным молекулярных методов исследования, эти виды всё-таки различаются генетически и в настоящее время выделены в самостоятельные виды. Для большей части представителей этой группы характерно наличие бета-гемолитической активности,но примерно 1/3 штаммов являются альфа-гемолитическими.
В настоящее время к данной группе относят два важнейших вида представителей резидентной флоры верхних дыхательных путей, желудочно-кишечного и урогенитального тракта — S. anginosus и S. constellatus. Их медицинское значение определяется способностью вызывать абсцедирующие инфекции абдоминальной и урогенитальной области. В отличие от S. anginosus представители вида S. constellatus чаще обладают бета-гемолитической активностью. Эти виды описаны в отдельных статьях на сайте.
Из представителей этой группы более типичен для слизистой оболочки полости рта и дыхательных путей облигатно-анаэробный вид S. intermedius. Поэтому он чаще выделяется при гнойно-воспалительных процессах одонтогенной природы, при инфекциях головы и шеи, пародонтите. Ряд авторов считают его представителем пародонтопатогенной флоры. S. intermedius, кроме того, проявляет тропизм к тканям мозга и печени, вызывая абсцессы, а также эндокардиты. Японские исследователи показали способность S. intermedius, наряду с представителями видов S. sanguis, S. gordonii и S. mutans, инвазироваться в клетки культуры аортального эндотелия человека. Очевидно, находки этих стрептококков в атеросклеротических бляшках и клапанах сердца при эндокардите носят закономерный характер.
е) Определение чувствительности к антибиотикам. Осуществляют традиционными методами. Наиболее широко распространен и считается адекватным дискодиффузионный метод по Кирби-Бауэру. Для альфа-зеленящих стрептококков, как правило, характерна высокая чувс твительность к большинству групп антибиотиков — в первую очередь, к бета-лактамам, макролидам, гликопептидам, а также и к препаратам широкого спектра действия. Однако, в последние десятилетия, всё чаще появляются сообщения о резистентных штаммах стрептококков. В первую очередь это относится к важнейшим представителям микробиоценозов слизистой оболочки — S. sanguis и S. oralis. У некоторых штаммов этих видов выявлены бета-лактамазы, определяющие устойчивость к пенициллинам и цефалоспоринам, а также erm- и tet-гены, кодирующие устойчивость к макролидам и тетрациклинам.
ж) Заключение об этиологической значимости. При обнаружении представителя стрептококковой флоры в материалах, которые в норме должны быть стерильны (кровь, ликвор, биоптаты тканей, образцы материала с клапанов сердца, эндотелия сосудов, синовиальная, плевральная жидкость и т. п.) можно говорить о высокой вероятности (90-95 %) роли стрептококка как возбудителя инфекционного процесса.
В остальных случаях выявление в исследуемом материале тех или иных стрептококков оппортунистической группы не означает их этиологической роли в воспалительном процессе, особенно, если данный вид типичен для этой экологической ниши.
Для воспалительных заболеваний полости рта, носоглотки, одонтогенных и риногенных очагов, гнойных ран разработаны количественные критерии микробной обсемененности основными видами альфа-зеленящих стрептококков (не менее 105—106 КОЕ/мл). При обострении хронического пародонтита количество S. sanguis в экссудате пародонтальных карманов, например, резко увеличивается по сравнению с нормой (от 105 до 108-109 КОЕ/мл). В пользу этиологической значимости возбудителя говорит также и его исчезновение при повторных исследованиях в процессе лечения антибактериальным препаратом соответствующего спектра действия.
Поскольку многие представители стрептококковой флоры трудны для идентификации традиционными методами, в практической работе нередко прибегают к помощи ПЦР. Однако следует учитывать, что определение ДНК на клапанах сердца или в атеросклеротических бляшках без культурального подтверждения многими авторами расценивается как сомнительный результат. Кроме того, в условиях применения антибиотиков повторное исследование материала следует проводить не ранее, чем через 14 суток после окончания приёма препарата, так как фрагменты разрушенной ДНК возбудителя могут сохраняться в секретах достаточно долго.
- Читать далее "Род Enterococcus (энтерококки): таксономия, характеристика"
Редактор: Искандер Милевски. Дата публикации: 16.3.2020
- Род Streptococcus: характеристика
- Условно-патогенные стрептококки серогрупп А (кроме S. pyogenes), С, D, F и G
- Краткая характеристика отдельных видов стрептококков серогрупп А, С, D, F и G
- Клинические проявления и эпидемиологические особенности стрептококковой инфекции
- Микробиологическая диагностика стрептококков (Streptococcus)
- Стрептококки серогруппы В: биология и микробиологическая диагностика
- Альфа-зеленящие стрептококки: морфология, культуральные, биохимические свойства
- Характеристика основных групп альфа-зеленящих стрептококков
