Методы исследования фармацевтических препаратов на стерильность
Испытание на стерильность проводят в асептических условиях, чтобы избежать микробной контаминации образца во время посева.
Для исследования используют следующие питательные среды: тиогликолевую и соевоказеиновый бульон — для культивирования аэробных и анаэробных бактерий и жидкую среду Сабуро—для выявления грибов. Все посевы инкубируют не менее 14 сут. на тиогликолевой среде при температуре 32,5(±2,5)°С, на соевоказеиновом бульоне и среде Сабуро—при температуре 22,5(±2,5)°С. Посевы просматривают ежедневно.
Для определения стерильности используют метод прямого посева и метод мембранной фильтрации. При прямом посеве образцы исследуемого препарата вносят непосредственно в питательные среды, объем которых должен в 10 раз превышать объем вносимого препарата. В случае помутнения питательной среды после внесения образца по окончании инкубации делают пересев на аналогичную среду, удлиняя срок выдерживания посевов на 4 сут.
При испытании мазей и масел образец препарата приготавливают в виде эмульсии, используют фосфатный буферный раствор с твином-80 и стеклянные бусы, а в случае необходимости — нагревание до температуры, не превышающей 42 °С.

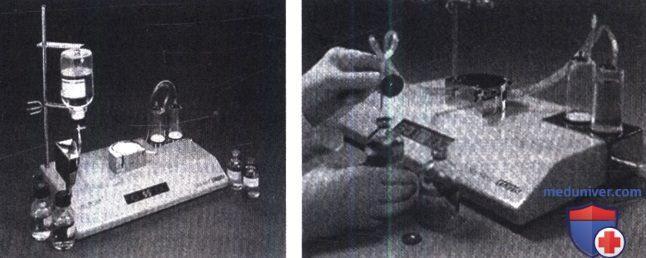
При определении стерильности лекарственных средств, обладающих выраженным антимикробным действием, и лекарственных средств в сосудах вместимостью более 100 мл преимущественно используют метод мембранной фильтрации. Исключение составляют препараты антимикробного действия, нерастворимые в воде или изопропилмиристате.
Испытание проводят с использованием фильтрационной установки, которая должна быть смонтирована таким образом, чтобы исследуемый раствор (жидкость) можно было ввести и профильтровать в условиях асептики. После окончания фильтрации мембрану асептически переносят в питательную среду.
Существует и другая конструкция фильтровального оборудования — стерильная замкнутая система с мембраной, вмонтированной в канистру, в которую после фильтрования добавляют стерильную среду (например, система «Стеритест», разработанная в 1973 г. фирмой «Миллипор»). Мембранные фильтры, применяемые для испытания на стерильность, имеют, как правило, размер пор 0,45 мкм и внешний диаметр 47 мм.
Фильтры из нитратцеллюлозы используют для водных, масляных и слабых спиртовых (менее 30%) растворов, фильтры из ацетатцеллюлозы—для концентрированных спиртовых растворов и др. Гидрофобный край фильтра и низкая сорбционная способность сводят к минимуму потери препарата при фильтрации. Для препаратов, не обладающих бактериостатическим или фунгистатическим действием, можно использовать фильтры без гидрофобного края, увлажняя их перед фильтрацией, если нет других указаний. Установки и фильтры стерилизуют автоклавированием.
Если препарат представляет собой раствор в масле, фильтр и установка перед употреблением должны быть тщательно высушены.
- Читать далее "Количественное определение микроорганизмов в фармацевтических препаратах"
Редактор: Искандер Милевски. Дата публикации: 18.10.2019
- Принципы микробиологического контроля качества лекарственных средств
- Методы исследования фармацевтических препаратов на стерильность
- Количественное определение микроорганизмов в фармацевтических препаратах
- Выделение и количественное определение энтеробактерий в нестерильных лекарственных средствах (НЛС)
- Выделение, идентификация и количественное определение Escherichia coli в лекарственных средствах
- Выделение, идентификация Salmonella spp. и Р. aeruginosa в лекарственных средствах
- Выделение и идентификация Staphylococcus aureus в лекарственных средствах
