Количественное определение микроорганизмов в фармацевтических препаратах
Испытание на микробиологическую чистоту НЛС состоит из 2 этапов: количественного определения микроорганизмов-контаминантов и идентификации некоторых видов бактерий, наличие которых недопустимо или ограничено. В начале бактериологического исследования устанавливают, обладает ли исследуемый препарат антимикробным действием, которое может привести к неправильной оценке результатов испытания. Отсутствие роста тест-микроорганизмов в питательной среде в присутствии препарата но сравнению с контролем свидетельствует о том, что лекарственное средство подавляет рост одного или нескольких видов бактерий и грибов.
Для получения достоверных результатов бактериологического анализа необходимо устранить антимикробное действие исследуемого препарата. Для этого применяют следующие методы:
— добавляют в раствор для растворения препарата и в питательные среды инактиваторы (специфические или неспецифические);
— используют метод мембранной фильтрации, если ЛС растворимо в водных растворителях или изопропилмиристате;
— увеличивают разведение препарата;
— комбинируют вышеуказанные методы.
После устранения антимикробного действия проводят количественное определение аэробных мезофильных бактерий и грибов в 1 г (мл) НЛС.
Количественное определение микроорганизмов. В зависимости от природы лекарственного средства и его физико-химических свойств используют один из вариантов чашечного агарового метода, метод мембранной фильтрации или пробирочный метод наиболее вероятных чисел (НВЧ).
а) Чашечный агаровый метод. Для культивирования микроорганизмов используют агаризованные питательные среды: соевоказеиновый агар или среду №1 сухую для контроля микробной загрязненности—для выращивания бактерий, агар Сабуро или среду №2 сухую для контроля микробной загрязненности—для выращивания грибов. Посевы на среде для выращивания бактерий инкубируют при температуре (32,5±2,5) °С, а на среде для выращивания грибов — при температуре 22,5(±2,5) °С.
Для каждого разведения образца используют не менее 2-х чашек Петри с определенной средой.
После расплавления среды охлаждают до температуры 45(±5)°С и вносят в чашки Петри в необходимом количестве.
1. Глубинный метод. Образец, приготовленный для анализа, в количестве 1 мл вносят в стерильную чашку Петри диаметром 90 мм. Добавляют 15-20 мл агаризованной питательной среды и быстро перемешивают вращательными движениями. При большем диаметре чашек Петри количество среды соответственно увеличивают. После застывания агара чашки переворачивают и инкубируют посевы.
2. Двухслойный метод. Агаризованные питательные среды вносят в количестве 15-20 мл в каждую стерильную чашку Петри диаметром 90 мм и оставляют до застывания. При большем диаметре чашек Петри количество среды соответственно увеличивают.
Образец, приготовленный для анализа, в количестве 1 мл вносят в пробирку с 4 мл соответствующей расплавленной и охлажденной питательной среды, быстро перемешивают содержимое пробирки и переносят на поверхность застывшего и подсушенного агара в чашке Петри, равномерно распределяя верхний слой среды вращательными движениями. После застывания чашки переворачивают и помещают в термостат для инкубации.
3. Поверхностный метод. Расплавленные и охлажденные питательные среды вносят в количестве 15-20 мл в каждую стерильную чашку Петри диаметром 90 мм и оставляют до застывания. При большем диаметре чашек Петри количество среды соответственно увеличивают. Поверхность агара в чашках подсушивают. Образец, приготовленный для анализа, наносят на агар в количестве 0,1 мл и равномерно распределяют шпателем по поверхности среды. Чашки переворачивают и помещают в термостат для инкубации.
4. Модифицированный глубинный метод. Образец, приготовленный для анализа, в количестве 1 мл вносят в стерильную чашку Петри диаметром 90 мм. Добавляют 7-10 мл расплавленной и охлажденной питательной среды и быстро перемешивают вращательными движениями. После застывания агара чашки переворачивают и инкубируют. Учет результатов производят через 48-72 ч.
5. Учет результатов посевов чашечными методами. Посевы просматривают ежедневно. Подсчет колоний производят через 48-72 ч (предварительный результат) и через 5 сут. (окончательный результат).
Для получения достоверных результатов отбирают чашки, где число колоний бактерий находится в пределах от 30 до 300, а колоний грибов — от 10 до 100. Если при учете результатов двух последующих разведений число колоний на чашках соответствует указанным выше пределам, рассчитывают результаты из меньшего разведения.
Если в среднем на чашках выросло более 300 колоний бактерий или более 100 колоний грибов, делают ряд дальнейших последовательных разведений образца, выбирая подходящее для посева.
Если в среднем на чашках выросло менее 30 колоний бактерий и менее 10 колоний грибов, делают расчет количественного содержания бактерий и грибов по имеющимся результатам.
При отсутствии на питательной среде роста микроорганизмов результаты отмечают следующим образом: при посеве лекарственного средства в разведении 1:10 — в 1 г (или в 1 мл) лекарственного средства содержится менее 10 бактерий (или грибов); при посеве лекарственного средства в разведении 1:100 — в 1 г (или в 1 мл) лекарственного средства содержится менее 100 бактерий (или грибов) и т. д.
Количество микроорганизмов в 1 г или в 1 мл рассчитывают по формуле:
N = cd/n,
где N — количество микроорганизмов в 1,0 г или в 1,0 мл;
с — сумма колоний на всех чашках;
n — число чашек;
d — коэффициент разведения образца.
При подсчете количества микроорганизмов в 1,0 г или в 1,0 мл образца полученный результат выражают в виде числа в пределах от 1,0 до 9,9, умноженного на 10х, где х — соответствующий показатель степени основания 10.
Пример. При посеве из разведения 10-2 на двух чашках выросло 168 и 215 колоний, следовательно:
N=(168+215)/2,
Полученный результат округляют до двух значащих цифр—19000 и записывают как 1,9х104.
Интерпретация результатов. При необходимости подсчета общего количества микроорганизмов (бактерий и грибов суммарно) в 1 г или в 1 мл лекарственного средства следует сложить число аэробных бактерий с числом грибов.
б) Метод мембранной фильтрации. Метод мембранной фильтрации используют для количественного определения микроорганизмов в лекарственных средствах, обладающих или не обладающих антимикробным действием. Метод применим только для растворов и водорастворимых лекарственных средств, а также для жиросодержащих препаратов, растворимых в изоиропилмиристате.
Для посева используют мембранные фильтры с диаметром пор не более 0,45 мкм, способные эффективно задерживать микроорганизмы, что подтверждается валидацией. Установка для мембранной фильтрации должна быть такой конструкции, которая позволяет извлечь из нее фильтры с целью переноса их на питательные среды. Материал мембраны следует выбирать таким образом, чтобы компоненты исследуемого препарата не влияли на его эффективность. Мембранную фильтрацию проводят в асептических условиях в вакууме.
Образец, как правило, растворяют в буферном растворе в соотношении 1:10. В воронку фильтровальной установки вносят сначала промывную жидкость (примерно 5 мл) для смачивания фильтра, добавляют 10 мл препарата в разведении 1:10, соответствующее 1 г образца, и немедленно фильтруют. В случае антимикробного действия лекарственного средства для отмывания мембраны используют раствор натрия хлорида 0,9%, жидкости №1, №2 или №3. Через фильтр пропускают минимум три порции по 100 мл подходящей стерильной промывной жидкости.
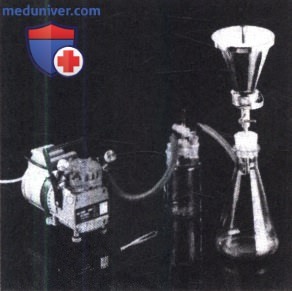
При необходимости к промывной жидкости могут быть добавлены поверхностно-активные вещества (например, твин-80) или инактиваторы антимикробного действия. Через одну мембрану можно пропустить не более 1000 мл жидкости. Допускается использование для отмывания мембран менее трех порций промывной жидкости при условии валидации метода.
По окончанию процесса фильтрации мембраны переносят на соответствующие питательные среды, разлитые в чашки Петри. Чашки с фильтрами переворачивают и инкубируют в термостате.
Учет результатов. Подсчет колоний производят через 48-72 ч (предварительные результаты) и через 5 сут. (окончательные результаты). Отбирают чашки, где число колоний бактерий на фильтрах не превышает 100, а грибов — 50, и рассчитывают число микроорганизмов на 1,0 г или на 1,0 мл образца либо на 1 пластырь. Если на фильтре большее количество микроорганизмов, делают ряд последовательных разведений образца и выбирают подходящее.
Для того чтобы определить, полностью ли отмыты мембраны от фильтруемого препарата, обладающего антимикробным действием, после фильтрации раствора в последнюю порцию промывной жидкости вносят по отдельности по 1 мл взвеси В. subtilis АТСС 6633 и С. albicans NCTC 885-653, содержащей от 10 до 100 КОЕ/мл. Рост тест-штаммов на фильтрах подтверждает отсутствие антимикробного действия лекарственного средства. Напротив, если роста определенного микроорганизма не наблюдается, значит, антимикробное действие лекарственного средства в отношении данного вида микроорганизмов сохраняется.
В этом случае используют специфические или неспецифические инактиваторы или увеличивают объем промывной жидкости.
Жидкости для промывания фильтров:
1. Раствор натрия хлорида изотонического 0,9 % стерильного, pH 7,0.
2. Жидкость №1:1 г мясного пептона растворяют в 1000 мл воды, фильтруют или центрифугируют для осветления, разливают во флаконы и стерилизуют. pH после стерилизации 7,0±0,2.
3. Жидкость №2: 1 мл твина-80 добавляют к 1000 мл жидкости №1, разливают во флаконы и стерилизуют. pH после стерилизации 6,9±0,2. Жидкость применяют, если в составе препарата имеется масло.
4. Жидкость №3: 5 г мясного пептона, 3 г мясного экстракта и 10 г твина-80 растворяют в 1000 мл воды. Разливают во флаконы и стерилизуют. pH после стерилизации 6,9±0,2.
в) Метод наиболее вероятных чисел (НВЧ). Исследуемый образец готовят в виде раствора, суспензии или эмульсии в разведениях 1:10, 1:100, 1:1000, используя подходящий растворитель. Жидкую питательную среду (соевоказеиновый бульон или среду №8) разливают в 12 стерильных пробирок по 9 мл в каждую. Пробирки ставят в штатив в 4 ряда по 3 пробирки.
В первый ряд пробирок вносят по 1 мл испытуемого образца в разведении 1:10, во второй ряд — по 1 мл в разведении 1:100, в третий ряд — по 1 мл в разведении 1:1000. В пробирки четвертого ряда вносят по 1 мл разбавителя, который используют для растворения, суспендирования или эмульгирования образца. Посевы инкубируют в течение не более 5 суток.
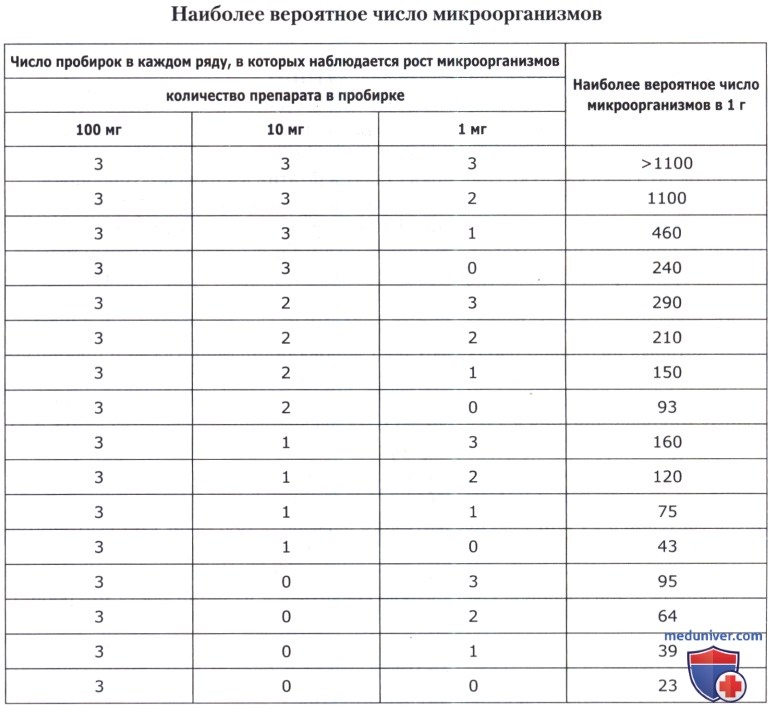
Учет результатов. Отмечают число пробирок в первом, втором и третьем рядах, в которых визуально наблюдают рост микроорганизмов. Среда в пробирках четвертого ряда (контроль разбавителя) должна оставаться стерильной. Полученное трехзначное число соответствует наиболее вероятному количеству жизнеспособных микроорганизмов в 1,0 г или в 1,0 мл лекарственного средства.
Пример. В первом ряду рост микроорганизмов наблюдается в 3 пробирках, во втором ряду — в 2 пробирках, в третьем ряду — в одной пробирке. Полученное число 321 соответствует цифре 150 в таблице 6.3. Следовательно, наиболее вероятное число бактерий в 1 г или 1 мл исследуемого образца—150. Если учет результатов не может быть определен точно в связи с природой исследуемого препарата (помутнение среды, изменение ее цвета и т. п.), делают пересев на соответствующую жидкую или агаризованную среду, чтобы убедиться в наличии роста микроорганизмов.
Варианты чашечного агарового метода (глубинный, двухслойный и модифицированный) можно использовать при испытании различных лекарственных форм независимо от уровня микробной загрязненности.
Поверхностный агаровый метод предпочтительнее использовать при испытании нестерильных лекарственных средств с высоким уровнем микробной контаминации.
Для количественного определения в ускоренные сроки бактерий и грибов, колонии которых склонны к сливному росту, используют модифицированный агаровый метод посева.
Метод мембранной фильтрации используют при испытании растворов, водорастворимых лекарственных средств и жиросодержащих лекарственных средств, растворимых в изопропилмиристате.
Метод НВЧ применяют при испытании лекарственных средств с низким уровнем микробной контаминации, а также в тех случаях, когда нельзя применить другие методы. Метод НВЧ менее чувствителен и точен по сравнению с чашечным агаровым методом или методом мембранной фильтрации. Он используется только для определения общего числа бактерий, так как результаты определения общего числа грибов, особенно плесневых, считаются недостоверными.
- Читать далее "Выделение и количественное определение энтеробактерий в нестерильных лекарственных средствах (НЛС)"
Редактор: Искандер Милевски. Дата публикации: 18.10.2019
- Принципы микробиологического контроля качества лекарственных средств
- Методы исследования фармацевтических препаратов на стерильность
- Количественное определение микроорганизмов в фармацевтических препаратах
- Выделение и количественное определение энтеробактерий в нестерильных лекарственных средствах (НЛС)
- Выделение, идентификация и количественное определение Escherichia coli в лекарственных средствах
- Выделение, идентификация Salmonella spp. и Р. aeruginosa в лекарственных средствах
- Выделение и идентификация Staphylococcus aureus в лекарственных средствах
