Принципы микробиологического контроля качества лекарственных средств
Санитарно-бактериологическое исследование фармацевтических препаратов является частью фармацевтической микробиологии, цель которой — определение качества лекарственных средств в соответствии с требованиями и методами Государственной Фармакопеи.
Всю продукцию, выпускаемую на мировой рынок фармацевтической промышленностью, по уровню микробиологической чистоты можно условно разделить на две части. Около 20 % препаратов должны быть стерильными, а в остальных допускается присутствие лимитированного количества микроорганизмов за исключением определенных видов бактерий, представляющих опасность для здоровья человека.
Испытание на стерильность впервые было введено в фармакопеи в 30-е годы прошлого века: в британскую — в 1932 г. и в фармакопею США — 1936 г. Стерильными должны быть все инъекционные и инфузионные растворы, глазные препараты, лекарственные средства, которые вводят в стерильные полости тела (матку, среднее ухо, мочевой пузырь и др.), а также те, которые наносят на открытые раны и ожоги.
К большей части препаратов (в среднем к 82%) требования стерильности не предъявляются, так как условия производства, как правило, не гарантируют отсутствие их микробной загрязненности. Микроорганизмы, в том числе патогенные, могут быть первично внесены с сырьем и технологической водой, не исключена вторичная контаминация в процессе производства или на этапе фасовки и упаковки.
К этим так называемым нестерильным лекарственным средствам (НЛС) относятся различные лекарственные формы: таблетки, капсулы, драже, порошки, суспензии, растворы, сиропы, эмульсии, мази, кремы, суппозитории, масла, пластыри, аэрозоли и др. Из них около 14%—препараты для местного применения, немногим более 65% — формы для приема внутрь и примерно 3% — остальные.
Проблема микробной загрязненности фармацевтических препаратов возникла в 60-е годы прошлого века, когда в медицинских журналах многих европейских стран появились сообщения о случаях вторичного заболевания у больных, принимающих определенные препараты. В 1962 г. в Стокгольме более 200 человек было одновременно госпитализировано с диагнозом «острое кишечное заболевание». В ходе дальнейшей диагностики была выявлена причина массовой инфекции.
Ею оказалась Salmonella munchen, выделенная из таблеток тиреоидина, которые принимали все заболевшие сальмонеллезом, так как их основным заболеванием была патология щитовидной железы. С этого времени началось массовое бактериологическое исследование различных лекарственных форм медицинских препаратов, в ходе которого были выявлены микроорганизмы-контаминанты, вызывающие вторичное заболевание—лекарственную инфекцию.
В связи с актуальностью проблемы микробной загрязненности НЛС в 1972 г. были опубликованы рекомендации Всемирной Организации Здравоохранения и Международной федерации фармацевтов, касающиеся общих принципов установления допустимого уровня микрофлоры, как количественного, так и качественного, в лекарственных средствах. В России методы испытания и нормы микробиологической чистоты НЛС впервые были включены в Государственную Фармакопею XI издания (ГФ XI), действующую с 1990 г.; они изложены в общей фармакопейной статье «Методы микробиологического контроля лекарственных средств».
За прошедшие годы в нашей стране и за рубежом накоплен большой материал, касающийся современных методов и подходов к установлению допустимых норм микробной контаминации фармацевтических препаратов.
В 1998 г. в дополнение к 3-му изданию Европейской Фармакопеи были введены нормы содержания мезофильных бактерий и грибов в НЛС и перечислены виды бактерий, наличие которых в препаратах, производимых в странах Западной Европы, недопустимо.
С июня 2003 г. требования к качеству ЛС, производимых в Российской Федерации, в соответствии с Изменением №3 к ГФ XI, аналогичны таковым Европейской Фармакопеи.
Критерии оценки уровня микробной контаминации препаратов основаны на способах применения и природе основного сырья. Все медицинские препараты разделены на 4 категории. К категории 1 отнесены ЛС, которые должны быть стерильными, т. е. не содержать никаких микроорганизмов. К категории 2 относятся препараты для местного и интравагинального применения, для введения в полости уха, носа и дыхательные пути (кроме тех, которые должны быть стерильными) и трансдермальные пластыри. В категорию ЗА включены препараты для применения внутрь и ректально, в категорию ЗБ — препараты для применения внутрь, изготовленные из природного сырья, в категорию 4—ЛС из растительного сырья.
В таблице ниже приведены допустимые нормы микробиологической чистоты субстанций и вспомогательных веществ, используемых для производства лекарственных препаратов.

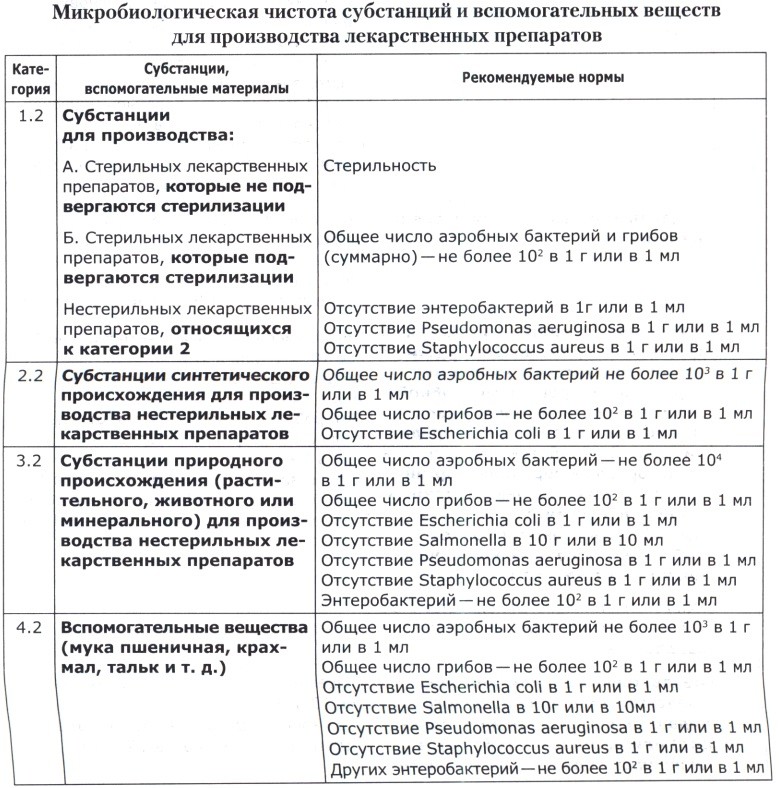
Примечания к таблицам:
1. В нормативных документах могут быть указаны в виде исключения и другие нормы в зависимости от состава препарата и особенностей производственного технологического процесса.
2. В нормативных документах на препараты для детей должны быть регламентированы более жесткие нормы, а именно: количество аэробных бактерий в 1 г или в 1 мл—в пределах от 100 до 500, количество грибов—от 10 до 50, отсутствие бактерий семейства Enterobacteriaceae, Pseudomonas aeruginosa, Staphylococcus aureus.
3. При обнаружении во время проведения испытания других патогенных бактерий, кроме указанных выше, считается, что качество лекарственных средств, субстанций и вспомогательных веществ не соответствует требованиям по показателю «Микробиологическая чистота».
- Читать далее "Методы исследования фармацевтических препаратов на стерильность"
Редактор: Искандер Милевски. Дата публикации: 18.10.2019
- Принципы микробиологического контроля качества лекарственных средств
- Методы исследования фармацевтических препаратов на стерильность
- Количественное определение микроорганизмов в фармацевтических препаратах
- Выделение и количественное определение энтеробактерий в нестерильных лекарственных средствах (НЛС)
- Выделение, идентификация и количественное определение Escherichia coli в лекарственных средствах
- Выделение, идентификация Salmonella spp. и Р. aeruginosa в лекарственных средствах
- Выделение и идентификация Staphylococcus aureus в лекарственных средствах
