Конъюгация у бактерий
Конъюгация — истинная копуляция двух бактерий различного пола с переносом части или всей хромосомы клетки-донора в клетку-реципиент и последующей рекомбинацией хромосомы последнего с вновь внесенным генетическим материалом донора. Иногда при конъюгации в реципиентную клетку может быть передана только плазмидная ДНК донора. Конъюгация—наиболее совершенный из всех известных способов передачи генов у бактерий, поскольку при ней может происходить передача больших количеств генетического материала, что обусловливает широкие возможности его обмена, а следовательно, и широкие возможности изменчивости.
Процесс конъюгации был описан впервые в 1946 г. у Е. coli К-12 Ледербергом и Тейтумом (Lederberg J., Tatum Е. L.). Обнаружение этого явления — пример значимости случайности и удачи в научном открытии. С одной стороны, эксперимент был тщательно продуман его авторами методически, с другой — им крупно повезло: случайно была взята культура К-12 Е. coli, у которой конъюгация осуществляется с наиболее высокой частотой, и два штамма разного пола. В первых же экспериментах было показано, что для возникновения рекомбинантов (гибридного потомства) необходим, в отличие от трансформации, контакт клеток двух родительских штаммов. Было обнаружено также, что в потомстве наблюдается как перекомбинация некоторых признаков родителей (их расщепление), так и совместное наследование (сцепление) других признаков. Очень скоро при изучении различных вариантов скрещиваний было обнаружено, что картина расщепления признаков в полученном после конъюгации потомстве бактерий резко отличается от той, которую привыкли видеть при скрещиваниях у эукариотов. Определенные маркеры (помеченные мутациями гены) одного из родителей всегда отсутствовали у рекомбинантов (гибридного потомства) — создавалось впечатление, что возникшие при копуляции бактерий зиготы (слившиеся клетки) были неполными, т.е. содержали неполные два генома. Они были названы мерозиготами.
Истинные механизмы передачи генетического материала бактерий и его рекомбинации при конъюгации были вскрыты после многолетних экспериментов многих научных коллективов ученых разных стран. Было показано, что способность к конъюгации обусловлена наличием в клетках донорного штамма плазмиды, несущей гены, которые контролируют ее свойства, необходимые для стабильного контакта клеток. Эта плазмида первоначально была названа F-фактором (от fertility — плодовитость), поскольку плазмиды у бактерий в то время были еще неизвестны, а потом — F-плазмидой, т.е. половой плазмидой, или конъюгативной плазмидой. F-плазмида имеет протяженность 100 гпо (это крупная плазмида) и несет более двадцати генов (около 20 тпо), определяющих способность бактериальной клетки к конъюгации. У Е. coli К-12 все эти гены собраны в один кластер — tra-область (от transfer—перенос), у других бактерий они могут быть расположены несколькими группами. В tra-область входят гены, контролирующие образование на поверхности донорных клеток специальных структур — половых волосков (фимбрий, или пилей), состоящих из белка нилина и служащих для первичного контакта донорных и реципиентных клеток (их заякоривания).
После возникновения первичного контакта пили сокращаются и клетки подтягиваются друг к другу вплотную, в их оболочках образуются поры — возникает возможность перехода клеточных органел из одной клетки в другую. Сейчас показано, что при конъюгации у бактерий возникают целые комплексы контактирующих клеток, которые обеспечивают эффективную передачу генетического материала. Один из генов tra-области плазмиды кодирует эндонуклеазу, специфичную к последовательности ori Т (ориджин трансферного переноса), расположенной в начале этой области. Данный фермент делает однонитевой надрез ДНК в ori Т-последовательности, после чего начинается контролируемая генами tra-области репликация плазмиды по способу катящегося кольца. С кольцевой молекулы ДНК плазмиды как бы сползает одна нить, которая через пору передается в клетку-реципиент, а двунитевая структура ДНК плазмиды в клетке донора восстанавливается за счет комплементарного синтеза ДНК по матрице оставшейся в донорной клетке нити. В клетке реципиента тоже идет синтез ДНК по матрице переданной туда нити, и образуется нормальная двунитевая молекула—плазмида. В описанном процессе, кроме упомянутых выше, участвуют и другие ферменты и их комплексы, необходимые для синтеза ДНК. Кроме того, конъюгативные плазмиды кодируют специальные антирестрикционные белки, защищающие от разрушения передаваемую при конъюгации ДНК; контролирующие их гены тоже лежат в tra-области. Передача конъюгативных плазмид от донора реципиенту происходит очень быстро—за несколько минут и может осуществляться в самых различных условиях среды.
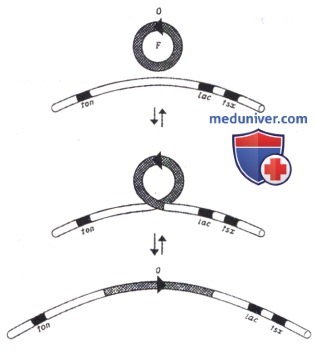
Для передачи хромосомного материала от донора реципиенту при конъюгации F-плазмида должна быть встроена в хромосому. У Е. сoli К-12 на хромосоме известно около двадцати точек, в которые может включаться F-плазмида. Встраивание ее идет «кольцо в кольцо» по механизму Кемпбела, как интеграция умеренных бактериофагов в хромосому.

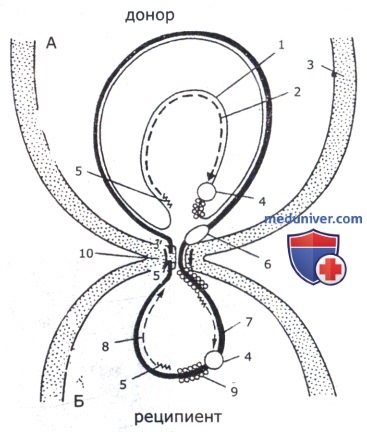
А — донор; Б — реципиент; 1 — цепь ДНК, остающаяся в доноре; 2 — вновь синтезирующаяся комплементарная цепь;
3 — клеточная стенка; 4 — ДНК-полимераза III; 5 — РНК-затравка; 6 — ДНК-геликаза;
7 — цепь ДНК F-плазмиды, переданная реципиенту; 8 — вновь синтезирующаяся в реципиенте комплементарная цепь;
9 — белок, защищающий ДНК; 10 — конъюгационная пора, в которой находятся эндонуклеаза и белок.
Хромосома со встроенной в нее F-плазмидой при конъюгации передается от донора в клетку реципиента за счет tra-области плазмиды. Процесс начинается с ori Т-плазмиды й протекает так же, как описано выше для конъюгативной плазмиды. При этом сначала передается фрагмент плазмидной ДНК от последовательности ori Т до точки рекомбинации ее с хромосомой, потом—хромосомная ДНК. Процесс этот длится дольше, чем передача одной плазмиды и занимает около 90 мин. После хромосомы передается оставшийся фрагмент плазмиды. Размер плазмидных фрагментов, передающихся перед хромосомой и после нее зависит от взаимного расположения участка плазмиды, по которому произошла рекомбинация при ее включении в хромосому, и ori Т-плазмиды.
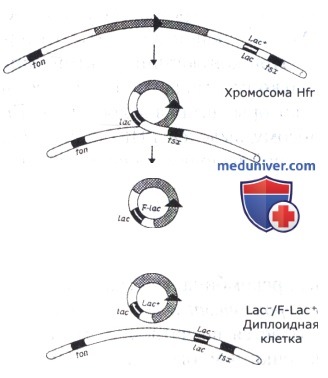
Целиком хромосома донора крайне редко передается в клетку реципиента: обычно в процессе передачи происходят ее спонтанные разрывы, и разные реципиентные клетки получают фрагменты хромосомы донора разных размеров. В связи с этим маркеры донора, лежащие в проксимальном отделе хромосомы реципиента (с точки зрения последовательности ее переноса), переносятся с большей частотой, чем дистальные,—от 10-3 до 10-8 на клетку, т.е. наблюдается градиент переноса маркеров донора в клетку реципиента. Доноры, включившие F-плазмиду в хромосому и способные передавать ее маркеры с высокими частотами, называются Hfr-донорами (от high frequency recombination). Доноры, содержащие конъюгативную плазмиду в автономном состоянии, называются донорами F+. Они тоже способны передавать при конъюгации не только плазмидные, но и хромосомные гены, но с меньшей и одинаковой для всех генов частотой. Способность F+-доноров к передаче хромосомных маркеров обусловлена тем, что в каждой бактериальной популяции с частотой около 10-5 происходит включение плазмиды в хромосому и, следовательно, возникают Hfr-донорные клетки. Поскольку плазмида может включаться в разные точки хромосомы, в каждой популяции возникают разные Hfr-доноры, передающие свои хромосомы с разных точек и иногда даже в разных направлениях. При передаче разных маркеров таким F+-донором частоты передачи каждого маркера усредняются и составляют обычно 10-7 на клетку-донора.
В ходе исследования процесса конъюгации у Е. coli К-12 было выделено большое количество Hfr-доноров, переносящих хромосому этого штамма при конъюгации с разных точек и в разных направлениях. При изучении порядка переноса ими генетических маркеров в клетки реципиентов было показано до появления электронно-микроскопических материалов Кернса (Cairns J.), что хромосома Е. coli имеет кольцевое строение.
На основании изложенных выше данных сделано заключение, что возможность попадания генетического маркера в зиготу при конъюгации определяется вероятностью предзиготного исключения, т.е. разрыва хромосомы проксимальнее этого маркера. Анализ закономерностей рекомбинации в большом числе различных конъю-гационных скрещиваний показал, что для разных хромосомных маркеров, уже попавших в зиготу, вероятность включения в хромосому реципиента одинакова и составляет 0,5, т.е. 50%. Было также установлено, что для его включения необходимо четное число перекрестов. Другими словами, фрагмент хромосомы донора, встраиваясь в хромосому реципиента, замещает ее гомологичный участок. Генотип рекомбинантов, полученных в конъюгационных скрещиваниях, представляет собой в основном генотип реципиента с включением групп генов донора. Поэтому для получения жизнеспособного потомства после таких скрещиваний важна жизнеспособность клеток реципиента; донорные клетки могут погибнуть после окончания процесса конъюгации, и это не отразится на жизнеспособности рекомбинантов.
В процессе конъюгации хромосомные гены могут быть перенесены от донора реципиенту не только при передаче хромосомы, но и при переносе только F-плазмиды. У донорных штаммов Hfr с определенной частотой происходит выщепление плазмиды из хромосомы — возникают клоны F+. Иногда это выщепление осуществляется неправильно с захватом прилежащего к плазмиде участка хромосомы, как у умеренных фагов. Такие конъюгативные плазмиды получили название F' (F-прим). Обычно они несут небольшие фрагменты хромосомы, не превышающие длину ДНК самой плазмиды, но иногда встречаются плазмиды, включившие 10-25% хромосомы. Процесс передачи хромосомных генов бактерии половой плазмидой называется сексдукцией.

Конъюгация — наиболее универсальный процесс переноса генов у бактерий, при котором может происходить передача больших количеств генетического материала вплоть до целой хромосомы. Это открывает широкие возможности для различных приемов генетического анализа у бактерий.
Кроме того, при изучении процесса конъюгации были сделаны два открытия общебиологической значимости: открыто кольцевое строение бактериальной хромосомы и обнаружены плазмиды у бактерий (первой выявленной бактериальной плазмидой была F-плазмида).
Все сказанное выше относится к Е. coli.
В настоящее время конъюгация, обусловленная различными половыми в подавляющем большинстве случаев крупными плазмидами, обнаружена у очень большого числа бактерий. Хотя другие системы конъюгации изучены намного хуже, чем конъюгация у Е. coli, тем не менее ясно, что в ряде случаев в них имеются некоторые различия. В качестве примера опишем процессы конъюгации у актиномицетов и стрептококков.
Конъюгация у актиномицетов. Актиномицеты — мицелиальные бактерии, в клетках которых содержится несколько гомологичных нуклеоидов. Это, несомненно, затрудняет их генетическое изучение. Однако практическая значимость этих объектов стимулировала исследования переноса генов у них и конъюгации в том числе. Было обнаружено, что у актиномицетов есть процесс конъюгации, в общих чертах аналогичный конъюгации грамотрицательных бактерий, хотя и отличающийся по ряду параметров (к тому же надо учитывать, что механизмы этого процесса у актиномицетов изучены недостаточно). Прежде всего половые плазмиды актиномицетов существенно отличаются от таковых у других бактерий. Многие штаммы актиномицетов имеют, как уже говорилось, линейные плазмиды. Ряд этих плазмид трансмиссивен, т. е. способен передаваться от содержащего их штамма реципиенту, другими словами, обладает свойствами половых плазмид. Такие плазмиды довольно разнообразны (различаются у разных штаммов) и некоторые из них имеют небольшие размеры, в отличие от половых плазмид других бактерий (как было сказано выше, только tra-область F-плазмиды Е. coli имеет протяженность более 20 тпо). На ряде половых плазмид актиномицетов показано, что их tra-область, необходимая для конъюгации, имеет протяженность всего 2 тпо. Ясно, что процесс конъюгации у актиномицетов должен быть более сложным, чем у других бактерий, по причине их мицелиального строения и не может обеспечиваться такой небольшой последовательностью ДНК. Возможно, что часть конъюгационных tra-генов находится в хромосоме или в составе конъюгативных транспозонов.
При конъюгации у актиномицетов передаются с высокой эффективностью не только плазмиды, но и хромосомные гены: частоты передачи всех генов генома у некоторых штаммов достигают 10-3. Половые плазмиды могут встраиваться в хромосому, выделены Hfr-доноры. Однако последние отличаются от Hfr-доноров кишечной палочки: чаще всего у таких доноров не обнаруживается направленного переноса генов при конъюгации он либо двунаправлен, либо вовсе не направлен. Часто рекомбинанты, полученные после конъюгационных скрещиваний актиномицетов, имеют в основном гены донора, а не реципиента, как у кишечной палочки. Кроме того, у актиномицетов после скрещивания возникают, кроме стабильных рекомбинантов (как у кишечной палочки), еще и нестабильные, называемые гетероклонами и долгое время выщепляющие как бы вторичные рекомбинанты. Создается впечатление, что состояние мерозиготы, очень короткое у кишечной палочки и многих других бактерий, у актиномицетов может сохраняться долгое время. Возможно, ряд перечисленных особенностей конъюгационного процесса у актиномицетов связан с линейным строением их хромосом и плазмид.
Конъюгация у стрептококков. У грамположительных бактерий, таких как стрептококки, конъюгация обнаружена у большого числа групп как внутри них, так и между ними. При этом у стрептококков описаны различные системы конъюгации. Наиболее хорошо изучена феромониндуцибельная система, при которой крупные конъюгативные плазмиды с молекулярной массой более 40 MD (около 60 тпо) передаются под контролем выделяемых реципиентом половых феромонов — пептидов с молекулярной массой 100 D. Реципиент выделяет феромон, строго специфичный к определенной конъюгативной плазмиде. Один реципиент может выделять несколько (до шести) различных феромонов, а один донор — нести до трех различных конъюгативных плазмид, чувствительных к разным феромонам. Под влиянием феромонов реципиента на поверхности клеток донора индуцируется образование фимбриеподобных структур, которые способствуют возникновению агрегатов разнополых клеток. (Показано, что у Streptococcus faecalis рецепторами у реципиента служит тейхоевая кислота.) Предполагается, что феромоны регулируют работу занимающих около 20 тпо и составляющих несколько групп tra-генов конъюгативных плазмид. Плазмиды в этой системе конъюгации передаются с высокой частотой, как F-плазмида Е. coli.
Обнаружены у стрептококков и конъюгативные системы, работающие без участия феромонов. У S. lactis описана такая система, обусловленная крупной плазмидой (около 50 тпо). Эта плазмида передается с высокой частотой. У некоторых культур выявлены обусловленные плазмидами протяженностью 25-50 тпо системы конъюгации, в которых передача плазмид осуществляется без образования половых пилей, только на плотных подложках (мембранных фильтрах) с низкой частотой. К сожалению, оба названных выше процесса плохо изучены.
Вероятно, конкретные механизмы образования контактов и перехода генетического материала от донора к реципиенту у бактерий довольно разнообразны и могут отличаться у различных систематических групп.
- Читать далее "Слияние протопластов бактерий"
Редактор: Искандер Милевски. Дата публикации: 12.07.2019
- Геном бактерий - строение бактериальной ДНК
- Формы переноса генетического материала бактерий: трансформация
- Трансдукция у бактериофагов и бактерий
- Конъюгация у бактерий
- Слияние протопластов бактерий
- Бактериальные плазмиды: функции, задачи
- Мигрирующие элементы ДНК бактерий: инсерционные последовательности и транспозоны
