Мигрирующие элементы ДНК бактерий: инсерционные последовательности и транспозоны
Мигрирующими элементами (МЭ) называются последовательности ДНК, имеющие специфическую структуру и автономно перемещающиеся по геному. Гены, кодирующие это перемещение, локализованы в самих МЭ. К мигрирующим элементам бактерий относятся:
— простые вставочные последовательности — IS-элементы (от Insertion Sequences);
— транспозоны — Tn;
— конъюгативные транспозоны — CTn;
— интегроны — In;
— генные острова (ГО), включая острова патогенности (ОН).
Первыми обнаруженными и изученными МЭ были IS-последовательности и транспозоны, перемещение которых осуществляется кодируемыми ими ферментами — транспозазами, которые могут связываться с однонитевыми ДНК. IS-элементы и Тп имеют общий принцип организации. В центре этих элементов находятся гены, окаймленные с двух сторон сначала инвертированными, а потом дуплецированнымиповторами. Инвертированные повторы — это повторяющиеся и инвертированные гомологичные последовательности ДНК, которые обусловливают возможность возникновения шпилечных структур в молекуле ДНК, способствуя прохождению в этом районе актов рекомбинации. Дуплецированные повторы возникают в ДНК-мишени, в которую встраивается МЭ, в результате ступенчатого разрыва двух нитей молекулы и достраивания пробелов по матрице одной оставшейся нити.
IS-элементы представляют собой последовательности ДНК средних размеров— 500-1500 по (редко встречаются более мелкие последовательности — около 200 по). В центральной части эти элементы содержат только гены, кодирующие синтез небольших белков, необходимых для их перемещения—транспозиции. Инвертированные повторы имеют размеры от нескольких пар оснований до нескольких десятков пар.
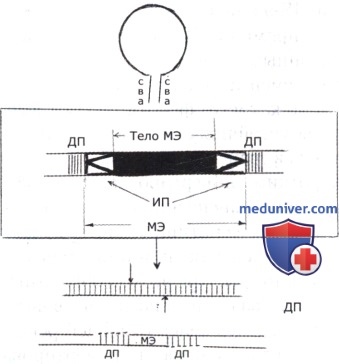
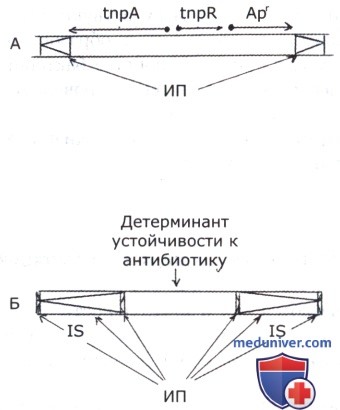
Транспозоны — это более крупные и более сложные МЭ, отличающиеся от IS-последовательностей тем, что в центральной части имеют гены, кодирующие какие-то фенотипические признаки бактерий. Очень часто это гены, определяющие устойчивость к антибиотикам, хотя могут быть и любые другие бактериальные гены. По строению транспозоны разделяются на два типа. У одного из них концевыми повторами служат IS-элементы, кодирующие транспозазы. Они могут быть инвертированными или прямыми. В последнем случае транспозон все равно фланкирован инвертированными повторами — небольшими инвертированными последовательностями IS-элемента. В центральной части такие транспозоны несут только гены, кодирующие какие-то фенотипически выявляемые признаки бактерий; очень часто это гены устойчивости к антибиотикам. Таких генов может быть несколько и от их числа в транспозоне зависит его размер. Транспозоны другого типа фланкированы короткими инвертированными повторами. У таких транспозонов гены, контролирующие транспозицию, находятся в центральной части вместе с генами, определяющими фенотипические признаки несущей транспозон бактерии.
При перемещении IS-элементов и Тп транспозазы опознают их инвертированные повторы. При этом необходимы оба повтора. Родственные МЭ имеют сходные транспозазы. Транспозиция является высокоспецифичной системой рекомбинации, отличающейся от общей рекомбинации и не требующей строгой гомологии в последовательностях инвертированных повторов и мишени — негомологичная рекомбинация. При транспозиции МЭ встраиваются обычно в АТ-богатые районы ДНК. При этом чаще всего происходит локальный синтез ДНК МЭ, и новая его копия перемещается в другое место; старая же копия остается на прежнем месте. Такой механизм перемещения МЭ называется репликативной транспозицией. Значительно реже осуществляется эксцизионная транспозиция, когда МЭ вырезается из несущей его ДНК и перемещается в новое место.
Внедрение различных МЭ в новую мишень происходит с разной степенью специфичности, причем последняя зависит как от МЭ, так и от мишени. Лучше всего специфичность внедрения разных МЭ изучена на Е. coli. У некоторых МЭ специфичность крайне низка—они внедряются практически в любые точки всех репликонов в бактериальной клетке. Есть МЭ со средней специфичностью — в бактериальном геноме много мест их внедрения как в разные гены, так и внутри отдельных генов. Некоторые МЭ характеризуются региональной специфичностью — они включаются в определенные районы генома протяженностью 1-2 тпо; внутри этих районов вставка осуществляется практически в любую точку. Наконец, известны МЭ с высокой специфичностью включения в мишень — в одну или очень немногие точки хромосомы. Выше уже было сказано, что специфичность—явление относительное, поскольку зависит и от МЭ, и от мишени. Поэтому МЭ с высокой специфичностью включения в хромосому могут в той же клетке включаться во много точек плазмиды.
Средние частоты транспозиции для IS и Тп составляют 10-4-10-7 при репликативной транспозиции и 10-6-10-9 — при эксцизии.
При перемещении МЭ могут включаться как в другое место того же репликона, так и в другие репликоны в бактериальной клетке и далее с плазмидами или при делении клеток перемещаться в другие клетки бактериальной популяции или даже в клетки бактерий других видов и родов (на широкотрансмиссивных плазмидах). Включение МЭ в генетические структуры клетки (различные репликоны ДНК) приводит к весьма существенным для бактерий результатам.
Внедрение в ДНК МЭ вызывает инактивацию генов-мишеней, т.е. мутации. Такие мутации могут быть обратимыми, если впоследствии произойдет точная эксцизия МЭ. Если эта эксцизия будет неточной, то активность гена-мишени не восстановится. Когда мутации, индуцированные внедрением МЭ, возникают в гене, входящем в состав какого-то оперона (совместно регулируемой группы генов, ответственных за единый метаболический процесс), они обычно бывают полярными, т. е. выключают не только тот ген, в который внедрился МЭ, но и все лежащие дистальнее гены. Полярный эффект обусловлен наличием в МЭ терминальных последовательностей, на которых обрывается считывание генетической информации. Внедряясь в молекулу ДНК, МЭ могут не только выключать, но и включать гены за счет присутствующих в них промоторных последовательностей или создания новых промоторов на стыках последовательностей МЭ и мишени. Другими словами, МЭ могут как выключать гены, так и регулировать их экспрессию.
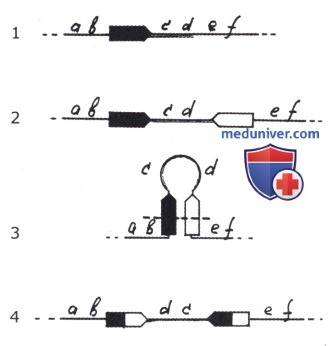
1 — исходная ДНК с МЭ;
2 — дупликация и транспозиция МЭ;
3 — рекомбинация между двумя МЭ;
4 — инверсия фрагмента cd.
МЭ индуцируют в мишени не только инактивацию или, наоборот, включение генов, но и различные перестройки ДНК. Так, в местах их внедрения с существенной частотой (до 10-4) возникают делеции (выпадение последовательностей ДНК) разного размера: от одной до 50 тпо. Обычно они простираются от концов МЭ в стороны от него. Возникшие делеции часто вызывают в этом месте генома еще большую нестабильность, поэтому последующие делеции начинают появляться и на расстоянии от МЭ. Часто делеции возникают в том месте генома, где был МЭ, а потом исключился.
Кроме делеций, МЭ индуцируют в ДНК мишени инверсии (изменение порядка последовательностей во фрагменте ДНК на обратный), дупликации (удвоение участка последовательностей) и транслокации (перемещение фрагмента последовательностей ДНК в другое место). Все эти перестройки возникают при наличии двух копий одного МЭ в молекуле ДНК (хромосоме либо плазмиде). Инверсии и дупликации появляются при рекомбинации между копиями одного мигрирующего элемента. Транслокация является следствием переноса участка ДНК, заключенного между двумя МЭ, при их транспозиции.
Мигрирующие элементы могут обусловливать мультипликацию генов в плазмидах и хромосомах бактерий. Лучше всего изучен этот процесс при мультипликации генов устойчивости к антибиотикам, но таким же образом могут быть мультиплицированы и другие гены бактериального генома. На рисунке ниже приведена схема описанного процесса с геном устойчивости к ампициллину. Устойчивость к этому антибиотику (и другим препаратам пенициллинового ряда) характеризуется многоступенчатостью. При первичном контакте бактерий с антибиотиком возникает устойчивость к определенной невысокой его концентрации. При дальнейшем культивировании бактерий на среде с этим антибиотиком, и особенно при повышении его концентрации, устойчивость бактерий к нему повышается ступенчато. Обусловлено это возникновением в его геноме структуры, состоящей из ряда генов устойчивости к ампициллину, фланкированных IS-элементами. Это образование напоминает расположенные рядом транспозоны с концевыми последовательностями в виде IS-элементов. Описанный тип многоступенчатой устойчивости формируется не только в случае применения антибиотиков ампициллинового ряда, но и при воздействии ауреомицином, хлорамфениколом, неомицином, террамицином, а также некоторыми красителями и солями металлов.
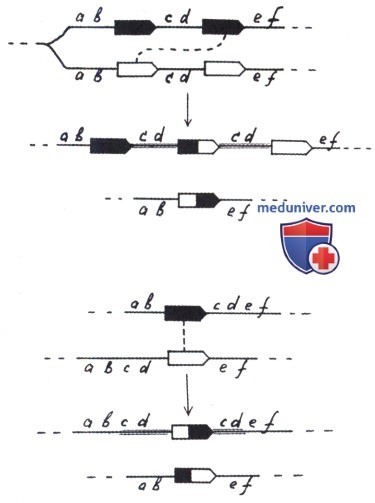
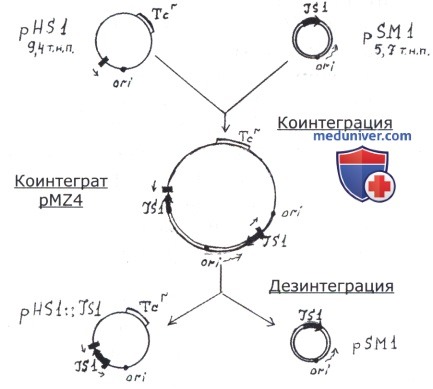
Помимо описанных выше перестроек генома, мигрирующие элементы индуцируют в бактериальных клетках слияние репликонов — образование коинтегратов из различных плазмид или из хромосомы и плазмиды. Такие коинтеграты могут возникать с участием разных систем рекомбинации; их образование может быть обусловлено либо системами транспозиции самих мигрирующих элементов (транспозазами), либо системой общей рекомбинации, кодируемой хромосомой. В первом случае происходит объединение репликонов, если оба или один из них несет какой-либо мигрирующий элемент. При коинтеграции репликонов МЭ удваивается и фланкирует один из объединяющихся репликонов; копии его находятся в прямой ориентации и снаружи окаймлены дуплицированными участками ДНК мишени.
Встраивание репликона происходит преимущественно в АТ-богатые районы молекул ДНК, так же как и встраивание любого МЭ. Образовавшийся коинтеграт может в дальнейшем разделиться.
Каждый из возникших при этом репликонов несет по МЭ (т.е. происходит как бы размножение МЭ). Разделение коинтеграта может быть правильным и неправильным. В первом случае появившиеся после разделения репликоны ничем не отличаются от исходных (слившихся), только один из них получает МЭ, которого ранее в его составе не было. При неправильном разделении коинтеграта возникают два новых измененных репликона (с новыми последовательностями ДНК). Как было сказано выше, слияние репликонов может происходить и за счет общей, или гомологичной, рекомбинации, если оба репликона несут один и тот же МЭ. Примером образования таких коинтегратов является описанное в разделе «Конъюгация» образование донорных штаммов Hfr типа при интеграции F-плазмиды в бактериальную хромосому. Показано, что эта интеграция происходит за счет рекомбинации по гомологичным IS-последовательностям, включенным в хромосому и плазмиду. Хромосома Е. coli имеет от 19 и более различных IS, а F-плазмида — четыре копии тех же IS.
Стимулируемые МЭ хромосомные перестройки, включая и образование коинтегратов, происходят с достаточно высокой частотой и, значит, вносят существенный вклад в перераспределение генетического материала в бактериальной клетке. Способность осуществлять индуцируемые МЭ перестройки зависит как от МЭ, так и от структуры генов его хозяина. Создается впечатление, что в результате «деятельности» МЭ геном должен быть нестабилен, однако это не так, поскольку перемещение МЭ в бактериальной клетке регулируется. Механизм этой регуляции пока не выяснен, но существует ряд косвенных фактов, указывающих на ее существование. Если МЭ попадает в клетку, которая его уже содержит, он перемещается в ней с более низкой частотой, чем в клетке, его не имеющей. То же относится и к отдельным репликонам. Известны факторы, влияющие на частоту транспозиции. УФ-облучение бактериальных клеток увеличивает частоты перемещения МЭ.
Инкубация бактериальных популяций с антибиотиками приводит к аналогичному эффекту в отношении транспозонов, несущих гены устойчивости к этим антибиотикам. Инкубация при повышенной температуре, наоборот, подавляет транспозицию МЭ — уменьшает ее частоты. Кроме того, показано, что частоты транспозиции, точного вырезания транспозонов и образования индуцированных ими делеций контролируются хромосомными генами бактерий: у Е. coli выделены мутации, влияющие на эти процессы.
Интересно, как могли возникнуть МЭ? Очевидно, сначала появились наиболее простые из них — IS-последовательности. Предполагают, что они могли эволюционировать из генов, контролирующих синтез ферментов топоизомераз первого типа, которые способны как разрезать молекулу ДНК, так и сшивать ее. Транспозоны, фланкированные IS-последовательностями, очевидно, образовались в результате захвата хромосомного гена или генов между двумя копиями IS. Транспозоны, окаймленные короткими инвертированными повторами, могли образоваться из первых путем делетирования части их последовательностей.
Очевидно, что МЭ играют ведущую роль в образовании измененных форм бактерий и изменчивости их популяций.
- Вернуться в оглавление раздела "Медицинская микробиология"
Редактор: Искандер Милевски. Дата публикации: 14.07.2019
- Геном бактерий - строение бактериальной ДНК
- Формы переноса генетического материала бактерий: трансформация
- Трансдукция у бактериофагов и бактерий
- Конъюгация у бактерий
- Слияние протопластов бактерий
- Бактериальные плазмиды: функции, задачи
- Мигрирующие элементы ДНК бактерий: инсерционные последовательности и транспозоны
