Лечение сепсиса
Определяющими условиями эффективности интенсивной терапии (ИТ) сепсиса являются полноценная хирургическая санация очага инфекции и адекватная антимикробная терапия. В последние годы были получены убедительные данные, свидетельствующие о снижении летальности и частоты осложнений при проведении ранней адекватной антибактериальной терапии сепсиса.
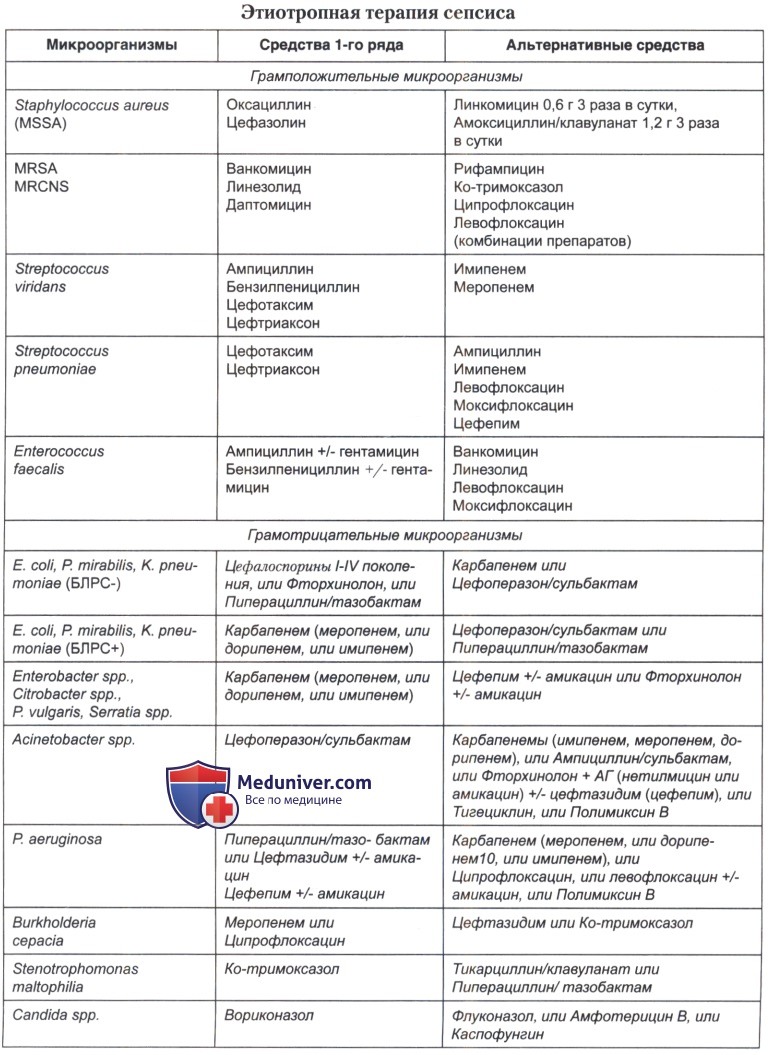
Своевременное рациональное назначение антибиотиков при сепсисе в 1,5-2 раза снижает частоту развития септического шока и летальность. В большинстве случаев она проводится в 2 этапа — эмпирический и этиологический (после идентификации патогена и определения его профиля чувствительности к антибактериальным препаратам).
Факторами, определяющими выбор препарата для проведения эмпирической антибиотикотерапии сепсиса, являются:
• предполагаемый спектр возбудителей (с учетом характера первичного очага инфекции и наличия вторичных и альтернативных инфекционных очагов);
• условие возникновения сепсиса (внебольничный, нозокомиальный);
• тяжесть течения сепсиса.
При тяжелом течении сепсиса с наличием признаков септического шока и полиорганной недостаточности стартовую эмпирическую антибиотикотерапию следует проводить по деэскалационной схеме, отдавая предпочтение карбапенемам, цефопе-разону/сульбактаму (сульперацеф) или цефалоспорину IV поколения (цефепиму, максицефу) в сочетании с метронидазолом.
При идентификации возбудителя требуется назначение этиотропной терапии.
а) Монотерапия антибиотиками при проведении лечения сепсиса имеет преимущество перед комбинированным назначением антибактериальных средств. Целесообразность назначения комбинации β-лактамных антибиотиков с аминогликозидами, применение которых должно быть ограничено строгими показаниями, прежде всего результатами исследования профиля резистентности возбудителя, является спорной.
Путь введения любых антибактериальных препаратов — только внутривенный. При использовании β-лактамных антибиотиков преимущество имеет метод длительной внутривенной инфузии антибактериального препарата.
В отдельных случаях допускается проведение системной антибиотикотерапии через катетер, установленный после селективной катетеризации артерии (внутриартериальная инфузия). Он применяется как метод преодоления резистентности госпитальных патогенов в очаге инфекции (достигается локальное значительное превышение МПК), а также в случаях инфекций, при которых невозможно обеспечить полноценную санацию первичного инфекционного очага (например, инфицированный панкреонекроз, послеоперационный перитонит, инфицированная диабетическая стопа, хронический остеомиелит и т.п.). Оптимальная длительность проведения антибиотикотерапии сепсиса в большинстве случаев составляет 10-14 суток.
При отсутствии ожидаемого эффекта от проведения лечения необходимо предпринять усилия для поиска несанированных инфекционных очагов, а лишь затем проводить смену антибиотика. Для лечения некоторых инфекций с высоким риском персистирования возбудителей (остеомиелит, бактериальный эндокардит, гнойный менингит, инфекции, вызванные S. aureus) длительность антибиотикотерапии пролонгируется до 3-4 недель.
Кроме этиотропного лечения больным сепсисом показана инфузионная терапия, которая принадлежит к первоначальным мероприятиям поддержания гемодинамики и прежде всего сердечного выброса. Основными задачами инфузионной терапии являются: восстановление адекватной тканевой перфузии, нормализация клеточного метаболизма, коррекция расстройств гомеостаза, снижение концентрации медиаторов септического каскада и токсических метаболитов.
Необходима оптимизация системной гемодинамики (допамин, норадреналин, адреналин, добутамин и др.).
Острая дыхательная недостаточность — один из ведущих компонентов полиорганной дисфункции. Развитие паренхиматозной дыхательной недостаточности является показанием к проведению ИВЛ, различных методов кислородотерапии (лицевые маски, носовые катетеры).
Сепсис сопровождается развитием тяжелых метаболических нарушений, синдромом гиперметаболизма-гиперкатаболизма, прогрессирующей белково-энергетической недостаточности. В этой ситуации покрытие энергетических потребностей происходит за счет деструкции собственных клеточных структур, что усугубляет имеющуюся органную дисфункцию и усиливает эндотоксикоз. Поэтому проведение нутритивной поддержки является крайне важным компонентом лечения и входит в комплекс обязательных лечебных мероприятий. Включение энтерального питания в комплекс интенсивной терапии предупреждает транслокацию микрофлоры из кишечника, развитие дисбактериоза, повышает функциональную активность энтероцита и защитные свойства слизистой оболочки, снижая степень эндотоксикоза и риск возникновения вторичных инфекционных осложнений.
Выбор метода нутритивной поддержки зависит от степени выраженности питательной недостаточности и состояния функций желудочно-кишечного тракта — пероральный прием энтеральных диет, энтеральное зондовое питание, парентеральное питание, парентеральное + энтеральное зондовое питание.
Важным аспектом комплексной ИТ тяжелого сепсиса является постоянный контроль уровня гликемии и инсулинотерапия. Высокий уровень гликемии и необходимость в инсулинотерапии являются факторами неблагоприятного исхода у больных с диагностированным сепсисом. В этой связи необходимо стремиться к поддержанию уровня гликемии в пределах 4,5-6,1 ммоль/л. При уровне гликемии более 6,1 ммоль/л должна проводиться инфузия инсулина (в дозе 0,5-1 ЕД/ч) для поддержания нормогликемии (4,4-6,1 ммоль/л). Контроль концентрации глюкозы — каждые 1-4 часа, в зависимости от клинической ситуации. При выполнении данного алгоритма регистрируется статистически значимое повышение выживаемости.
Одним из характерных проявлений сепсиса являются нарушения системной коагуляции (активация коагуляционного каскада и угнетение фибринолиза), что в итоге приводит к гипоперфузии и органной дисфункции. В этих случаях показано введение активированного протеина С (дротрекогин-а активированный, Зигрис), который оказывает антикоагулянтное, нрофибринолитическое, противовоспалительное действие и защиту эндотелия от апоптоза.
б) Иммунозаместительная терапия. Целесообразность введения внутривенных иммуноглобулинов (IgG и IgG+IgM) связана с их возможностью ограничивать избыточное действие провоспалительных цитокинов, повышать клиренс эндотоксина и стафилококкового суперантигена, устранять анергию, усиливать эффект β-лактамных антибиотиков. Использование внутривенных иммуноглобулинов в рамках иммунозаместительной терапии тяжелого сепсиса и СШ является в настоящее время единственным реально доказанным методом иммунокоррекции при сепсисе, повышающим выживаемость. Наилучший эффект зарегистрирован при использовании комбинации IgG и IgM («пентаглобин»). Наиболее оптимальные результаты при использовании иммуноглобулинов получены в раннюю фазу шока («теплый шок») и у пациентов с тяжелым сепсисом и диапазоном индекса тяжести по APACHE II — 20-25 баллов.
Различные биологически активные вещества и продукты метаболизма, участвующие в развитии генерализованного воспаления, являются основанием для применения методов детоксикации, что становится особенно актуальным при отсутствии естественного печеночно-почечного клиренса в условиях ПОН. Перспективными в этом отношении являются методы заместительной почечной терапии, которые способны воздействовать не только на уремические нарушения гомеостаза у больных, как с острой, так и с хронической почечной недостаточностью, но и оказывать положительное влияние на другие нарушения гомеостаза и органные дисфункции, выявляемые у больных с сепсисом, шоком и полиорганной недостаточностью.
Наиболее мощным способом очищения крови является гемодиафильтрация, сочетающая в себе 2 способа массопереноса — диффузия+конвекция, которая охватывает весь спектр веществ, которые удаляются при гемодиализе и гемофильтрации. Дополнительный вклад в процесс детоксикации вносит сорбционный компонент патологических веществ на мембране гемодиафильтра.
В заключение необходимо отметить, что несмотря на расширение наших представлений о процессах, лежащих в основе генерализованного воспаления, не снижается актуальность проблемы. Многие медиаторы, участвующие в этом процессе, уже установлены, многие остаются пока еще непознанными. Взаимоотношения между медиаторами воспаления могут быть самыми различными и на разных уровнях (в сыворотке, в тканях, на уровне клеточной регуляции и др.), что может предопределять прогноз заболевания. К сожалению, в клинической ситуации измерение этих процессов оказывается очень затруднительным, а иногда — невозможным.
Важность выбора правильной антибактериальной терапии не вызывает сомнения. В настоящее время имеется широкий ассортимент антибактериальных препаратов, активных в отношении как грамотрицательной, так и грамположительной микрофлоры, которые могут быть использованы в виде монотерапии или в виде комбинации. При этом комбинированная терапия предпочтительна на этапе эмпирической терапии и должна быть оптимизирована после получения результатов бактериологических исследований. Для успешной борьбы с этим тяжелым состоянием необходимы меры, направленные на устранение симптомов полиорганной недостаточности. Показана оптимизация системной гемодинамики, восстановление метаболических нарушений, активная детоксикация, применение иммунокорригирующих препаратов и др.
- Вернуться в оглавление раздела "Медицинская микробиология"
Редактор: Искандер Милевски. Дата публикации: 26.6.2020
- Алгоритмы микробиологической диагностики оппортунистических инфекций
- Определение и этиология сепсиса
- Эпидемиология сепсиса (распространенность сепсиса)
- Патогенез сепсиса (механизмы развития сепсиса)
- Классификация сепсиса
- Клинические проявления сепсиса
- Диагностика сепсиса: критерии органной дисфункции, концепция PIRO
- Лечение сепсиса
