Психиатрические проявления заболеваний гипофиза
Гипоталамо-гипофизарная система связана со структурами ЦНС, такими как префронтальная кора и лимбическая система, которые регулируют настроение и личностные черты. С другой стороны, гормоны гипофиза контролируют работу жизненно важных желез, таких как надпочечники, щитовидная железа и половые железы, и, следовательно, дисфункция гипофиза может приводить к возникновению соответствующих гормональных нарушений, которые влияют на структуру и функционирование ЦНС.
Аденомы гипофиза — это гистологически доброкачественные опухоли, которые имеют разнообразные клинические проявления и патогенез. Они гетерогенны по своей гормональной активности и классифицируются с клинической точки зрения на гормонально-активные и гормонально-неактивные аденомы. Гормонально-активные аденомы гипофиза приводят к гиперсекреции гормонов, как это имеет место при акромегалии (гиперсекреция соматотропного гормона, СТГ), болезни Кушинга (гиперсекреция АКТГ) и пролактиномах (гиперсекреция пролактина, ПРЛ), что приводит к развитию специфических проявлений.
Напротив, при гормонально-неактивных аденомах гипофиза может наблюдаться как гипопитуитаризм, так и нормальная функция передней доли гипофиза.
а) Гипопитуитаризм. При гипопитуитаризме у пациентов проявляются симптомы, вызванные дефицитом гормонов, что требует лечения. При отсутствии лечения последствия зависят от наличия дефицита соответствующего гормона. В целом большинство опубликованных исследований гормонально-неактивных аденом гипофиза проводились в условиях проведения полной заместительной гормональной терапии, обеспечивающей нормальное качество жизни, связанное со здоровьем (по оценке Ноттингемского профиля здоровья, SF-36 и Европейской шкалы оценки качества жизни) (Capatina и соавт., 2013).
В большинстве, хоть и не во всех исследованиях, отмечаются худшие показатели у женщин по сравнению с мужчинами. Эти различия могут быть объяснены неодинаковым гормональным статусом и отсутствием специальной шкалы по оценке качества жизни для пациентов с гормонально-неактивными аденомами гипофиза (Webb, 2013).
Что касается личностных характеристик, у пациентов с гормонально-неактивными аденомами гипофиза отмечаются большее беспокойство по поводу будущих событий, пессимизм и повышенная тревожность по сравнению со здоровым населением (Sievers и соавт., 2009а), а также депрессивное поведение и снижение качества сна (Leistner и соавт., 2015) по сравнению с населением в целом. Как и ожидалось, рецидив опухоли и нарушение полей зрения ассоциированы с тревогой, депрессией и ухудшением качества жизни (Capatina и соавт., 2013).
Психиатрические проявления у пациентов с дефицитом гормона роста напрямую связаны с депрессией, враждебностью, параноидальными идеями, тревогой, психотицизмом и когнитивными нарушениями. Рецепторы СТГ широко распространены в ЦНС, поэтому эти симптомы, хотя бы частично, устраняются на фоне заместительной терапии рекомбинантным СТГ (Marie и соавт., 2010).
б) Болезнь Кушинга. Эндогенный гиперкортицизм и, в частности, болезнь Кушинга (БК), которая возникает вследствие развития АКТГ-продуцирующей аденомы гипофиза, являются заболеваниями, психические проявления которых чаще всего описываются в литературе. Харви Кушинг в своей первой работе, опубликованной в 1932 г., включил эмоциональные расстройства в описание классической клинической картины БК.
Наиболее частыми психиатрическими проблемами, обнаруживаемыми при БК, являются большая депрессия с изменениями настроения, аффективных и когнитивных функций, а также мания и тревожность.
О большой депрессии сообщалось у 54% пациентов; изменения настроения, например, раздражительность, были выявлены у 86%; депрессивное настроение — у 74% пациентов с БК; 66% пациентов сообщают о генерализованном тревожном или паническом расстройстве. Биполярные расстройства возникают у 30% пациентов с БК (Pivonello и соавт., 2015).
Суицидальные мысли и попытки также были зарегистрированы в 17% и 5% случаев соответственно (Starkman, 2013). Также были описаны изменения аппетита и нарушение сна у 54% и 69% пациентов соответственно. Нейрокогнитивные нарушения, потеря памяти и способности к умственной концентрации могут наблюдаться у 80% пациентов с БК (Pivonello и соавт., 2015). Степень тяжести всех этих нарушений варьируется и во время активной фазы заболевания иногда в значительной степени зависит от интенсивности гиперкортицизма (Pivonello и соавт., 2015; Conner и Solomon, 2017).
Лечение БК с помощью транссфеноидального хирургического вмешательства, медикаментозной терапии, лучевой терапии или адреналэктомии в значительной доле случаев приводит к разрешению гиперкортицизма. Однако, хотя нормализация динамики секреции кортизола обычно ассоциирована со значительным регрессом осложнений БК, не всегда удается добиться ремиссии. Это относится к остеопорозу, избыточному отложению жира в организме, сердечно-сосудистому риску и психическим расстройствам.
Таким образом, в то время как некоторые исследования документально подтверждают снижение уровня депрессии, тревожности и раздражительности после нормализации активности гипоталамо-гипофизарно-надпочечниковой системы, другие наблюдения показывают, что восстановление психологического состояния происходит только частично, даже спустя долгое время после достижения биохимической ремиссии БК (Pivonello и соавт., 2015). Психиатрические проявления серьезно влияют на качество жизни у пролеченных пациентов с БК.
Опять же, как и при акромегалии, существует значительное несоответствие между показателями гормональной активности, в данном случае ночным уровнем кортизола в плазме или свободного кортизола в моче, и качеством жизни после успешного лечения БК (Pivonello и соавт., 2015).
Механизмы, участвующие в патогенезе психиатрических и нейроког-нитивных осложнений гиперкортизолизма, частично связаны с наличием большого количества глюкокортикоидных рецепторов во многих отделах ЦНС, включая переднюю часть поясной извилины, гиппокамп и миндалину — ключевые структуры, связанные с реакцией на стресс со стороны памяти и поведения.
Хронический гиперкортицизм, вызванный БК, вызывает различные метаболические нарушения, включая развитие инсулинорезистентности, центральное ожирение, воспаление и преобладание процессов катаболизма. Снижение нейронального захвата глюкозы и снижение нейротрофических факторов, вызванное гиперкортизолемическим состоянием, приводит к подавлению нейрогенеза, атрофии мозга, уменьшению объема гиппокампа и потере памяти (рис. ниже). Повышение нейротоксичности из-за усиленного действия возбуждающих аминокислот также способствует атрофии дендритов (Pivonello и соавт., 2015).
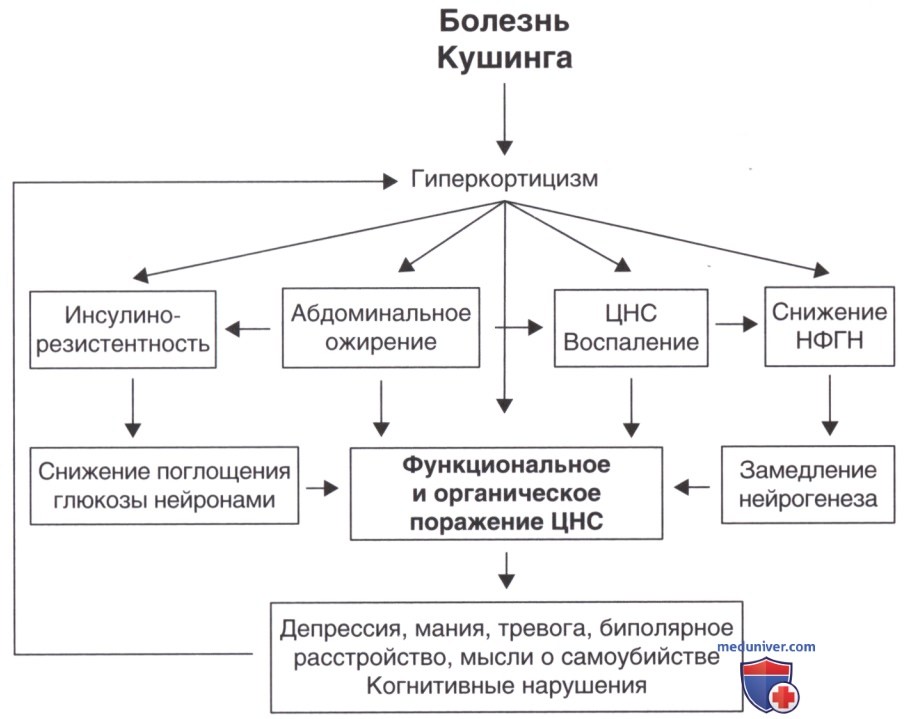
Каковы бы ни были механизмы, последние исследования показали, что объем серого вещества, особенно на уровне коры головного мозга, при БК по сравнению со здоровыми людьми уменьшается даже после достижения ремиссии (Andela и соавт., 2015). Связь между функциональными изменениями и морфологической картиной, наблюдаемой при МРТ, ясна не во всех исследованиях, но в целом эти результаты указывают на тот факт, что гиперкортизолемическая нейротоксичность играет роль в развитии длительных психических и функциональных нарушений как во время активной фазы заболевания, так и после достижения биохимической ремиссии БК.
в) Акромегалия. Акромегалия — это заболевание, которое возникает в результате избыточной секреции гормона роста, как правило, СТГ-секретирующей аденомой гипофиза, после завершения продольного роста тела. Акромегалия вызывает серьезные прогрессирующие изменения строения лица, которые могут существенно влиять на настроение. Кроме того, существует множество других симптомов, таких как астения и гипергидроз, а также могут наблюдаться сопутствующие гормональные нарушения, такие как сахарный диабет, гиперан-дрогения, гипогонадизм и дисфункция щитовидной железы.
Первоначальные описания болезни Пьером Мари включали психиатрические проявления как часть симптоматического спектра акромегалии. Как и в случае с другими заболеваниями гипофиза, используются различные шкалы для установления наличия психопатологии. Sievers и соавт. (2009b) обнаружили, что частота развития психических и аффективных расстройств составляет 45,7% и 34,6% соответственно, у пациентов с акромегалией, что выше значений, наблюдаемых у пациентов с хроническими заболеваниями и здоровой контрольной группы. Аффективные расстройства были вызваны главным образом депрессивными эпизодами и дистимией.
Частота развития тревожных расстройств, напротив, не увеличилась. Большинство психических нарушений уже существовали до того, как был установлен диагноз акромегалии; это позволяет предположить, что психиатрические проявления могут предшествовать развитию гиперпродукции гормона роста. Кроме того, предиктором увеличения частоты развития психических расстройств служила лучевая терапия. Это может быть связано либо с тяжестью заболевания, либо с прямым воздействием самой лечебной процедуры. Та же исследовательская группа дополнительно сообщила о снижении стремления к познавательной деятельности и меньшей импульсивности (Sievers и соавт., 2009а).
Недавнее исследование с использованием SF-36 и более специфического опросника AcroQol продемонстрировало, что и депрессия, и тревожность были определяющими факторами качества жизни у пациентов с акромегалией (Geraedts и соавт., 2015). Другие психопатологические проявления включают повышенную раздражительность, тоску, нетерпимость, социальную изоляцию, нарушения сна и даже психозы (Szczesniak и соавт., 2015). В целом эти исследования показывают, что ухудшение качества жизни в большей мере связано с психопатологией, чем со степенью биохимического контроля, поэтому особенно выделяется роль расстройства настроения в общем успехе лечения.
Механизмы развития этих эффектов изучены недостаточно, однако как СТГ, так и ИФР-1, которые повышаются при акромегалии, а также связанные с ними метаболические осложнения, такие как инсулинорезистентность и диабет, играют потенциальную роль в дифференцировке клеток, выживании и ингибирование апоптоза нейронов (Sievers и соавт., 2009b). Анатомически у пациентов с акромегалией наблюдаются макроскопические изменения архитектуры мозга, включая увеличение объема серого и белого вещества (Sievers и соавт., 2012), что может помочь объяснить как функциональные, так и сосудистые нарушения на уровне ЦНС.
г) Гиперпролактинемия. Большинство клинических исследований, направленных на изучение взаимосвязи между гиперпролактинемией и психическими заболеваниями, основано на изучении преобладания и патофизиологии секреции пролактина у пациентов, принимающих психотропные препараты, в основном антипсихотические средства, которые на самом деле могут обладать мощным стимулирующим действием на синтез пролактина. У пациентов, страдающих психическими заболеваниями, гиперпролактинемия в большинстве случаев вызвана действием наркотических препаратов, блокирующих дофамин, таких как галоперидол и рисперидон, а также других психотропных препаратов, например, агонистов серотонина.
Тем не менее некоторые клинические наблюдения указывают на то, что гиперпролактинемия присутствует у 39% пациентов с шизофренией, не получавших антипсихотическую терапию (Riecher-Rossler, 2013), что позволяет предположить, что гиперпролактинемия может быть обусловлена приемом лекарств не во всех случаях. Предыдущие исследования показали, что пациенты с гиперпролактинемией демонстрируют более высокий уровень враждебности, беспокойства и депрессии, чем пациенты с нормопролактинемией, и эти эффекты, по-видимому, ослабевают после лечения бромокриптином (Liao и Bai, 2014).
Гиперпролактинемия может быть связана со стрессом; хорошо известно, что повышение концентрации пролактина в плазме может вызывать изменения в активности дофаминергической системы в ЦНС и, с другой стороны, снижать секрецию эстрогена яичниками, вызывая гипогонадотропный гипогонадизм. В настоящее время имеются некоторые свидетельства в пользу защитной роли эстрогенов в отношении нейрокогнитивного дефицита при шизофрении. Эти открытия создают необходимость в дополнительных исследованиях, направленных на изучение потенциальных эффектов гиперпролактинемии как основного фактора развития психических расстройств (Riecher-Rossler, 2017) либо за счет прямого воздействия, либо за счет снижения эстрогенового тонуса.
Видео гормоны гипофиза в норме и при патологии
- Читать "Психиатрические проявления заболеваний половых желез"
Редактор: Искандер Милевски. Дата публикации: 7.2.2023
- Неврологические проявления заболеваний гипофиза
- Неврологические проявления заболеваний щитовидной железы
- Неврологические проявления заболеваний надпочечников
- Неврологические проявления заболеваний околощитовидных желез
- Неврологические проявления заболеваний половых желез
- Неврологические проявления ожирения
- Неврологические проявления сахарного диабета
- Психиатрические проявления эндокринных заболеваний
- Психиатрические проявления заболеваний гипофиза
- Психиатрические проявления заболеваний половых желез
