Биохимические методы идентификации микобактерий
Биохимические методы исследования применяют для окончательной идентификации видов НТМБ. Они основаны на определении активности ряда ферментов и толерантности микобактерий к различным химическим агентам.
а) Полуколичественный метод определения каталазы по Kubica. Каталаза — внутриклеточный фермент, способный расщеплять перекись водорода на воду и кислород. Наличие фермента определяется путем добавления перекиси водорода в исследуемую культуру МБ и наблюдения за образованием пузырьков кислорода. Фактически все МБ, за исключением М. gastri и некоторых непатогенных штаммов М. kansasii, имеют этот фермент. Виды каталазопродуцирующих МБ различаются по степени каталазной активности, которую определяют у интактных клеток полуколичественным методом, и по термостабильности фермента, которую определяют при нагревании культуры до 68°С.
С помощью этого метода МБ можно разделить на 2 группы — с низкой каталазной активностью (продукция пузырьков менее 45 мм) и с высокой каталазной активностью (продукция пузырьков более 45 мм). К МБ, обладающим низкой каталазной активностью, относятся МБТ, М. bovis, М. marinum, MAC, М. xenopi и М. malmoense. Другие виды МБ обладают высокой каталазной активностью.
Материал и метод:
1. Приготовленную среду Левенштейна-Йенсена разливают по 5 мл в пробирки. При свертывании среды пробирки должны находиться в вертикальном положении (без скоса).
2. На горизонтальную поверхность среды засевают 0,2 мл бактериальной суспензии, инкубируют в течение 2-3 недель при 35-37°С.
3. Готовят свежий раствор перекиси водорода: 0,2 мл пергидроля на 10 мл дистиллированной воды.
4. В пробирку с выросшей культурой добавляют 1 мл раствора перекиси водорода и измеряют высоту колонки пузырьков в миллиметрах после 5-минутной выдержки пробирки в вертикальном положении при комнатной температуре. По высоте колонки пузырьков — более 45 мм или менее 45 мм — определяют степень каталазной активности.
б) Метод определения термостабильной каталазы (68°С) по Kubica. Некоторые виды МБ теряют каталазную активность при нагревании культуры до 68°С. К ним относятся МБТ, М. bovis, М. gastri. Термостабильную каталазу продуцируют М. kansasii, М. gordonae, М. scrofulaceum, M.fortuitum и многие другие виды МБ.
Материал и метод:
1. Готовят свежий раствор перекиси водорода: 0,2 мл пергидроля на 10 мл дистиллированной воды.
2. Для приготовления 100 мл фосфатного буфера pH 7,0 берут:
61,1 мл 0,067 М раствора двузамещенного фосфорнокислого натрия (9,47 г Na2PO4 на 1 л дистиллированной воды);
38,9 мл 0,067 М раствора однозамещенного фосфорнокислого калия (9,07 г КН2РO4 на 1 л дистиллированной воды).
3. Тестируют хорошо выросшие, изолированные колонии МБ со среды Левенштейна-Йенсена.
4. Готовят суспензию МБ в 0,5 мл фосфатного буфера pH 7,0, помещают пробирку на водяную баню с температурой воды 68°С на 20 мин. Затем охлаждают суспензию до комнатной температуры и добавляют 0,5 мл приготовленного раствора перекиси водорода. Наблюдают за образованием пузырьков или их отсутствием. Пробирки с реагирующим раствором выдерживают в течение 20 мин, прежде чем зарегистрировать отрицательный результат.
5. Контрольными штаммами при определении каталазы служат МБТ, как отрицательный, и М. kansasii, как положительный контроль.
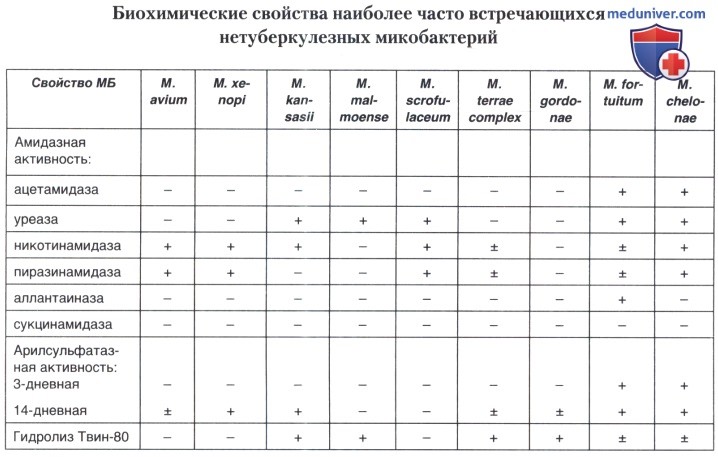
в) Метод восстановления нитратов по Tsukamura. Способность некоторых видов МБ восстанавливать нитраты в нитриты используется для дифференциации культур, которые обладают сходными бактериологическими свойствами. Так, МБТ, М. kansasii, М. szulgai и многие быстрорастущие МБ способны восстанавливать нитраты, М. bovis, М. avium и М. chelonae не имеют этого фермента.
Материал и метод:
1. Культуру выращивают на плотной питательной среде в течение 3-4 недель.
2. Для приготовления М/15 фосфатного буфера pH 7,1 берут:
а) М/15 раствор однозамещенного фосфорнокислого калия (9,078 г КН2PO4 на 1 л дистиллированной воды);
б) М/15 раствор двузамещенного фосфорнокислого натрия (11,876 г Na2HPO4 на 1 л дистиллированной воды).
Для получения 100 мл фосфатного буфера pH 7,1 берут 33,4 мл раствора «а» и 66,6 мл раствора «б».
3. Готовят 0,1%-ный раствор нитрата натрия в фосфатном буфере. Навеску в 100,0 мг NaNO3 растворяют в 100 мл фосфатного буфера, стерилизуют в течение 20 мин при температуре 120°С, хранят в холодильнике. Перед постановкой реакции нагревают до комнатной температуры.
4. Готовят реактив Эрлиха: 2 г парадиметиламинобензальдегида растворяют в 100 мл 10 %-ного раствора соляной кислоты.
5. 10,0 мг влажной массы испытуемой культуры со среды Левенштейна-Йенсена вносят в пробирку с 1мл 0,1 %-ного раствора нитрата натрия в фосфатном буфере. Инкубируют при 37°С в течение 24 ч.
По истечении срока инкубации в пробирку добавляют 2 капли реактива Эрлиха и 0,5 мл 10 %-ного раствора соляной кислоты. Если испытуемая культура содержит фермент, восстанавливающий нитраты в нитриты, то при добавлении реактива Эрлиха раствор окрасится в желтый цвет (реакция положительная). В случае отсутствия у испытуемой культуры этого фермента — раствор останется бесцветным (реакция отрицательная). На получение положительного результата влияет возраст исследуемой культуры (3-4 недели) и ее количество. В случае получения отрицательного результата рекомендуется повторить реакцию.
г) Метод определения арилсульфатазной активности по Wayne. Арилсульфатаза гидролизует связь между сульфатной группой и ароматическим кольцом трикалий фенолфталеин дисульфата, входящего в ростовую среду, с образованием свободного фенолфталеина. Наличие свободного фенолфталеина определяется по красному цвету среды, который появляется после добавления щелочи. Быстрорастущие МБ обладают арилсульфатазной активностью, поэтому постановка этого теста существенно помогает видовой идентификации МБ. 3-дневная арилсульфатаза используется главным образом для идентификации потенциально патогенных быстрорастущих видов. Только M. fortuitum и М. chelonae отщепляют фенолфталеин от трикалий фенолфталеин дисульфата в течение 3 дней.
14-дневная арилсульфатаза может быть использована для идентификации таких видов МБ, как М. таппит, М. xenopi, М. triviale, М. smegmatis и M. flavescens.
Материал и метод:
1. Готовят среду для выращивания МБ: к 100 мл расплавленного питательного агара добавляют 1 мл глицерина и 65,0 мг трикалий фенолфталеин дисульфата. Агар разливают в пробирки по 2-3 мл, автоклавируют при 0,5 атм в течение 15 мин и дают застыть при вертикальном положении пробирок.
2. Готовят индикатор — 1 М раствор углекислого натрия (5,3 г Na2CO3 на 100 мл дистиллированной воды). Приготовленный раствор хранят в холодильнике.
3. Суспензию испытуемой культуры в количестве 0,2 мл засевают на поверхность приготовленной среды, инкубируют при 37°С в течение 3-14 дней. После окончания инкубации к выросшей культуре добавляют индикатор. Появление малиновой окраски среды при добавлении индикатора свидетельствует о наличии фермента арилсульфатазы у данной культуры. Фермент гидролизовал связь сульфатной группы с ароматическим кольцом трикалий фенолфталеин дисульфата с освобождением фенолфталеина, который при добавлении индикатора окрасил среду в красный цвет — положительная реакция. В случае отсутствия у испытуемой культуры этого фермента цвет среды не изменится (отрицательная реакция).
д) Метод гидролиза Твин-80 по Wayne. Липазы, которые продуцируют некоторые виды МБ, гидролизуют Твин-80 до олеиновой кислоты и нолиоксиэтиленсорбитола. Нейтральный красный в среде с pH 7,0 связан с Твин-80 и имеет янтарный цвет. При гидролизе Твин-80 нейтральный красный освобождается и приобретает свой обычный цвет. Этот метод используется для идентификации потенциально патогенных и сапрофитных МБ. Так, М. gordonae и М. malmoense гидролизуют Твин-80, a MAC и М. scrofulaceum не гидролизуют его.
Материал и метод:
1. Для приготовления 100 мл М/15 фосфатного буфера pH 7,0 берут:
а) М/15 раствор однозамещенного фосфорнокислого калия (9,078 г KH2PO4), на 1 л дистиллированной воды);
б) М/15 раствор двузамещенного фосфорнокислого натрия (11,876 г Na2HPO4 на 1 л дистиллированной воды).
Для получения 100 мл фосфатного буфера pH 7,0 берут 38,9 мл раствора (а) и 61,1 мл раствора (б).
2. Берут 0,5 мл Твин-80.
3. Готовят 2 мл 0,1 %-ного водного раствора нейтрального красного.
4. Смешивают 100 мл фосфатного буфера, 0,5 мл Твин-80 и 2 мл раствора нейтрального красного, разливают по 4 мл в пробирки и автоклавируют 15 мин при 0,5 атм., хранят в холодильнике.
5. Эмульгируют 1 лопаточку исследуемой культуры в пробирке с приготовленным реактивом. Инкубируют при 37°С.
6. Реакцию читают через 5-10 дней. Если испытуемая культура обладает липазой, которая гидролизует Твин-80, то нейтральный красный освобождается из соединения и приобретает свой обычный цвет. Реакция считается положительной, если соломенно-желтый цвет жидкой среды изменяется на красный.
е) Метод определения устойчивости к хлористому натрию. Тест применяется для дифференциации быстро- и медленнорастущих НТМБ: быстрорастущие устойчивы к 5%-ному хлористому натрию, а медленнорастущие теряют способность расти в его присутствии. Из медленнорастущих МБ только М. triviale способны расти на среде, содержащей 5 % хлористого натрия. Из клинически значимых быстрорастущих МБ М. chelonae подвид chelonae не растет на этой среде.
Материал и метод:
1. Используют суспензию микобактерий высокой плотности.
2. Среда Левенштейна-Йенсена, с добавлением 5% NaCl, и среда без NaCl (контроль).
3. Все испытуемые культуры засевают по 0,1 мл бактериальной суспензии в 2 пробирки с хлористым натрием и без него, инкубируют при 37°С. Регистрируют результат роста культуры через 1 или 4 недели.
ж) Метод восстановления теллурита калия по Kilburn. В основе метода лежит восстановление бесцветного теллурита калия до металлического теллура, имеющего черную окраску. MAC способны восстанавливать теллурит в течение 3-4 дней, поэтому это свойство используют для отделения М. avium от других нефотохромогенных видов МБ. Некоторые быстрорастущие МБ также могут восстанавливать теллурит в короткие сроки.
Материал и метод:
1. Берут 7-дневную культуру МБ, выросшую в 5 мл жидкой среды Миддлбрука 7 Н9. Среда должна быть интенсивно мутной — признак массивного роста культуры.
2. Готовят 0,2 %-ный водный раствор теллурита калия (0,1 г K2TeO3 на 50 мл дистиллированной воды). После того как соль растворится, реактив разливают в пробирки по 2-5 мл и автоклавируют при 120°С в течение 10 мин. В каждую пробирку с массивным ростом культуры добавляют по 2 капли раствора и ставят в термостат при 37°С. Наблюдают за культурами в течение 4 дней и более. Положительный результат определяется по появлению черного преципитата металлического теллура на дне пробирки.
з) Метод определения амидазной активности по Taequet. В основе метода лежит способность различных видов МБ использовать в процессе метаболизма определенные амиды. Амидазная активность — постоянное свойство микроорганизмов. Ферментативное разложение амидов сопровождается выделением аммиака, наличие которого определяют с помощью реактива Несслера.
Материал и метод:
1. Для приготовления синтетической питательной среды pH 6,9 для выращивания МБ берут: пептон — 2,0 г, питательный агар — 40,0 г, хлористый натрий — 10,0 г, однозамещенный фосфорнокислый калий — 4,0 г, глицерин — 20 мл, дистиллированную воду — до 2 л. Среду разливают в пробирки по 5 мл, автоклавируют при 0,5 атм. в течение 20 мин. Дают остыть при комнатной температуре в наклонном положении пробирок (со скосом).
2. Готовят навески амидов: ацетамид — 1,0 г, мочевина — 1,0 г, никотинамид — 0,75 г, пиразинамид — 0,5 г, аллантоин — 0,4 г, сукцинамид — 0,25 г, проиионамид — 0,5 г. Каждый амид растворяют в 25 мл дистиллированной воды, стерилизуют через бактериальные фильтры или на водяной бане с температурой воды 100°С в течение 30 мин; раствор мочевины стерилизуют только через бактериальные фильтры. На поверхность готовой агаровой среды стерильно вносят по 0,5 мл аллантоина и сукцинамида, остальные амиды — по 0,25 мл. Растворам дают впитаться в поверхность среды в течение 2-3 дней при комнатной температуре.
3. Используют реактив Несслера коммерческого производства (ОАО «Уральский завод химических реактивов» — ТУ 6-09-2089-77). Приготовление реактива Несслера в условиях лаборатории не проводится ввиду того, что в его состав входит металлическая ртуть.
4. На поверхность агаровой среды с различными амидами и в контрольную среду (не содержащую амидов) засевают по 0,2 мл суспензии НТМБ. Засеянные пробирки инкубируют при 37°С. При появлении (через 1 или 3-4 недели) видимых на глаз колоний на всей поверхности среды регистрируют результат исследования. В пробирки добавляют по 0,5 мл реактива Несслера. Оранжево-коричневая окраска реактива в опытной пробирке доказывает образование аммиака в результате ферментативного разложения амида — реакция оценивается как положительная. Результаты следует учитывать сразу после добавления реактива Несслера, так как в дальнейшем могут происходить неспецифические реакции.
Представленные выше биохимические методы идентификации позволяют окончательно установить видовую принадлежность НТМБ. Биохимические свойства лежат в основе определения вида культур, выделенных из патологического материала.
Очень важно в наиболее короткий срок установить принадлежность выделенной культуры к потенциально патогенным или сапрофитным МБ. Знание лечащим врачом видовой принадлежности МБ определит его дальнейшую тактику. Так, при однократном выделении из патологического материала потенциально патогенных МБ необходимо решить вопрос об установлении диагноза микобактериоза или о назначении дополнительных бактериологических исследований. Частые находки сапрофитов в патологическом материале, особенно в промывных водах бронхов, могут указывать на возможную его контаминацию при сборе материала.
- Читать далее "Хроматографические методы идентификации микобактерий"
Редактор: Искандер Милевски. Дата публикации: 31.3.2020
- Условно-патогенные микобактерии (Mycobacterium)
- Внутривидовые различия условно-патогенных микобактерий (Mycobacterium)
- Патогенность нетуберкулезных микобактерий
- Бактериологическая диагностика инфекций вызванных нетуберкулезными микобактериями
- Бактериоскопическая диагностика нетуберкулезных микобактерий
- Культуральный метод выявления микобактерий (метод посева)
- Автоматические анализаторы для выявления микобактерий
- Родовая идентификация микобактерий
- Проведение дифференциации нетуберкулезных микобактерий от микобактерий туберкулезного комплекса
- Биохимические методы идентификации микобактерий
- Хроматографические методы идентификации микобактерий
- Молекулярно-генетические методы идентификации нетуберкулезных микобактерий
- Методы определения лекарственной чувствительности нетуберкулезных микобактерий
