Проведение дифференциации нетуберкулезных микобактерий от микобактерий туберкулезного комплекса
Не существует какого-либо одного лабораторного теста, позволяющего с достоверностью отличить потенциально патогенные микобактерии от комплекса М. tuberculosis. Тем не менее, сочетание вышеописанных признаков с результатами ряда биохимических исследований позволяет провести четкую идентификацию микобактерий комплекса М. tuberculosis.
Первым этапом исследования выделенной культуры является дифференциация микобактерий туберкулезного комплекса от нетуберкулезных микобактерий.
Для этого необходимо определить способность выделенной культуры микобактерий расти на среде Левенштейна -Йенсена с добавлением 1 мг/мл и 0,5 мг/мл салициловокислого натрия. Нетуберкулезные микобактерии хорошо растут на среде с салициловокислым натрием, рост от пышного до стелющегося, пленчатого. Микобактерии туберкулезного комплекса, напротив, не растут на этой среде.
а) Тест с салициловокислым натрием (салицилатный тест). Микобактерии комплекса М. tuberculosis не обладают способностью утилизировать салициловокислый натрий, который оказывает на рост МБТ угнетающее воздействие. Это свойство салицилата натрия используется как один из основных биохимических методов дифференциации М. tuberculosis и нетуберкулезных микобактерий.
б) Приготовление среды с салициловокислым натрием. Приготовить 2 навески салициловокислого натрия — 50 мг и 100 мг, каждую растворить в 1 мл дистиллированной воды. Раствор подогреть над пламенем горелки до кипения и дать остыть до комнатной температуры. Охлажденный раствор салициловокислого натрия добавить к 100 мл среды Левенштейна-Йенсена и тщательно размешать. Контрольную среду без препарата готовить одновременно с опытными. Среду с салицилововокислым натрием в двух концентрациях и контрольную среду разлить по пробиркам и поместить в аппарат-свертыватель «АСИС». Проводить коагуляцию при 85° С в течение 45 минут.
Указанный тест рекомендуется проводить одновременно с определением лекарственной чувствительности выделенной культуры, дополнительно используя 2 пробирки — с 0,5 мг/мл и 1,0 мг/мл салициловокислого натрия. Посев суспензии исследуемой культуры микобактерий и учет результатов теста производят одновременно с посевом на среды, содержащие противотуберкулезные препараты. Учет результатов теста проводят одновременно с регистрацией результатов испытания лекарственной устойчивости исследуемой культуры.
Микобактерии туберкулеза не растут на этой среде. Однако около 10% культур МБТ могут давать незначительный рост на среде с 0,5 мг/мл салициловокислого натрия (культура, давшая рост на среде с препаратом менее 20 колоний, расценивается как чувствительная) и никогда не растут на среде с концентрацией препарата 1,0 мг/мл. В то же время некоторые культуры нетуберкулезных микобактерий дают на среде с 1,0 мг/мл салициловокислого натрия очень слабый рост. Чтобы избежать диагностических ошибок, следует использовать среду с салициловокислым натрием в двух разведениях.
В сомнительных случаях увеличивать срок инкубации до 4 недель и проводить тщательный осмотр поверхности среды. Наличие стелющегося мембраноподобного роста культуры расценивается как положительный результат. В случае появления незначительного роста М. tuberculosis на среде с салициловокислым натрием необходимо подтвердить видовую принадлежность культуры с помощью дополнительных биохимических тестов.
В некоторых случаях при постановке салицилатного теста наблюдается почернение, побурение среды с салициловокислого натрия без изменения цвета среды в контрольной пробирке. Способность вызывать деградацию салициловокислого натрия с образованием катехолов является отличительной особенностью М. fortuitum и М. chelonae.
Следовательно, культуры, которые дали рост на среде с салициловокислым натрием, относятся к нетуберкулезным микобактериям (НТМБ) и подлежат дальнейшему изучению.

в) Видовая идентификация нетуберкулезных микобактерий. Видовая идентификация потенцально патогенных микобактерий по степени сложности применяемых методов подразделяется на первичную и окончательную. Первичная идентификация основана на морфологических и бактериологических свойствах МБ и может проводиться в лабораториях противотуберкулезных диспансеров (ПТД). Окончательная идентификация основана на изучении биохимических свойств и культуральных потребностей МБ и осуществляется в бактериологических лабораториях третьего уровня.
г) Первичная идентификация НТМБ. Исследование большого числа МБ показало, что их морфологические и бактериологические свойства наиболее постоянны и специфичны для характеристики вида. Наличие или отсутствие пигмента, так же как его образование под действием света, являются абсолютными признаками всех исследованных видов МБ. Свойство отдельных видов МБ расти в определенном температурном диапазоне также служит надежным признаком идентификации. Другой характерной особенностью НТМБ является скорость роста, или время, необходимое для образования сформированных колоний. По этому признаку МБ подразделяются на быстро- и медленнорастущие.
Таким образом, первичная идентификация основана на таких признаках, как скорость роста, способность образования пигмента, морфология колоний и способность роста при различных температурах. Для выявления этих признаков не требуется дополнительное оборудование и реактивы, так что их можно определять в бактериологических лабораториях ПТД.
1. Морфология колоний. При осмотре колоний микобактерий отмечают:
• состояние поверхности — грубая, шершавая (R-форма), гладкая, блестящая (S-форма), промежуточное состояние;
• форму — плоская, куполообразная, с приподнятым центром;
• пышный рост — эугонический;
• слабый, стелющийся, выпотевающий рост — дисгонический.
Большинство НТМБ имеют гладкие, круглые, влажные, возвышенные, блестящие колонии, хорошо эмульгирующиеся в воде. Кремового цвета колонии быстрорастущих M.fortuitum бывают сухие и морщинистые, поэтому их иногда ошибочно принимают за М. tuberculosis. Неокрашенные, шершавые, толстые, с неровными краями колонии встречаются среди культур М. kansasii и М. teirae complex.
Скорость роста определяется по времени, необходимому для формирования видимых, хорошо сформированных колоний на плотной среде. МБ, которые формируют такие колонии в период до 7 дней, называются быстрорастущими. К классическим представителям быстрорастущих МБ относятся М. fortuitum и М. chelonae. Для их полного роста требуется менее 5 дней. Если формирование колоний требует более длительного периода времени, МБ называются медленнорастущими.
Однако быстрорастущим МБ в некоторых случаях необходим более длительный период для формирования видимых колоний — например, при выделении их из диагностического материала. Наоборот, избыток посевного материала может заметно ускорить рост медленнорастущих МБ. Поэтому скорость роста МБ оценивают по скорости роста субкультуры. С этой целью 0,1 мл суспензии тестируемой культуры в стандартном разведении засевают на плотную яичную среду и инкубируют при температуре 37°С. Наблюдение за культурой в первые 5-7 дней ведется ежедневно, далее — еженедельно, до момента появления видимого роста.
2. Рост при разных температурах. Для определения способности роста при разных температурах суспензию культуры засевают на среду Левенштейна-Йенсена и инкубируют при 22, 28, 37 и 45°С. Почти все виды НТМБ хорошо растут при 22°С.
Интенсивность роста культур М. avium при повышении температуры от 22 до 37°С меняется с 76,5 до 100%. При 45°С растут только 86% культур, причем массивность роста при температуре 37°С у всех культур более выражена, чем при температуре 45°С.
М. xenopi относятся к термофилам. Для них характерно почти полное отсутствие роста при 22°С и 100%-ный рост при 37 и 45°С, но, в отличие от MAC, более массивный рост отмечается при 45°С. Приблизительно две трети культур растут при 52°С. Однако в некоторых случаях этот рост очень слабый, формируются лишь единичные колонии.
3. Пигментация и фотореактивность. Колонии НТМБ могут иметь как кремовую, так и интенсивную желто-оранжевую окраску. В зависимости от окраски колоний и способности образования пигмента под действием света нетуберкулезные микобактерии делятся на следующие 3 группы.
1) Фотохромогенные МБ окрашиваются в желтые тона только под действием света, в темноте они имеют кремовый цвет. Для определения фотохромогенных свойств суспензию культуры засевают на 2 пробирки со средой Левенштейна-Йенсена. Через 8-10 дней инкубации при температуре 37°С появляется инициальный рост культуры. Одну из пробирок помещают на 2 часа под яркий солнечный или электрический свет, затем пробирку снова инкубируют в термостате и через 1-2 дня проверяют окраску культуры. Если под воздействием света культура приобрела желтую окраску, а в контрольной пробирке осталась кремовой, то это фотохромогенная культура. Типичным представителем этой группы является М. kansasii.
2) Скотохромогенные МБ — продуцируют пигмент от интенсивно-желтого до оранжевого цвета при росте как на свету, так и в темноте. К ним относятся М. gordonae и М. xenopi.
3) Нефотохромогенные МБ — не образуют пигмент, их колонии имеют только светло-желтые и кремовые оттенки. Среди них встречаются культуры, которые изменяют окраску в процессе старения или при неблагоприятных условиях роста (22°С).
Применение самых простых бактериологических методов позволяет идентифицировать 10 из 18 наиболее часто встречающихся в практических лабораториях НТМБ. При еженедельном просмотре посевов исследуют появление раннего роста культуры, пигментацию колоний, диапазон температурного режима, что дает возможность определить вид микобактерий. Специфичность первичной идентификации составляет в среднем 94,3% (от 91 до 100% по различным признакам).
В то же время многие виды МБ обладают сходными бактериологическими свойствами, и идентифицировать их с помощью методов первичной идентификации не представляется возможным. С другой стороны, свойства одних и тех же видов МБ, по данным различных авторов, достаточно вариабельны, что может быть связано как с чувствительностью методов, применяемых для исследования, так и с внутривидовыми различиями. Поэтому для уточнения видовой принадлежности НТМБ необходимо исследовать их биохимические свойства. Так, способность восстанавливать нитраты отличает М. fortuitum от М. chelonae; термостабильность каталазы характерна для скотохромогенной М. gordonae в отличие от М. scrofulaceum.
д) Окончательная идентификация с применением сложных биохимических исследований проводится в специализированных лабораториях. Она включает в себя определение нитратредуктазной, арилсульфатазной и амидазной активности, каталазы, способности, к гидролизу Твин-80, восстановлению теллурита калия, росту на среде с хлористым натрием.
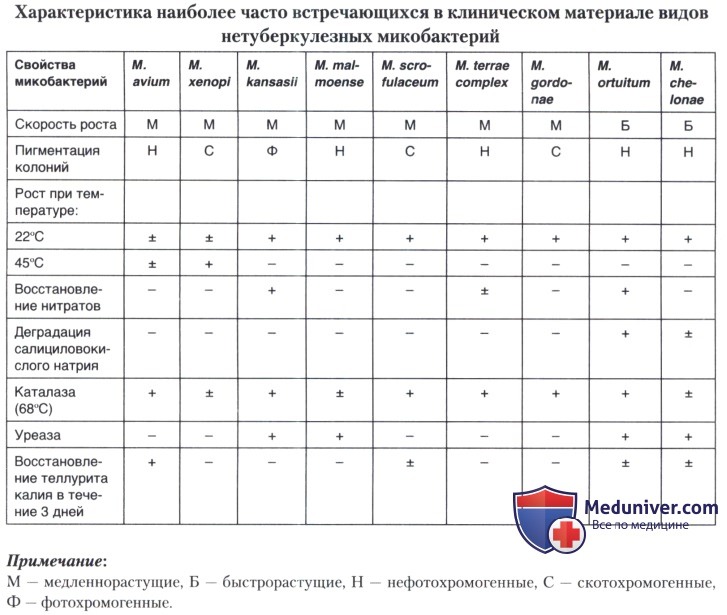
Результаты исследования бактериологических свойств НТМБ позволяют выбрать биохимические тесты, необходимые для их окончательной идентификации. Биохимический профиль и морфологические свойства испытуемого штамма следует сопоставить с данными табл. 1.5.6, чтобы определить вид МБ.
- Читать далее "Биохимические методы идентификации микобактерий"
Редактор: Искандер Милевски. Дата публикации: 31.3.2020
- Условно-патогенные микобактерии (Mycobacterium)
- Внутривидовые различия условно-патогенных микобактерий (Mycobacterium)
- Патогенность нетуберкулезных микобактерий
- Бактериологическая диагностика инфекций вызванных нетуберкулезными микобактериями
- Бактериоскопическая диагностика нетуберкулезных микобактерий
- Культуральный метод выявления микобактерий (метод посева)
- Автоматические анализаторы для выявления микобактерий
- Родовая идентификация микобактерий
- Проведение дифференциации нетуберкулезных микобактерий от микобактерий туберкулезного комплекса
- Биохимические методы идентификации микобактерий
- Хроматографические методы идентификации микобактерий
- Молекулярно-генетические методы идентификации нетуберкулезных микобактерий
- Методы определения лекарственной чувствительности нетуберкулезных микобактерий
