Дифференциально-диагностические биохимические тесты грибов
Идентификация культур грибов рода осуществляется также с помощью биохимических тестов. Чаще всего проводятся исследования по изучению способности грибов к ассимиляции и ферментации углеводов. Эти тесты признаются надежными.
а) Тест ассимиляции углеводов (ауксонограмма). Тест преследует цель определить, какой из углеводов может быть использован культурой гриба в процессе его метаболизма. Набор исследуемых сахаров должен включать обязательно глюкозу, мальтозу и сахарозу, желательно также лактозу, галактозу и раффинозу (или вместо нее — трегалозу).
Суть метода сводится к следующему: приготовленными стерильными (5%-ными растворами) растворами углеводов пропитывают бумажные диски, которые после их подсушивания помещают на поверхность плотной питательной среды сложного состава, включающую источник азота, витамины, а также другие факторы роста, неорганические соли, но не содержащую углеводы, (например, фирмы HiMedia). На поверхность сред предварительно наносится суспензия 24-48 часового тест-штамма гриба, выращенного на среде Сабуро, и равномерно распределяется шпателем по поверхности среды. Чашки инкубируют при 30-37°С в термостате в течение 24-48 час. Об ассимиляции углеводов через 48 часов свидетельствует появление зоны роста тест-культуры вокруг диска, пропитанного соответствующим сахаром. При этом проводят оценку сочетания ассимилируемых сахаров, специфичного для определенного гриба.
В таблице ниже приведены данные о способности грибов, принадлежащих к различным видам рода Candida, ассимилировать углеводы, а также осуществлять их ферментацию.
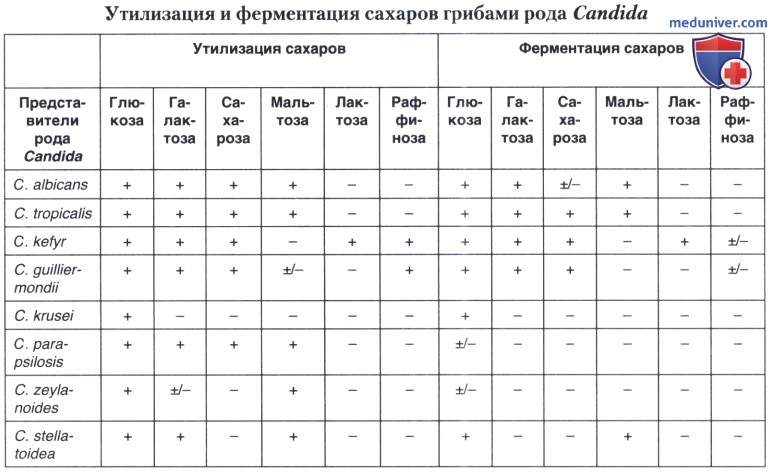
б) Тест ферментации углеводов (зимограмма). С помощью этого теста определяют способность тестируемых грибов рода Candida сбраживать определенные сахара. Обычно изучается ферментирующая способность грибов в отношении следующих 6 сахаров: глюкозы, сахарозы, мальтозы, галактозы, лактозы и раффинозы (или трегалозы). В этом исследовании используется свежая чистая культура тестируемого гриба (24-48-часовая) с агара Сабуро. Испытуемую культуру сеют уколом в полужидкие среды Гисса, содержащие перечисленные углеводы и индикатор. Пробирки с посевами инкубируют в термостате при 30-37°С в течение 24-48 ч. Через 48 часов учитывают результаты.
Ферментация сахаров грибами рода Candida, выявленная с помощью добавленного в среду индикатора Андреде, свидетельствует об образовании тестируемыми культурами кислоты, а образование пузырьков в агаре — о газообразовании.
В продаже имеются автоматизированные системы для определения этих признаков, но все же наилучшей остается система API 20С для ручного метода (bioMerieux). Через 72 часа инкубации при 30°С фиксируют характер использования сахаров и сравнивают его с базой данных. Она дает результат идентификации и сведения о частоте встречаемых изолятов с данными признаками. Эта система признана «Золотым стандартом» ассимиляционных тестов. Для более точной идентификации используют систему API 20С CAUX.
Помимо упомянутых выше тестов рекомендуется использовать и ряд других биохимических методов, с помощью которых удается идентифицировать практически любой из известных дрожжевых грибов. К таким тестам можно отнести тест ассимиляции ими азота и их уреазную активность.
в) Тест ассимиляции азота (нитратный тест). Используют агаровую среду, содержащую нитрат калия KN03, при усвоении которого тест-грибом агар, благодаря индикатору, окрашивается в синий цвет. При отрицательном результате цвет среды — желтый. Среду с нитратом засевают 24-48 часовым ростом чистой культуры гриба, снятой со среды Сабуро, и инкубируют при температуре 25-30оС до 7 суток — срок, ранее которого нельзя фиксировать отрицательный результат. В тесте используют соответствующие контрольные штаммы. В качестве положительного контроля используют штамм Cryptococcus albidus, отрицательного — С. albicans. Результаты этого теста приведены в таблице ниже. Данные, приведенные в таблице, свидетельствуют о том, что почти все грибы рода Candida не способны редуцировать нитрат.
г) Тест на уреазную активность. В качестве среды, на которой изучается этот тест, используют агар Кристенсена с мочевиной. Незасеянная среда имеет желто-оранжевый цвет. Микроорганизмы, использующие мочевину, вызывают подщелачивание этой среды, о чем свидетельствует ее ярко-розовое окрашивание, при отрицательном результате цвет среды не изменяется. На эту среду засевают штаммы исследуемых грибов Candida spp. и инкубируют при 25-30°С. Положительный результат в этом тесте фиксируют через 48-72 часа, но для констатации отрицательного результата необходимо продолжить инкубацию до 7 суток. Результаты, полученные при использовании этого теста, приведены в таблице ниже. Как свидетельствуют эти данные, среди представителей рода Candida уреазной активностью обладают только некоторые штаммы С. krusei.
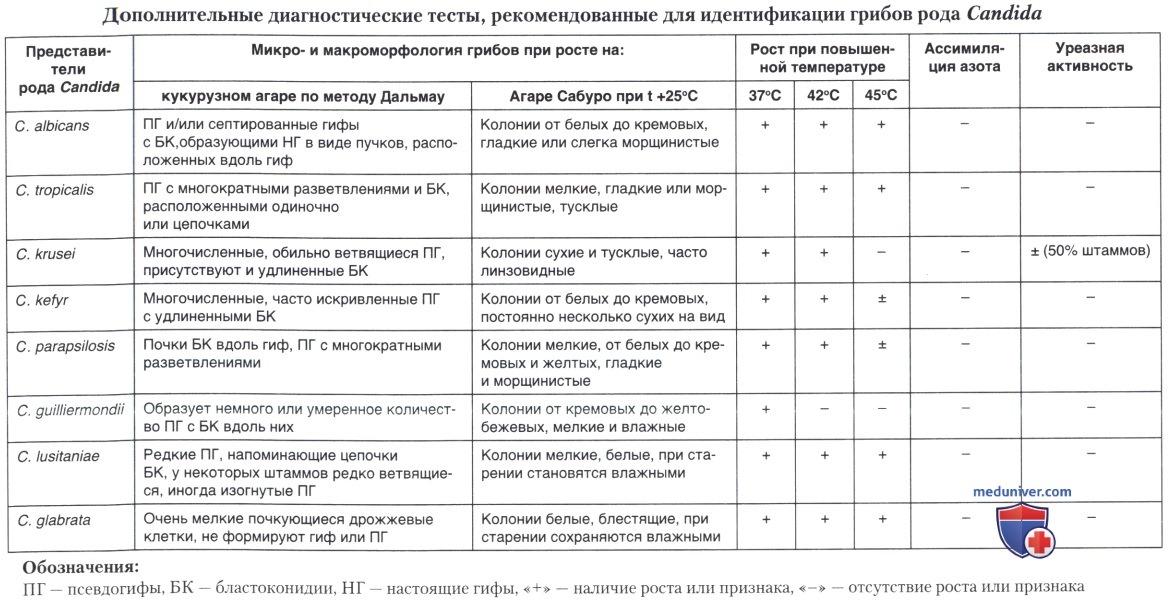
д) Тесты на толерантность к повышенной температуре. Зависимость роста от температуры может быть полезным дифференцирующим признаком, если штаммы выделенных грибов Candida оказались сходны по биохимиическим признакам. 24-часовую культуру гриба засевают в 4 чашки Петри с агаром Сабуро. Одну чашку оставляют при комнатной температуре, а три других помещают в термостаты при температурах 37, 42 и 45°С. Результаты учитывают через 48 ч.
Определение толерантности к повышенной температуре используют с целью идентификации видов Candida и Cryptococcus. В частности, этот метод применяют с целью выявления отличий С. albicans от недавно описанного вида С. dubliniensis. Результаты, полученные при использовании этого метода для идентификации грибов рода Candida, приведены в таблице ниже.
Температура для роста грибов, оказывается, имеет важное значение, влияя на морфогенез некоторых представителей грибов Candida spp. Температура около 25°С используется для образования хламидоспор С. albicans, а при более высоких температурах, которые имеют место у потенциальных хозяев (около 37°С, а иногда и до 43"С), происходит увеличение образования псевдогиф. Не все представители Candida spp. способны расти при 37°С и более высоких температурах, и поэтому такая способность рассматривается как важный фактор патогенности, который имеют потенциально патогенные штаммы из массы окружающих сапрофитов.
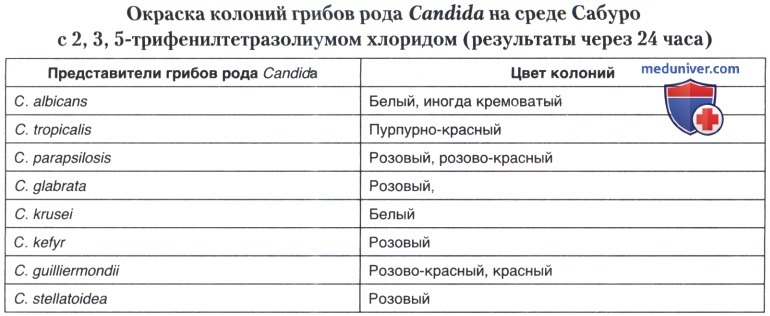
е) Тест на восстановление 2,3,5-трифенилтетразолиума хлорида. Этот тест преследует выявление способности некоторых видов Candida восстанавливать бесцветный 2,3,5-трифенилтетразолиум хлорид, при этом цвет колоний становится красным или розовым. Среда содержит глюкозу и пептон.
Интенсивность окраски колоний после инкубации культур грибов на этой среде при 37"С в течение 24-48 часов может служить одним из дополнительных диагностических признаков. Тест можно проводить только с чистыми культурами, выращенными предварительно на агаре Сабуро.
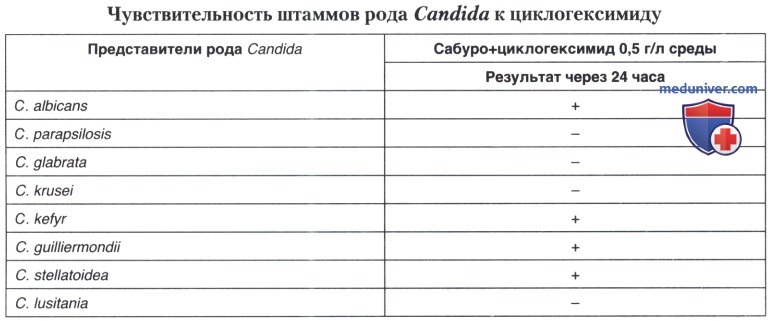
ж) Тест на чувствительность к циклогексимиду. Этот тест основан на способности циклогексимида угнетать рост некоторых грибов рода Candida, таких как С. krusei, С. glabrata, С. lusitaniae, С. parapsilosis. Инокулюм тест-гриба следует нанести штрихом в чашки Петри со средой Сабуро, содержащей циклогексимид (0,5 г/л среды), и инкубировать при 25-30° С. Рост или его отсутствие определяют в течение 72 часов. Этот тест является вспомогательным и введен в состав некоторых коммерческих наборов для идентификации грибов рода Candida (например AUXACOLOR).
- Читать далее "Некультуральные методы идентификации грибов рода Candida"
Редактор: Искандер Милевски. Дата публикации: 8.5.2020
- Патогенез кандидоза и иммунологическая защита
- Клиника инфекций вызванных грибами рода Candida
- Эпидемиология инфекций вызванных грибами рода Candida
- Взятие материала для диагностики инфекций вызванных грибами рода Candida
- Методы идентификации выделенных грибов на микроморфологическом уровне
- Изучение грибов рода Candida на макроскопическом уровне
- Дифференциально-диагностические биохимические тесты грибов
- Некультуральные методы идентификации грибов рода Candida
- Методы быстрого скрининга видов грибов рода Candida
- Иммунологические методы диагностики кандидозов
