Диагностика пневмоцистоза (пневмоцистной инфекции)
Для диагностики пневмоцистоза необходимо использовать комплекс лабораторных методов исследования, включающий паразитологический и иммунологические тесты.
а) Правила сбора клинического (секционного) материала для паразитологического и иммунологических исследований. Несмотря на то, что Р. carinii/jiroveci относится к III группе патогенности, работу проводят с соблюдением противоэпидемического режима, согласно СП 1. 3. 1285-03 «Безопасность работы с микроорганизмами I—II групп патогенности (опасности)». Для патологоанатомического исследования в течение первых суток после гибели больного производят взятие фрагментов легочной ткани, включающей альвеолы, в стерильные одноразовые флаконы стерильными инструментами. Из полученных материалов приготавливают мазки-отпечатки легкого или мазки из пенистого содержимого альвеол.
При жизни легочную ткань получают при проведении трансбронхиальной биопсии при фибробронхоскопии, что позволяет выявить пневмоцисты в 66-98 %, однако, этот метод взятия материала показан далеко не всем больным. Другой способ получения материала возможен при открытой биопсии легкого или с помощью чрескожной интраторакальной аспирации легочной иглой у больных, которым противопоказано проведение трансбронхиальной биопсии при прогрессирующим течении заболевания. Метод открытой биопсии легкого дает наилучшие (100%) результаты и приравнивается по результату к хирургическому вмешательству, при этом получается достаточно большой объем материала для исследования и ложноотрицательный результат полностью исключается.
В клиниках исследуют бронхоальвеолярный лаваж (БАЛ) для выявления цист и трофозоитов. С помощью фибробронхоскопа заклинивают один из дистальных бронхов и вводят в него порциями по 20 мл физиологического раствора, общее количество которого составляет 100-200 мл, и отсасывают его. Специалисты считают этот метод простым и безопасным.
Более простым методом получения материала для выделения пневмоцист является взятие индуцированной мокроты. Через ультразвуковой распылитель делается ингаляция 3 %-ным раствором хлорида натрия и собирается мокрота в стерильную чашку. Если мокрота легко отделяется, ее надо собирать несколько раз в течение суток в одну посуду, сохраняя до исследования при t +4°С.
Для получения материала от детей раннего возраста можно использовать прямую ларингоскопию без медикаментозной подготовки или метод воспроизведения кашлевого рефлекса путем надавливания на корень языка. Слизь при этом забирается тампоном.
Для иммунологического исследования сыворотки кровь берут из вены. Кровь центрифугируют при 1500 об/мин 10 мин и отсасывают сыворотку, которую можно сохранять при температуре 4-6°С в течение недели или в замороженном состоянии (при — 20°С) достаточно долго. Исследуют антитела в НРИФ и ИФА.
Все перечисленные материалы исследуют как паразитологическими методами (окраска и микроскопия) с целью выявления всех форм иневмоцист, так иммунологическими на наличие антигенов Pneumocystis jiroveci. Микологический метод основан на прямом морфологическом выявлении пневмоцист в биолог ическом материале.
б) Метод приготовления мазков. Некоторые виды материала подвергают специальной обработке.
Лаважную жидкость центрифугируют при 1,5 тыс. об/мин, разводя фосфатным буфером до нужной концентрации (исходя из предполагаемого количества клеток) и готовят мазки.
Мокроту для разжижения обрабатывают муколитическим раствором спутолизина (дитиотреитол), нейтрализуют фосфатным буфером, инкубируя при 37°С 3 минуты. Все материалы (мокрота, слизь биоптат) центрифугируют при 1,5 тыс. об/мин и из осадка готовят мазки.
Для окраски препаратов с целью выявления Р. jiroveci используют классические паразитологические методы: импрегнация метенамин-серебряным нитратом по Гомори, окраска 1%-ым водным раствором толуидинового синего, гематоксилином и 0,1%-ым эозином, по Граму и реактивом Шиффа, а также методом Романовского-Гимзы.
Диагноз «ннсвмоцистоз» основывается на выявлении паразитов, характерных размеров и формы (цисты, прецисты и трофозоиты) или по характерной эозинофильной пене (окраска гематоксилином и эозином), внутри которой лежат цисты.
При серебрении по Гомори полисахариды стенки цисты окрашиваются скоплением осадка серебра и создается впечатление, что стенка нарисована черной тушью, трофозоиты при этом не окрашиваются.
Толуидиновый синий также окрашивает стенку цисты, но в пурпурно-фиолетовый цвет. Окраске кристалл фиолетовым и реактивом Шиффа подвержены как цисты, так и трофозоиты.
Наиболее универсальным недорогим и быстрым для выявления цист, трофозоитов и спорозоитов является метод Романовского-Гимзы. Характерным и диагностическим является обнаружение при большом увеличении (х400) розовых цист, оболочка которых при работе микровинтом микроскопа имеет вид прозрачного кольца, а внутри лежат от 4 до 8 красно-фиолетовых включений. Наличие большого количества трофозоитов говорит об активации инфекционного процесса.
Выполнение перечисленных методов окраски требует высокой квалификации исследователя для точной идентификации Pneumocystisjiroveci; к тому же эти методы служат лишь для индикации и направлены на выявление на общих грибных полисахаридов оболочки цист.
в) Молекулярная диагностика пневмоцистоза. Американским исследователям (Т. К. Jensen et al., 2001) удалось применить гибридизацию in situ в целях выявления Р. carinii в легких крыс и человека с использованием биотинилированных олигонуклеотидных зондов, нацеленных на рибосомальную РНК, а также в легких человека и хорьков путем флуоресцентной гибридизации in situ, нацеленной на специфические малые подгруппы генов рРНК.
В ряде работ показано определение пневмоцист методом ПЦР путем амплификации ДНК паразита с праймерами, специфичными для митохондриальной рРНК, в серии конечных разведений исследуемых материалов. Исследуемые образцы подвергали перевариванию протеинкиназой К в течение 2 часов при 56°С, экстрагировали фенол-хлороформом, разбавляли и амплифицировали с pAZ102E и Н. Затем проводили электрофорез продуктов ПЦР в 2 %-ном агарозном геле и окрашивали этидиум-бромидом. ДНК экстрагировали из исследуемого материала, серийно разбавляли до разведения 1:20 000. Хотя этот метод не стандартизирован, его результаты хорошо согласовывались с результатами, полученными другими методами.
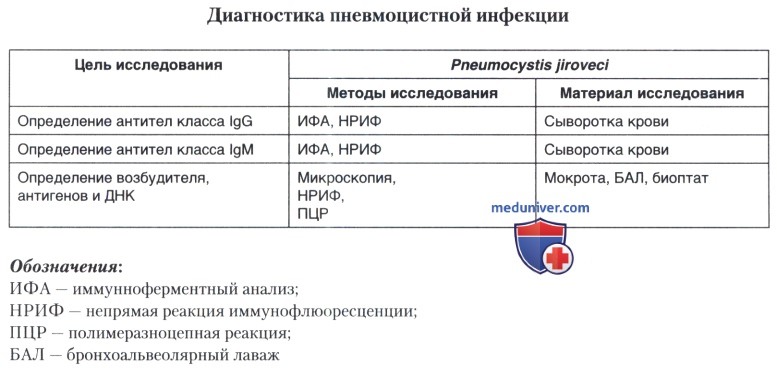
г) Иммунологическая диагностика пневмоцистоза. Для своевременной и точной диагностики пневмоцистоза необходимо применение комплексной лабораторной диагностики, включающей иммунологические тесты. В настоящее время в России лицензированы два набора реагентов для диагностики пневмоцистоза, выпускаемые фирмой «Медгамал» (наборы реагентов разрешены к применению приказом Федеральной службой по надзору в сфере здравоохранения и социального развития в 2009 году). Эти наборы позволяют выявлять:
• методом ИФА антитела класса IgG и IgM к Pneumocystis jiroveci в сыворотке крови больного:
• методом НРИФ в мазках, приготовленных из мокроты, бронхоальвеолярного лаважа, все формы пневмоцист.
Зарубежные фирмы, выпускающие аналогичные тест-системы — «Медак» (Германия) и «Биорад» (Франция).
- Читать далее "Профилактика пневмоцистоза (пневмоцистной инфекции)"
Редактор: Искандер Милевски. Дата публикации: 15.5.2020
- Возбудитель пневмоцистоза (Pneumocystis carinii (jiroveci hominis)): таксономия, морфология
- Факторы предрасполагающие к развитию пневмоцистоза
- Клиническая картина пневмоцистоза
- Особенности иммунного ответа при пневмоцистозе
- Особенности эпидемиологии пневмоцистоза
- Диагностика пневмоцистоза (пневмоцистной инфекции)
- Профилактика пневмоцистоза (пневмоцистной инфекции)
- Лечение пневмоцистоза (пневмоцистной инфекции)
