Фенотипические маркеры вирулентности энтеробактерий (Enterobacteriaceae)
В настоящее время повсеместно наблюдается активизация условно-патогенных бактерий, для которых характерно отсутствие нозологической специфичности и локализации инфекционного процесса. Условно-патогенные энтеробактерии семейства Enterobacteriaceae являются одними из основных представителей этой группы микроорганизмов, способных вызвать менингит, энцефалит, множественный неврит, пиелит, пиелонефрит, цистит, холецистит, перитонит, аппендицит, панкреатит, пневмонию, назофарингит, отит, конъюнктивит, офтальмит, токсико-септицемические осложнения, которые характеризуются полиморфизмом клинических проявлений, связанным не столько с эпидемической ситуацией, сколько с возрастом и состоянием защитных сил организма пациента.
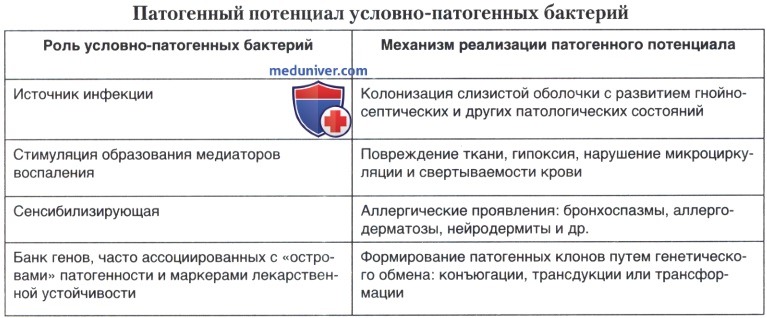
Известно, что выделение условно-патогенных энтеробактерий (УПЭ) из кишечника, респираторного или урогенитального трактов не является бесспорным доказательством их этиологической роли, т. к. они могут обнаруживаться у здоровых лиц и при дисбиотическом состоянии того или иного биотопа открытых полостей организма. В лабораториях этиологическую значимость выделенных УПЭ принято определять преимущественно с учетом источника их выделения и концентрации в материале. Однако количественный критерий не всегда определяет способность изолята вызывать заболевание, которое в большей степени связано с уровнем патогенного потенциала возбудителя, представленного в таблице ниже.
При обосновании этиологической значимости УПЭ ряд исследователей пользуется следующими критериями: (1) при отсутствии патогенных бактерий этиологическое значение имеют любые бактериальные изоляты из крови, ликвора, плеврального экссудата, закрытых полостей; (2) этиологически значимы выделенные из мочи и трахеобронхиальных смывов УПБ в концентрации 104 КОЕ/мл, из ран в концентрации 103 КОЕ/мл, из мокроты и фекалий в концентрации 105 КОЕ/мл и более; (3) важное значение имеет наличие факторов патогенности у изолятов; (4) определенную роль играет нарастание титра антител в динамике при серологическом исследовании парных сывороток крови в реакции агглютинации с изолятом; (5) имеет значение выделение УПБ в первые дни заболевания до начала этиотропной терапии и исчезновение их в период реконвалесценции.
Фенотипические маркеры вирулентности. Каждому виду энтеробактерий свойствен свой комплекс факторов или признаков (маркеров) патогенности, благодаря которым осуществляется развитие инфекционного процесса. Способность энтеробактерий к адгезии обусловлена наличием различного типа пилей (фимбрий) и нефимбриальных структур, в том числе и компонентами полисахаридной капсулы, поверхностными белками наружной мембраны и липополисахаридами клеточной стенки. Наличие фимбрий часто коррелирует с гемагглютинируютцей способностью энтеробактерий. Бактерии семейства Enterobacteriaceae могут обладать 4-мя различными типами фимбрий или пилей, ассоциированных с адгезивной активностью бактериальных клеток, среди которых наиболее распространены фимбрии I типа — их белковые молекулы опознают D-маннозу и связываются с ней в рецепторе. При этом добавление в реакционную смесь D-маннозы подавляет реакцию гемагглютинации. В тех случаях, когда D-манноза не влияет на проявление агглютинации эритроцитов, говорят о маннозорезистентном (MR) типе реакции гемагглютинации, в случае подавления реакции гемагглютинации — о маннозочувствительном (MS) типе этой реакции.
Фимбрии I типа вызывают реакцию гемагглютинации свежих эритроцитов различных видов животных и человека 1(0) группы крови. Связь определенного типа фимбрий, выявляемых у энтеробактерий, с положительной реакцией гемагглютинации, подтверждена данными электронной микроскопии. Помимо фимбрий I типа, существуют фимбрии типа MR/K (Klebsiella-like), MR/E (Escherichia-like), MR/P (Proteus-like) и др.
Определенную роль в развитии инфекционного процесса играют ферменты патогенности, которые могут способствовать как инвазии, так и защите возбудителя от действия клеточных и гуморальных систем иммунитета организма хозяина. Условно-патогенные энтеробактерии могут синтезировать ДНК-азу, РНК-азу, лецитиназу, щелочную фосфатазу, нейраминидазу, каталазу и различного типа протеазы. Выявление у клинических изолятов протеолитических свойств, включая казеинолитическую и желатиназную активность, также может служить фенотипическим маркером вирулентности условно-патогенных энтеробактерий. Высокий уровень протеолитической активности встречается у представителей дисбиотической микрофлоры кишечника — бактерий родов Proteus, Klebsiella, Enterobacter, Serratia, Staphylococcus, Pseudomonas, грибов рода Candida.
Протеолитические ферменты микробного происхождения стимулируют высвобождение целого ряда медиаторов воспаления, ведущих к активации биохимических систем и утяжелению инфекционного процесса.
Бактериальные IgA-протеазы, деградирующие иммуноглобулины A (IgA), обнаружены у Klebsiella pneumoniae, Proteus mirabilis, Proteus vulgaris, Citrobacter freundii, Escherichia coli и др. Наиболее часто IgA-протеаза обнаруживается у уропатогенных штаммов Proteus mirabilis и К. pneumoniae. Показано, что гены, детерминирующие sIgA-протеазу (sIgA — secreted IgA) клебсиелл инактивирующую секреторный иммуноглобулин А, находятся на конъюгативной плазмиде, способной к наследованию и передаче широкому кругу хозяев семейства кишечных.
Важное значение имеет РНК-азная активность возбудителей. Это обусловлено тем, что РНК является ключевым звеном в реализации генетической информации. Ее биологическое значение заключается в том, что она обеспечивает синтез различных белков, необходимых для функции эукариотических клеток. Кроме того, РНК принимает участие в формировании иммунного ответа макроорганизма как переносчик антигенной информации, так и в качестве неспецифического стимулятора антителообразующих и фагоцитирующих клеток. РНК стимулирует продукцию лизоцима и интерферона. Бактериальные РНК-азы, участвующие в деградации РНК, могут вести к резкому снижению содержания РНК в клеточных структурах организма хозяина, влияя на общую устойчивость последнего к развитию гнойно-воспалительных процессов. Определенную роль играют бактериальные ДНК-азы, обладающие генотоксичными свойствами. Бактериальные ДНК-азы, расщепляя связи в цепи нуклеиновых кислот, вызывают деструктивные изменения ядер лейкоцитов, в определенной степени нейтрализуя защитные силы организма. Бактериальные фосфатазы, участвуя в обмене углеводов, нуклеотидов и фосфолипидов, способны повреждать мембраны эукариотических клеток.
Для развития острого инфекционного процесса важными являются адгезивные свойства, способность к биопленкообразованию, энтеротоксигенность и синтез ряда секретируемых факторов патогенности.
1. Тест на биопленкообразование. Биопленка — это микробное сообщество, в котором прикрепленные к поверхности и друг к другу клетки, заключены в матрицу внеклеточных полимерных субстанций, продуцируемых в соответствии с уровнем развития популяции и условия транскрипции генов. Формирование биоплёнки способствует паразитированию в организме и выживанию бактерий в окружающей среде. Установлено, что формирование биопленок связано с хронизацией инфекционного процесса, и способность к биопленкообразованию расценивается в качестве фенотипического маркера вирулентности потенциального возбудителя. Формирование изолятами биопленки проводят по модифицированному методу G. A. O’Toole et al. (2000). Для этого в полистироловые чашки диаметром 35 мм вносят по 5 мл жидкой питательной среды для роста бактериальных клеток, затем добавляют 0,1 мл суточной бульонной культуры, культивируют при 37°С в течение 24 ч. Затем питательную среду аккуратно отсасывают, и прикрепленные к стенкам и дну полистироловой чашки биопленки, окрашивают 0,1%-ным спиртовым раствором кристаллви-олета. Регистрируют наличие выраженной биопленки, видимой по интенсивному фиолетовому окрашиванию стенок и дна чашки, свидетельствующему о способности изолята к биопленкообразованию.
Для количественной оценки способности бактерий к формированию биопленок суточные культуры тестируемых штаммов разводят свежей питательной средой в пропорции 1:100. Полученные суспензии стерильно вносят в плоскодонные пластиковые планшеты для иммуноферментного анализа по 150 мкл в лунку. Для контроля фона также в четыре лунки вносят по 150 мкл жидкой питательной среды. Планшеты инкубируют при 30°С во влажной камере в течение 24 и 48 ч. Оптическую плотность выросших за сутки планктонных клеток определяют на спектрофотометре при длине волны 540 нм. Затем содержимое лунок осторожно удаляют, вносят по 150 мкл 0,1 %-го спиртового раствора кристаллвиолета и инкубируют при комнатной температуре в течение 45 мин. Не адсорбировавшийся краситель аккуратно отбирают и лунки промывают дистиллированной водой. В лунки, отмытые от несвязавшейся краски, вносят по 250 мкл этилового спирта и оставляют на 45 мин при комнатной температуре для экстракции связанного с клетками красителя. Интенсивность окрашивания спирта в лунках оценивают на фотометре при 540 нм. Результаты подсчета обрабатывают по программе «Excel».
2. Определение адгезивных свойств. Практически все клинически значимые штаммы УПЭ обладают таким фенотипическим признаком патогенности, как адгезия. Степень адгезии микроорганизмов определяют, пользуясь средним показателем адгезии (СПА) по методу В. И. Брилиса (1986) на эритроцитах человека О (I) группы Rh+, а также на перевиваемых эпителиоидных клеточных линиях типа Нер-2. При постановке опыта на предметное стекло наносят одну каплю буферного раствора (0,1 М раствор фосфата натрия на изотоническом растворе хлорида натрия, pH 7,2-7,3), в котором суспендировали по одной петле взвесь эритроцитов, предварительно дважды отмытых буферным раствором путем центрифугирования (300-1000 об/мин), концентрацией 100 млн/мл, и одну петлю густой суточной суспензии культуры микроорганизмов (№ 6 по McFarland), выращенных в оптимальной жидкой питательной среде. На одно стекло наносят 3 капли суспензии разных микроорганизмов. Предметное стекло с эритроцитами и микробами помещают во влажную камеру на 30 минут при температуре 37°С.
Затем препарат высушивают при той же температуре, фиксируют в пламени спиртовки и окрашивают по методу Романовского-Гимзы. При микроскопии подсчитывают среднее количество бактерий, прикрепившихся к одному эритроциту, это средний показатель адгезии (СПА). Подсчитывают не менее 25 эритроцитов, учитывая не более 5 эритроцитов в одном поле зрения. Адгезивность считается нулевой при СПА от 0 до 1,0; низкой при СПА от 1,01 до 2,0; средней при СПА от 2,01 до 4,0; высокой при СПА свыше 4,0. Вариации результатов при данном методе ±15%.
Способность микроорганизмов к адгезии на эпителиоидных клетках исследуют по аналогичной методике, окрашивая азур-эозином. Изучение адгезивных свойств с помощью реакции гемагглютинации или адсорбции на эритроцитах, окрашиваемых по методу Романовского-Гимзы, так же как исследование на эпителиоидных клетках, окрашенных азур-эозином, с последующей микроскопией и учетом степени сорбции, доступно для практических лабораторий.
3. Энтеротоксигенность. При острой кишечной инфекции ведущим и общим для всех видов УПЭ являются продукция термолабильного и/или термостабильного энтеротоксинов, от типа которых зависит выраженность диарейного синдрома. Энтеротоксины можно выявить с помощью доступных для практических лабораторий диагностических иммуноферментных тест-систем для определения термолабильного и термостабильного энтеротоксинов или постановкой ПЦР с праймерами, амплифицирующими фрагменты соответствующих генов. Обнаружение энтеротоксинов дает основание считать эти бактерии этиологическими агентами банальной кишечной инфекции. При отсутствии энтеротоксинов или невозможности их определения в лаборатории проводят тестирование других признаков патогенности.
4. Цитотоксичность. Цитотоксичность бактерий определяют путем внесения стерильных ультразвуковых фильтратов тестируемых штаммов в объеме 0,2 мл в пробирку с 2-суточной культурой клеток НЕр-2 и инкубации в термостате при 37°С в течение 2-5 суток. Степень выраженности цитопатического действия учитывают по изменению характера монослоя в виде отслоения клеток, изменения их морфологии, наличию деструкции.
5. Гемолитическая активность. Продукцию гемолизинов определяют на кровяном агаре, засевая суточные агаровые культуры «бляшками». Учет ведут после инкубации посевов при 37°С в течение суток и последующего выдерживания при 4°С в течение 16-18 часов. Для приготовления агара ex tempore смешивают равные части дефибринированной крови кролика или человека всех известных 4-х групп (Rh-) и, тщательно перемешав, вносят в количестве 5 % в расплавленный и охлажденный до 50°С питательный агар (см. Кн. II, гл. 32.2.1.4., с. 1025). Степень гемолитической активности оценивают по величине зоны гемоонг вокруг «бляшки»: высокоактивные — зона гемолиза более 8 мм, умеренно активные — от 5 до 7 мм, активные — до 5 мм, слабоактивные — зона гемолиза под «бляшкой» и отрицательные — отсутствие гемолиза.
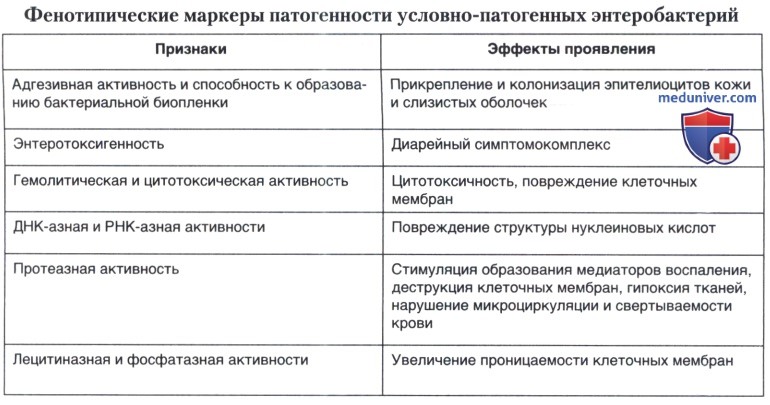
6. ДНК-азная и РНК-азная активности. Наличие ферментов выявляют на среде с ДНК и РНК соответственно. Методика основана на деполимеризации субстратов ДНК или РНК, содержащихся в среде под действием соответствующих ферментов. При положительном результате вокруг колоний или «бляшек» образуется зона просветления (см. Кн. II, гл. 32.2, с. 1034). Суточные агаровые культуры засевают «бляшками» диаметром 5 мм, помещая до 16-20 штаммов на чашку и инкубируют 24 ч. Степень активности определяют по величине зоны просветления. Для повышения четкости реакции рекомендуется обработать поверхность среды 5-7 мл 10 %-ной НС1 и через 10-15 мин отсосать пипеткой. Высокоактивные штаммы дают зону просветления более 5 мм, умеренно активные — 1-5 мм, слабоактивные — просветление только под «бляшкой».
7. Определение фосфатазной активности. Для определения фермента щелочной фосфатазы используется специальная среда, содержащая в качестве субстрата натриевую соль дифосфата фенолфталеина в количестве 0,05 г в 3,0 мл воды на 100 мл среды. Среда полупрозрачная, молочно-белого цвета. Суточные агаровые культуры засевают «бляшками» и инкубируют при 37°С 16-18 ч. После этого на внутреннюю поверхность крышки чашки Петри помещают диск фильтровальной бумаги, пропитанный 10-15%-ным водным раствором аммиака, и вставляют в них чашки с посевами. Образуемый продукт расщепления под действием паров аммиака приобретает ярко-малиновое окрашивание. Результат учитывают через 10-15 минут по 4-х крестовой системе: 4+ — ярко-малиновое окрашивание всей поверхности «бляшки» и зоны вокруг нее, 3+ — малиновое окрашивание всей поверхности «бляшки», 2+ — малиновое окрашивание 2/3 поверхности «бляшки», 1+ — бледно-розовое окрашивание «бляшки» или ее центра. За положительный результат принимают интенсивность теста не менее чем на 2 креста.
8. Протеазная активность. С целью определения протеазной (энтерокиназной) активности изучают желатиназную активность и способность гидролизовать казеин. В первом случае используют 10-15 %-ный желатин-агар, приготовленный на питательном бульоне в пробирке. Можно определять желатиназную активность с помощью полосок засвеченной и проявленной фотопленки. Высокоактивные штаммы дают зону просветления более 5 мм, умеренно активные -1-5 мм, слабоактивные — просветление только под нанесенной «бляшкой».
9. Казеинолитическая активность. Наличие казеиназы исследуют на агаризованой среде, содержащей растворимый казеин. Приготовление: 2 %-ный раствор казеина на 0,1 N фосфатном буфере (в г на 1 л: Na., НРО4-19,4; КН2РO4 - 5,9; NaCl — 8,5; казеин — 2,0; pH — 7,2). Готовят отдельно 2 %-ный раствор казеина на фосфатном буфере и 3%-ный агар на аналогичном буфере. Предварительно кипятят на водяной бане (казеин 20 мин, агар — 30 мин), сливают равными объемами и разливают по чашкам Петри (20 мл на чашку). После застывания агара на его поверхность «бляшками» засевают исследуемые бактерии и помещают в термостат на 37°С на 18 ч. Затем визуально регистрируют зоны протеолиза. Для более наглядного проявления зон можно залить чашку слоем 0,1N HCl. Высокоактивные штаммы дают зону просветления среды более 25 мм, умеренно активные — 10-15 мм, слабоактивные — менее 5 мм.
10. Лецитиназная активность. Определение лецитиназы изучают, как правило, у клинических штаммов клебсиелл, энтеробактеров, протеев, морганелл, гафний и серраций. Для этого используют лецитин-агар. Высокоактивные штаммы дают зону просветления среды более 5 мм, умеренно активные — 1—5 мм, слабоактивные — просветление только под «бляшкой».
Для каждого вида (штамма) возбудителя бактериальной оппортунистической инфекции может быть свой набор фенотипических признаков, или маркеров, вирулентности, благодаря которым осуществляется развитие инфекционного процесса. Фенотипические маркеры вирулентности условно-патогенных энтеробактерий представлены в таблице ниже.
Следует отметить, что выявление фенотипических признаков вирулентности in vitro не представляет особой сложности, не требует наличия специальных питательных сред и реактивов и доступно для каждого исследователя-энтузиаста.
- Читать далее "Генотипические маркеры вирулентности энтеробактерий (Enterobacteriaceae)"
Редактор: Искандер Милевски. Дата публикации: 4.4.2020
- Фенотипические маркеры вирулентности энтеробактерий (Enterobacteriaceae)
- Генотипические маркеры вирулентности энтеробактерий (Enterobacteriaceae)
- Род условно-патогенных эшерихий (Escherichia): морфология, культуральные, биохимические свойства
- Род условно-патогенных сальмонелл (Salmonella): морфология, культуральные, биохимические свойства
- Род условно-патогенных клебсиелл (Klebsiella): морфология, культуральные, биохимические свойства
- Род условно-патогенных энтеробактер (Enterobacter): морфология, культуральные, биохимические свойства
- Род условно-патогенных гафний (Hafnia): морфология, культуральные, биохимические свойства
- Род условно-патогенных серраций (Serratia): морфология, культуральные, биохимические свойства
- Род условно-патогенных протей (Proteus): морфология, культуральные, биохимические свойства
- Род условно-патогенных морганелл (Morganella): морфология, культуральные, биохимические свойства
