Генотипические маркеры вирулентности энтеробактерий (Enterobacteriaceae)
Более экономичным и мало затратным является определение генетических маркеров вирулентности с помощью молекулярно-генетических методов, в частности, ПЦР.
В настоящее время с помощью ПЦР, мультилокусного типирования или мультилокусного секвенирования получены данные, свидетельствующие о том, что основой для формирования патогенезированных клонов УПЭ являются родственные бактерии комменсалы. Сформировавшиеся вирулентные клоны могут нести геномные «острова» патогенности (ОП), вклад которых в патогенность возбудителя связан с рядом особенностей этих генетических элементов.
Острова патогенности (ОП) представляют собой кластеры (скопления) структурных и регуляторных генов патогенности, которые у вирулентных штаммов обнаруживаются всегда, у невирулентных — спорадически. Они имеют отличающийся от хромосомы бактерии-хозяина состав пар G+C, представляют собой дискретную генетическую единицу, ограниченную прямыми (DR) нуклеотидными повторами, и ассоциированы с З'-областью локусов тРНК и/или IS-последовательностями. Острова патогенности (ОП), как правило, содержат гены транспозаз и иптеграз, входящие в состав транспозонов, геномов бактериофагов или плазмид. Уникальные особенности ОП определяют их способность к распространению среди одного или родственных видов бактерий путем генетического обмена.
В состав ОП могут входить кластеры генов, детерминирующие ключевые этапы взаимодействия возбудителя с чувствительными клетками организма хозяина, включая адгезию, продукцию токсинов, способность противостоять факторам неспецифической резистентности и размножению в тканях.
У патогенных Е. coli кишечного происхождения могут быть обнаружены следующие гены вирулентности: eaeА (Е. coli attaching and effacing, англ. — эшерихиозный локус прикрепления и сглаживания энтероцитов), iha — синтез рецептора, гомологичного белку гена irgA (iron-regulated gene А, англ., железо-регулируемый белок), saa (surface aggregative antigen, англ., поверхностный агрегирующий антиген), stx1 (shiga-like toxin-1-шигаподобный токсин-l), stx2 (shiga-like toxin-2, англ.,— шигаподобный токсин-2), cdt (cytolethal distending toxin-цитолеталъный растягивающий токсин, известный также как цитолеталъный токсин гигантских клеток), subA (subtilase, англ., субтилаза или цитотоксическая протеаза), ehx (enterohemolysin — энтерогемолизин), esp (Е. coli serine protease, англ., - эшерихиозная сериновая протеаза).
Штаммы Е. coli внекишечного происхождения могут обладать такими генами вирулентности, как afaE8 (afimbrial adhesion, англ., — афимбриальный адгезии); astA (aggregative heat-stable toxin, англ., — агрегативный термостабильный токсин); clpG (К-88-иодобный адгезии); hlyF (haemolysin - гемолизин F); hra (heatresistant aggiutinin, англ., — терморезистентный агглютинин); kfiC и kpsM (капсульные антигены К5 и К15 соответственно); usp (uropathogen-specific protein, англ., — уропатоген-специфический протеин); различные сериновые протеазы: pic (protein involved in intestinal colonization, англ., — протеин, участвующий в колонизации кишечника); tsh (temperature-sensitive haemagglutinin, англ., — температурочувствительный гемагглютинин); vat (vacuolating autotransporter, англ., — вакуолирующий аутотранспортер).
Большинство генов вирулентности патогенных Е. coli входят в состав геномных «островов» патогенности. Для септицемических и уропатогенных штаммов Е. coli показана эпидемическая и филогенетическая связь между наличием геномного острова патогенности pks (pks — polyketid synthetase, англ - поликитидная синтетаза), размером 54 kb (54 тыс.п.н.), состоящего из 20 открытых рамок считывания, 8 из которых контролируют синтез поликитидной синтетазы, нерибосомную пептидную синтетазу и гибридный пептидополикегид колибактин (англ, colibactin, Cbl), рассматриваемый как цикломодулин — генотоксин, блокирующий клеточный цикл эукариотической клетки. Ранее было известно, что нерибосомные пептидные гибриды у кишечной группы бактерий могут относиться к энтеробактину аэробактину и иерсиниобактину — хелаторам ионов железа.
В отличие от последних, колибактин обладает циотоксическим действием. Гены clbB и clbN являются основными, а гены clbA и clbQ, ограничивающие открытые рамки считывания, служат дополнительными маркерами острова патогенности cbl. Геном септицемических штаммов E.coli помимо острова патогенности cbl, может содержать гены hra (heat-resistent agglutinin) и vat (vacuolating tonin). Особый интерес представляют патогенные кишечные палочки филогенетической группы В2, геном которых содержит детерминанты cbl, а также гены hra и vat, ассоциированные с бактериемией.
В геноме Escherichia fergusonii, изолированных в 2003-2004 гг при кишечных и внекишечных инфекционных процессах, в 43% случаев были выявлены такие гены вирулентности, как iss (increased serum survival, англ. — увеличение срока выживания в сыворотке), prfB (P-regulated fimbriae, англ, — P-регулируемые фимбрии, кодируемые генами pap (pyelonephritis-associated pili) и в 10% — ireA (siderophore receptor IreA). С помощью ПЦР и сиквенс-анализа генов prfB, iss и ireA Е. fergusonii показана высокая степень их гомологии с последовательностями генов острова патогенности Е. coli O1, поражающих птиц.
Показана циркуляция штаммов Escherichia coli, продуцирующих шига-токсин (STEC), лишенных локуса сглаживания энтероцитов (LEE — locus of enterocyte effacement, англ.), вызывающих развитие различных клинических форм кишечной инфекции с явлениями геморрагического колита и гемолитико-уремического синдрома. У таких штаммов выявляется ОП, обозначенный как PAI 1 (CL3), ранее описанный у LEE-негативного штамма STEC O113: Н21 (CL3). PAI 1 (CL3) является уникальным маркером вирулентности и обнаруживается в геноме Citrobacter rodentium, патогенных для грызунов.
Отечественными микробиологами с помощью ПЦР у клинических штаммов Е. coli, К. pneumoniae, Enterobacter cloacae, Serratia marcescens, Citrobacter freundii и Proteus vulgaris, выделенных при респираторных, урологических септицемических и менингеальных гнойно-воспалительных процессах, обнаружены нуклеотидные последовательности ОП, содержащих гены, контролирующие синтез фимбрий (sfaG, рарС), гемолизинов (hlyА, hlyВ), цитотоксического некротизирующего фактора (cnf-1) и гена железорегулируемого белка (irp-2), входящего в состав острова высокой патогенности HPI (high pathogenicity island, англ.), типичного для патогенных иерсиний. Эти данные свидетельствует о широком генетическом обмене ОП между различными видами энтеробактерий в окружающей среде.
Праймеры, рекомендуемые для обнаружения генетических маркеров вирулентности энтеробактерий, представлены в таблице ниже.
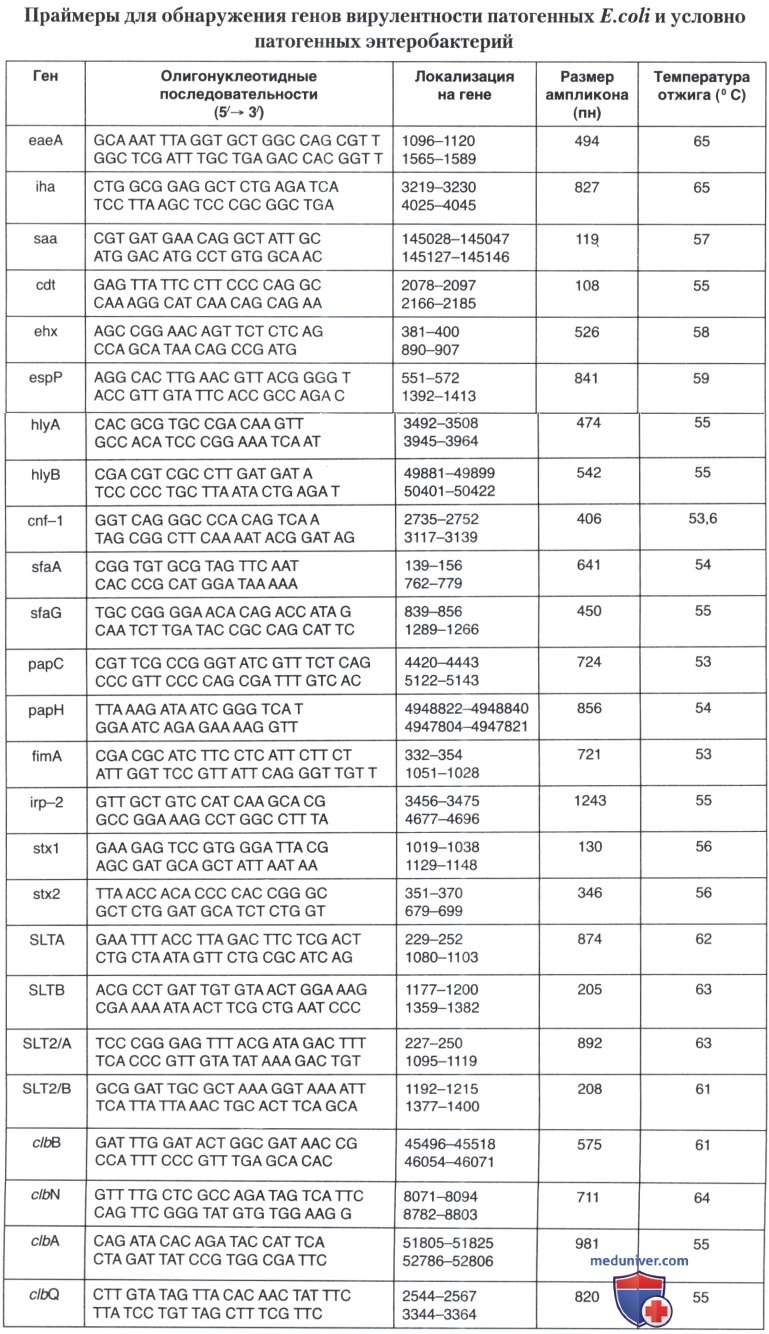
Эти исследования позволили установить факт наличия у изученных клинических штаммов условно-патогенных энтеробактерий фрагментов ДНК, гомологичных известным генам «островов» патогенности Е. coli. Обнаружен штамм уропатогенных кишечных палочек (UPEC), содержащий тринадцать «островов» патогенности размерами от 32 kb до 123 kb. Одиннадцать «островов» патогенности были в составе хромосомы. При характеристике урологических штаммов, выделенных при катетер-ассоциированной инфекции, идентифицирован «остров» патогенности, обозначенный как ICEPml, общий для изолятов Proteus mirabilis, Providencia stuartii и Morganella morganii. Остров патогенности ICEPml кодирует факторы вирулентности, важные для колонизации мочевыводящего тракта, в том числе, гены ptg (Proteus toxic agglutinin, англ. — протейный токсический агглютинин) и детерминанты острова высокой патогенности (HPI).
В Голландии у пандемических штаммов Enterobacter hormaechei (EHOS) были выявлены генетические маркеры вирулентности, включенные в состав двух разных плазмид вирулентности, обозначенных как pQC и pLVPK. Плазмида pQC обладала генами пили-ассоциированного протеина, белков-траспортеров и устойчивости к тяжелым металлам. Плазмида pLVPK содержала в геноме фрагменты ДНК, ответственные за синтез пилей, гомологичных таковым у Salmonella enterica. У части штаммов EHOS дополнительно обнаружены хромосомные детерминанты HPI (high pathogenicity island, англ, — остров высокой патогенности). Наличие у E.hormaechei (EHOS) генетических маркеров вирулентности и устойчивости к тяжелым металлам явилось основой, обусловившей широкое эпидемическое распространение возбудителя в госпиталях.
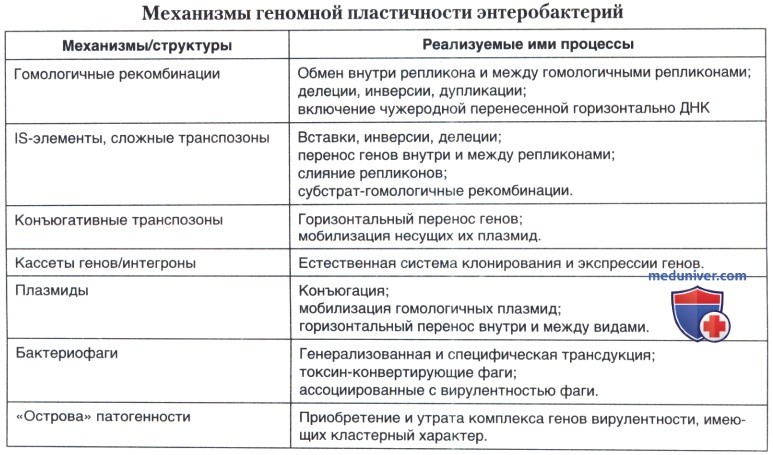
Анализ данных исследователей различных стран позволяет заключить, что механизм увеличения патогенности у условно-патогенных энтеробактерий тесным образом связан с наследованием ОП: (1) поскольку гены тРНК и IS-элементы универсальны, то теоретически они определяют возможность передачи генов патогенности не только между штаммами одного вида, но и между штаммами различных видов; (2) кластерный характер генов «островов патогенности» обеспечивает передачу не только структурных генов, но и генов-регуляторов, что предполагает генетическую возможность экспрессии признака; (3) существование универсальных механизмов транспорта биомолекул и его регуляции у бактерий делает теоретически возможной экспрессию бактериями одного вида генов, полученных от бактерий другого вида. Механизмы геномной пластичности условно-патогенных энтеробактерий представлены в таблице ниже.
Таким образом, в основе изменения патогенности условно-патогенных энтеробактерий лежит структурная модификация ДНК бактерий-комменсалов, связанная с миграцией мобильных генетических детерминант, входящих в состав транспозонов, геномов бактериофагов и плазмид. Ассоциация мобильных генов вирулентности с «островами» патогенности и особенности их структурной организации определяют высокую вероятность экспрессии наследуемых генов при межвидовом и межродовом генетическом обмене. В связи с этим обнаружение детерминант «островов» патогенности с помощью ПЦР может свидетельствовать об этиопатогенетической значимости клинического изолята.
- Читать далее "Род условно-патогенных эшерихий (Escherichia): морфология, культуральные, биохимические свойства"
Редактор: Искандер Милевски. Дата публикации: 4.4.2020
- Фенотипические маркеры вирулентности энтеробактерий (Enterobacteriaceae)
- Генотипические маркеры вирулентности энтеробактерий (Enterobacteriaceae)
- Род условно-патогенных эшерихий (Escherichia): морфология, культуральные, биохимические свойства
- Род условно-патогенных сальмонелл (Salmonella): морфология, культуральные, биохимические свойства
- Род условно-патогенных клебсиелл (Klebsiella): морфология, культуральные, биохимические свойства
- Род условно-патогенных энтеробактер (Enterobacter): морфология, культуральные, биохимические свойства
- Род условно-патогенных гафний (Hafnia): морфология, культуральные, биохимические свойства
- Род условно-патогенных серраций (Serratia): морфология, культуральные, биохимические свойства
- Род условно-патогенных протей (Proteus): морфология, культуральные, биохимические свойства
- Род условно-патогенных морганелл (Morganella): морфология, культуральные, биохимические свойства
