Гуморальный иммунный ответ
При этой форме иммунного ответа происходит выработка антител (иммуноглобулинов) к чужеродному антигену. Они циркулируют в жидкостях организма (отсюда название: лат. humor — жидкость) и обеспечивают нейтрализацию антигена.
На поверхности В-лимфоцитов находится иммуноглобулиновый рецептор (sIgM; от англ. — superficial Ig). Именно он распознает, захватывает и переносит антиген внутрь клетки. Происходит внутриклеточное расщепление антигена с образованием пептидов. Они в комплексе с молекулами II класса МНС выносятся на поверхность В-клетки, обеспечивая процессинг антигена и представляя его в иммуногенной форме. Развитие дальнейших событий зависит от характера антигена.
Тимусзависимые антигены (TD-thymus; от англ. — depending antigens) для выработки антител нуждаются в помощи Т-хелперных лимфоцитов.
Комплекс антигенный пептид — молекула МНС II класса распознается и связывается с Т-хелпером (Tn2) при помощи Т-клеточного рецептора (ТКР) и костимуляторных молекул (адгезинов). Эти процессы сопровождаются активной секрецией цитокинов (ИЛ-1, ИЛ-2, ИЛ-4, ИЛ-5, ИНФ и др.), которые стимулируют процесс размножения В-лимфоцита и образования клона плазматических клеток, вырабатывающих иммуноглобулины только на данный антиген.
Иммунный ответ на тимуснезависимые антигены (ЛПС, бактериальные полисахариды, высокополимерные белки и др.) осуществляется без участия CD4 Т-хелперов. В этом процессе участвуют только В-клетки, имеющие антигенраспознающий иммуноглобулиновый рецептор. Иммунный ответ при этом развивается быстро, обычно в ранние сроки инфекции, но является менее совершенным. Без участия Т-хелперных клеток продуцируются антитела только одного изотипа (IgM); аффинность этих антител низкая, клетки памяти не образуются.
Процесс образования антител происходит в лимфоидной ткани.
Иммуноглобулины (антитела) — это особые белки сыворотки крови, которые продуцируют плазматические клетки в ответ на проникновение чужеродного антигена и способны к специфическому взаимодействию с этим антигеном.
Впервые немецкий бактериолог Э. Беринг и японский исследователь Ш. Китазато в 1890 г. обнаружили особые свойства антитоксической сыворотки, которые выражались в способности нейтрализовать токсическую активность дифтерийного токсина. Позже немецкий иммунолог П. Эрлих (1891) использовал термин «антитело» для обозначения этого нейтрализующего вещества антитоксической сыворотки. Р. Потеру (Великобритания) и Д. Эдельману (США) в 1959-1970 гг. удалось полностью расшифровать химическую структуру и установить функциональную активность некоторых антител. За эту работу они были удостоины Нобелевской премии.
Было выяснено, что антитела являются гликопротеинами сыворотки крови, сосредоточены в гамма-глобулиновой фракции и имеют глобулярную вторичную структуру. А. Тизелиус и Э. Кебот в 1937 г. опубликовали первую работу по электрофорезу сыворотки крови и установили значительное увеличение гамма-глобулиновой фракции после иммунизации кроликов антигеном. Современное название антител — «иммуноглобулины» (Ig). Они составляют около 30% всех белков сыворотки. Скорость их образования плазматическими клетками велика. За 1 с вырабатывается 1000-1500 молекул.
У млекопитающих обнаружено 5 классов иммуноглобулинов: IgM, IgG, IgA, IgT, IgD. В свою очередь, IgG имеет четыре субкласса — G1, G2, G3, G4, a IgA — два субкласса — А1 и А2. Классы и субклассы вместе взятые называются изотипами иммуноглобулинов. Таким образом, изотипов 9. В пределах изотипа у отдельных особей выявляют варианты иммуноглобулинов, которые отличаются аминокислотной последовательностью в тяжелых цепях. Они получили название аллотипов. Следовательно, аллотипы отражают индивидуальную характеристику антител.
У антител, специфичных к различным антигенным детерминантам, конструкция активных центров неодинакова за счет наличия разных аминокислот в гипервариабельных областях. Эти различия обеспечивают уникальность антигенсвя-зывающего участка молекулы иммуноглобулина. Его называют идиотипом (от греч. idious—уникальный, не такой как все) антитела. Следовательно, идиотип антитела — это отражение специфичности антитела по антигену. Все молекулы Ig, выделяемые отдельным лимфоцитом и его потомками (клоном), имеют одинаковый идиотип и обозначаются как моноклональные антитела. К этому уникальному участку можно получить антитела, которые называются антиидиотипическими. Такие антитела образуются в норме и могут участвовать в регуляции иммунного ответа.
Таким образом, в молекуле Ig различают три типа антигенных детерминант: изотипические, аллотипические, идиотипические. Эти детерминанты определяют специфичность антител по отношению к разнообразным антигенам. Антигенное разнообразие молекул Ig генетически детерминировано.
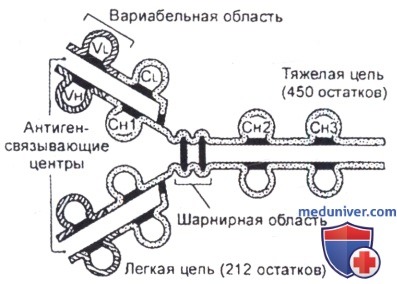
Иммуноглобулины характеризуются общим типом строения. Наиболее просто устроена молекула IgG. По специфичности и способности связывать антиген в каждой молекуле выделяют три фрагмента. Два из них являются антигенсвязывающими Fab-фрагментами (от англ. — antigen binding) и способны реагировать с чужеродным антигеном. Третий фрагмент—константный Fc-фрагмент (от англ, constant — постоянный). Он строго идентичен у молекул одинаковых изотипов и неспецифичен по отношению к антигену. Молекула IgG состоит из четырех полипептидных цепей—двух тяжелых Н-цепей (от англ, heavy—тяжелый), каждая из которых имеет молекулярную массу 50 кДа и содержит около 450 аминокислотных остатков, и двух легких — L (от англ, light—легкий). Легкая цепь имеет по 212 остатков аминокислот с молекулярной массой 25 кДа. Четыре цепи соединены между собой в единую молекулу дисульфидными связями.
Каждая легкая и тяжелая цепь имеет вариабельную V-область с выраженным разнообразием аминокислотного состава, что обеспечивает специфичность молекулы Ig, и константную С-область. Все области подразделяются на гомологичные участки (домены). Домен содержит 110 аминокислотных остатков. У легких цепей обнаружено 2 домена: один — в V-области, второй — в С-области. Каждая тяжелая цепь имеет 4 домена: один V-домен и три С-домена — Сн1, Сн2, Сн3. Между Сн1- и Сн2-доменами находится шарнирная зона, которая обеспечивает подвижность Fab-фрагмента. Сн2-домен является местом связывания комплемента, Сн3-домен способен взаимодействовать с Fc-рецепторами на поверхности иммунокомпетентных клеток.
Молекулы иммуноглобулинов присутствуют в растворимой форме в крови и других биологических жидкостях, на мембране В-лимфоцита — в составе трансмембранного рецептора для антигена.
Основными биологическими функциями иммуноглобулинов являются связывание антигенов и их нейтрализация, опсонизация корпускулярных антигенов для подготовки к поглощению фагоцитами, нейтрализация токсинов и ферментов, участие в лизисе микроорганизмов и собственных измененных клеток, активация комплемента.
Иммуноглобулины G (IgG) имеют молекулярную массу 160 кДа, константу седиментации 7S (т. е. являются микроглобулинами). От общего пула иммуноглобулинов в организме человека на их долю приходится 75-80%. Эти иммуноглобулины способны проходить через плаценту и после рождения ребенка в течение 4-6 мес. обеспечивают надежную защиту от возбудителей инфекционных болезней, создавая естественный пассивный (трансплацентарный) иммунитет. Действие IgG проявляется на поздних этапах первичного и в процессе вторичного иммунного ответа, т.е. после распознавания антигена, проникшего в организм повторно. Они участвуют в различных реакциях иммунитета, опсонизации корпускулярных антигенов, фиксируют и активируют комплемент.
Иммуноглобулины М (IgM) встречаются в свободной форме в виде пентамерной молекулы, состоящей из 5 молекул IgG, объединенных J-цепью (от англ, join — соединять, присоединять), т.е. они состоят из 10 пар легких и тяжелых цепей. Мономерная форма этого иммуноглобулина выполняет функцию антигенраспознающего рецептора на поверхности В-лимфоцитов. В сыворотке крови человека доля IgM составляет 10%. Они имеют молекулярную массу 900 кДа, константу седиментации 19S (являются макроглобулинами), термостабильны, не проходят через плаценту. Основная их биологическая функция — мощная антибактериальная защита, которая выражается в лизисе клеток в присутствии комплемента. Особенно активны IgM в отношении грамотрицательных бактерий: шигелл, сальмонелл, патогенных эшерихий, вибрионов. Вместе с гуморальными факторами естественной резистентности они обусловливают бактерицидную активность крови. В процессе первичного иммунного ответа это первые, наиболее ранние иммуноглобулины.
Иммуноглобулины A (IgA) составляют около 10-15% от общего количества иммуноглобулинов в крови. Flo основная их часть содержится в секретах слизистых оболочек. Структурными особенностями иммуноглобулинов этого класса являются способность образовывать мономерные, димерные, реже трех- и мультимерные молекулы, благодаря наличию J-цепи и секреторного компонента. Поэтому выделяют сывороточные IgA, которые являются мономерами, и секреторные sIgA, представленные на поверхности эпителиальных клеток димерными молекулами с секреторным S-компонентом. Наличие секреторного компонента придает молекуле устойчивость к действию протеолитических ферментов. В зависимости от этого молекулярная масса IgA составляет 150-450 кДа. Они термостабильны, не проходят через плаценту. Функционально эти иммуноглобулины выступают в качестве первой линии защиты на слизистых оболочках и обеспечивают местный иммунитет. Вероятно, они участвуют в регуляции видового и количественного состава микрофлоры слизистых оболочек. Присутствие IgA в молозиве поддерживает иммунитет новорожденных.
Иммуноглобулины Е (IgE) представляют собой мономеры с молекулярной массой 190 кД, константой седиментации 8S; они термолабильны; их количество в крови незначительно. Функциональная активность проявляется в развитии аллергических реакций, так как они способны взаимодействовать своими Fc-фрагментами с тучными клетками и базофилами. В результате такого взаимодействия тучные клетки секретируют вазоактивные амины, что и приводит к развитию аллергических реакций.
Иммуноглобулины D (IgD) обнаруживаются в сыворотке крови в небольшом количестве. Молекулы этого иммуноглобулина экспрессированы на поверхности активированных зрелых В-лимфоцитов вместе с мономерными молекулами IgM и выполняют регулирующие функции.
В сыворотке крови здорового человека иммуноглобулины обнаружены в следующих количествах (мг/100 мл): IgG—1000-1500, IgM — 60-180, IgA—100-400, IgE —0,1, IgD —3-5.
Конститутивные (нормальные) иммуноглобулины являются аутоантителами, т. е. направлены против молекул собственного организма. У взрослых индивидуумов они относятся в основном к IgG, реже к IgM, IgA. Эти антитела способны связывать множество различных антигенов эндо- и экзогенной природы. Они участвуют в поддержании гомеостаза, защите против инфекций, удалении из организма отживших клеток, в представлении антигенов для Т-клеток, индукции синтеза противовоспалительных цитокинов и др.
Иммуноглобулины могут взаимодействовать с антигенами разной химической природы: пептидами, углеводами, полифосфатами и др. Важным их свойством является способность вступать в контакт и связывать цельные, нативные молекулы антигена в неизмененном виде. Сродство между антигенами и иммуноглобулинами характеризуют аффинность и авидность. Аффинность (степень родства) — это сила связывания между одним антигенным эпитопом и одним активным центром антитела. Авидность связи антигена с антителом — это сила связи цельной молекулы антигена (всех его эпитопов) с антигенсвязывающими центрами цельной молекулы антитела. Связывание антигена с антителом основывается на тесном контакте, который обеспечивается ван-дер-ваальсовыми силами (через облако электронов), водородными связями, электростатическим притяжением или гидрофобными связями. Соединения антигена и антитела называют иммунными комплексами. Обычно они фагоцитируются макрофагами, нейтрофилами, эозинофилами и др. либо связываются через рецепторы комплемента с эритроцитами, попадают с ними в печень или селезенку, где фагоцитируются местными клетками. В некоторых случаях иммунные комплексы длительное время циркулируют в крови и вызывают воспалительное поражение органов или подавляют иммунитет.
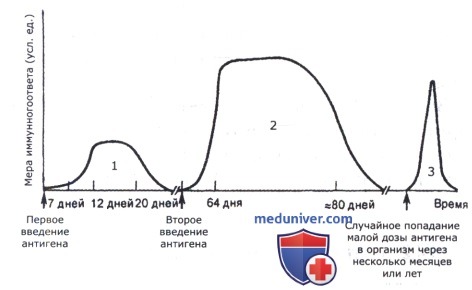
Динамика образования антител при первичном и повторном введении антигена различна.
При первичном введении антигена выделяют:
• Латентную (индуктивную) фазу, в течение которой происходит захват, переработка и представление антигена Т-хелперным клеткам, размножение специфического клона В-лимфоцитов и трансформация в плазматические клетки, начало выработки антител. Продолжительность этой фазы составляет 3-5 дней. В этот период антитела в крови не обнаруживаются.
• Логарифмическую фазу, которая характеризуется поступлением антител в кровь и лимфу, увеличением количества плазмоцитов и геометрическим ростом (в десятки раз) количества антител. Продолжительность этой фазы — 7-15 сут.
• Стационарную фазу, продолжительностью 15-30 сут., во время которой количество антител достигает максимума и стабилизируется.
• Фазу снижения уровня антител, что происходит в результате гибели плазмоцитов ранней генерации. Остаточный низкий уровень антител может сохраняться длительное время—до нескольких месяцев.
В ходе первичного иммунного ответа происходит переключение плазмоцита на синтез антител разных классов. В начале иммунного ответа синтезируются IgM, а позже (на 5-14-й день) появляются IgG.
Динамика иммунного ответа при повторном проникновении антигена в организм имеет следующие особенности: латентная фаза короче (от нескольких часов до 2 дней), логарифмическая фаза продолжительнее, скорость прироста антител и их уровень выше, в последующие фазы количество антител снижается медленно, иногда в течение нескольких лет, рано появляются антитела класса IgG.
Указанные различия в динамике иммунного ответа объясняются феноменом иммунологической памяти. При иммунном ответе некоторые В-лифоциты не дифференцируются в плазмоциты-антителопродуценты, а сохраняются в лимфоидной ткани как клетки памяти. При повторном поступлении антигена количество их быстро увеличивается, и формируются клоны клеток, которые обеспечивают высокоэффективный вторичный ответ.
Примером иммунного ответа этого типа является повторное введение вакцины (ревакцинация), что стимулирует иммунологическую память. Поствакцинальный и постинфекционный иммунитет также поддерживаются иммунологической памятью.
Все В- и Т-лимфоциты, вовлеченные в реакции иммунного ответа, способны формировать клетки памяти, обеспечивая возможность более эффективного и ускоренного ответа (по вторичному типу). В иммунных реакциях, где эффекторные функции выполняют макрофаги, память создается исключительно Т-хелперами.
- Читать далее "Клеточный иммунный ответ"
Редактор: Искандер Милевски. Дата публикации: 14.08.2019
- Факторы неспецифической резистентности (защиты) организма
- Классификация антигенов
- Органы иммунной системы
- Виды иммунитета и формы иммунного ответа
- Гуморальный иммунный ответ
- Клеточный иммунный ответ
- Иммунологическая толерантность
- Типы реакций гиперчувствительности
- Иммунограмма в норме. Основные параметры иммунного статуса человека и методы его оценки
- Техника подсчета основных популяций лимфоцитов методом иммунофлюоресценции
