Рецепты кислотно-основных буферных растворов для окрашивания бактериальных препаратов
Кислотно-основными буферными растворами называют такие растворы, значение pH которых при разбавлении их водой или при добавлении к ним небольших количеств сильной кислоты либо сильного основания не изменяется. Это свойство, известное под названием буферного действия, определяется химическим составом растворов, состоящих из сопряженных кислотно-основных пар, создающих в них кислотно-основное равновесие.
Для микробиологических исследований используют буферные растворы трех типов:
Тип 1: раствор слабой* кислоты и соль этой кислоты (pH < 7). Пример—смесь уксусной кислоты и ацетата натрия (0,1 моль/л раствор CH3COOH + 0,1 моль/л раствор CH3COONa; pH 3,8-5,8).
* Электролиты (соли, основания, кислоты) делятся на 2 группы — сильные и слабые. В водных растворах сильные электролиты диссоциируют почти полностью, слабые—только частично, и в растворе устанавливается динамическое равновесие между недиссоциированными молекулами и ионами.
Тип 2: раствор слабого основания и соль этого основания. Пример — смесь гидроксида аммония и хлорида аммония (0,1 моль/л раствор NH3OH + 0,1 моль/л раствор NH4Cl).
К этому типу буферных растворов относят TBS-трибуферные системы (от лат. tri — натрое, на три части), представляющие собой водные растворы первичных, вторичных и третичных аминов. В состав молекул «трисов» входят три одинаковых радикала, связанных с атомом азота или углерода. Например, трисэтаноламин (НОСН2СH2)3N, триоксиметил-аминометан.
Тип 3: растворы смеси кислой и средней соли или двух кислых солей. Примером этого типа буферных систем могут служить две нижеприведенные смеси:
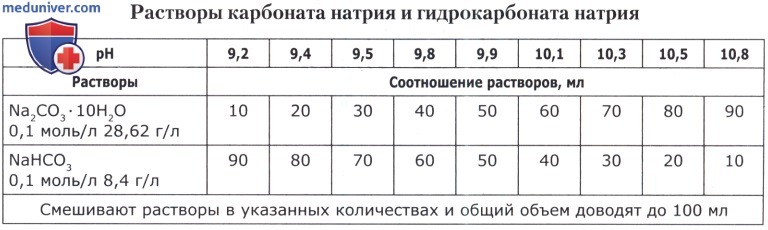
а) смесь карбоната и бикарбоната (0,1 моль/л раствор Na2CO3- 10Н2О + 0,1 моль/л раствор NaHCO3; pH 9,3-11,3);
б) фосфатная буферная смесь, состоящая из натрия дигидрофосфата и натрия гидрофосфата (0,067 моль/л раствор NaH2PO4 + 1/15 Na2HPO4; pH 6,2-8,2).
Эти солевые буферные системы можно отнести и к типу 1, поскольку одна из солей этих буферных систем (NaHCO3 и NaH2PO4 соответственно) выполняет функции слабых кислот.
Буферное действие растворов обусловлено наличием кислотно-основного равновесия общего типа. Например, в основе действия ацетатной буферной системы лежит кислотно-основное равновесие:
СН3СООН <=> СН3СОО- + H+
CH3COONa <=> СН3СОО- + Na+
CH3COONa—сильный электролит, основной источник ацетат-ионов. При добавлении сильной кислоты сопряженное основание СН3СОО- связывает добавленные протоны и превращается в слабую уксусную кислоту.
CH3COO- + H+ <=> CH3COOH
Уменьшение концентрации анионов СН3СОО- уравновешивается повышением концентрации слабой кислоты СН3СООН и ее соли CH3COONa, чему сопутствует незначительное смещение pH в кислую зону.
При добавлении к буферной смеси основания ионы Н+ уксусной кислоты высвобождаются и нейтрализуют внесенные в раствор ионы ОН-, связывая их в молекулы воды:
СН3СООН + ОН- <=> СН3СОО- + Н3O
При этом концентрация слабой уксусной кислоты понижается, уравновешивая концентрацию анионов СН3СОО- и вызывая незначительное смещение pH в сторону увеличения щелочности.
Таким образом, буферное действие растворов, независимо от типа буферной системы, обусловлено смещением кислотно-основного равновесия в результате добавления в раствор ионов Н+ или ОН-, реакции их с компонентами буферной системы и образования слабо диссоциирующих продуктов.
Способность буферных растворов к сохранению постоянства pH ограничена. Каждый отдельный буферный раствор обладает определенной буферной емкостью, характеризующей его способность противодействовать смещению pH при его разбавлении или добавлении к нему сильных кислот либо сильных оснований.
Единицей измерения емкости буферных систем является количество кислоты или основания (моль или микромоль-эквивалент), добавление которых к 1 л буферного раствора изменит значение pH на единицу. Чем выше концентрация солей буфера, тем выше емкость. Максимальная буферная емкость, т.е. наибольшая способность буферной системы противостоять изменению pH, отмечается при равных концентрациях компонентов буферного раствора и уменьшается с отклонением этого соотношения.
В микробиологии буферные растворы используют при постановке различного рода диагностических реакций, а главное—при изготовлении искусственных питательных сред с целью поддержания постоянства pH и обеспечения кислотноосновного гомеостаза растущих на них микроорганизмов.
Для успешного применения буферных смесей при постановке реакций, изготовлении питательных сред сначала необходимо удостовериться, что химический состав выбранной смеси соответствует назначению.
Особенно важную роль качественный состав буферов играет при изготовлении питательных сред, так как некоторые химические вещества, применяемые для изготовления буферных смесей, могут ингибировать рост микроорганизмов и, возможно, оказывать на них мутагенное действие.
Для приготовления буферных растворов применяют дистиллированную воду, не содержащую угольной кислоты (Н2СO3). Для удаления ее воду кипятят 30-45 мин, после чего сосуд закрывают резиновой пробкой, через которую пропущена стеклянная трубка, заполненная натронной известью: 2 весовые части монооксида кальция (СаО) и 1 весовая часть гидроксида натрия (NaOH). pH воды должен находиться в пределах 5,8-7,0.
Навески реактивов взвешивают с точностью до 0,001 г, растворяют в дистиллированной воде в мерной колбе вместимостью 1 л, доводят объем до метки. Концентрацию исходных растворов-компонентов, входящих в состав буферного раствора, выражают в моль/л.
После тщательного перемешивания исходные растворы переносят в сухие колбы с хорошо притертыми пробками.
Буферные растворы хранят при температуре 6(±4)°С в течение 10-12 дней. Исходные растворы сохраняют не более 30 дней.
Рецепт 49. Цитратные буферные смеси:
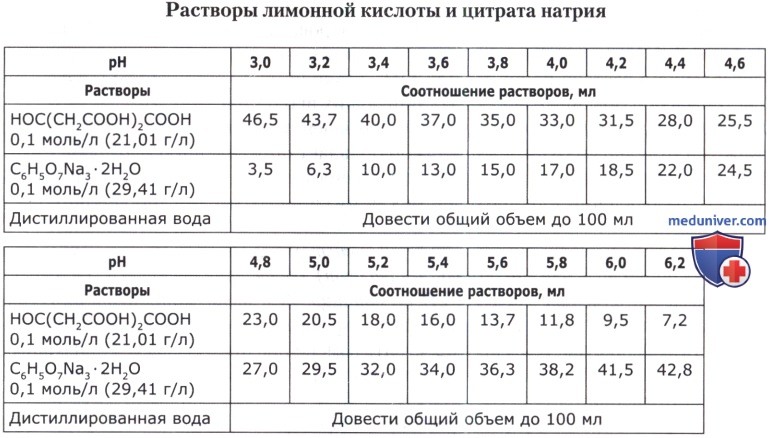
Рецепт 50. Ацетатные буферные смеси:
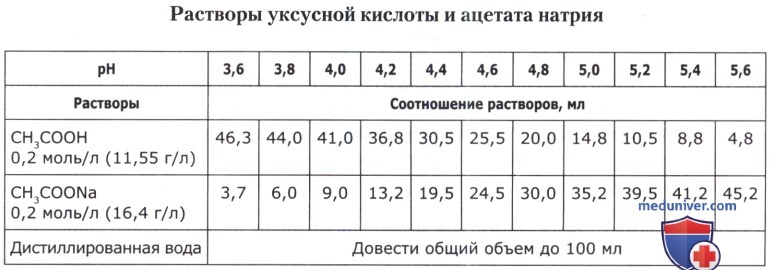
Рецепт 51. Цитратно-фосфатные буферные смеси:
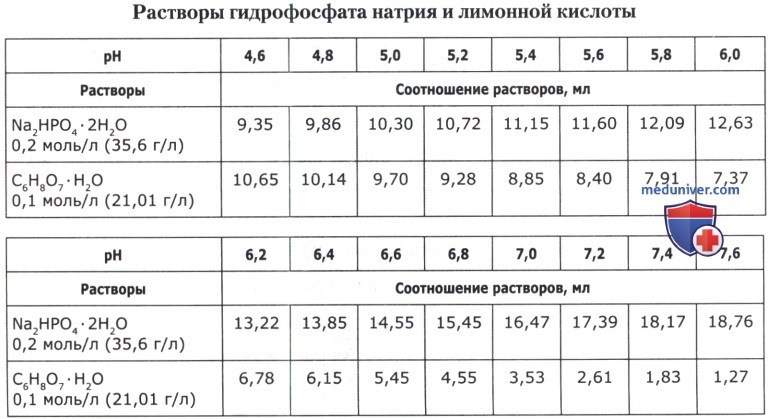
Рецепт 52. Боратные буферные смеси:
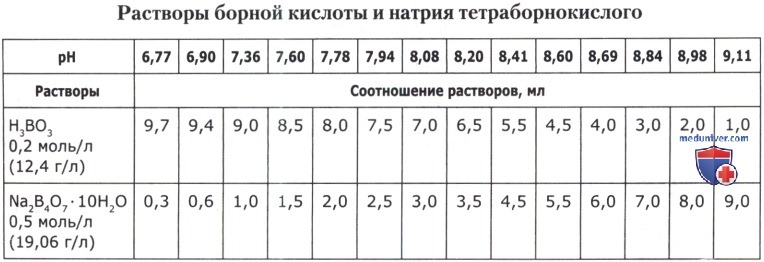
Рецепт 53. Фосфатные буферные смеси:
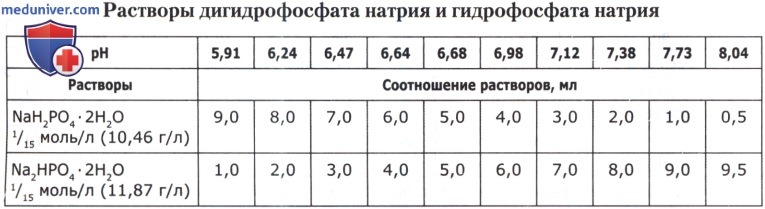
Рецепт 54. Фосфатные буферные смеси:
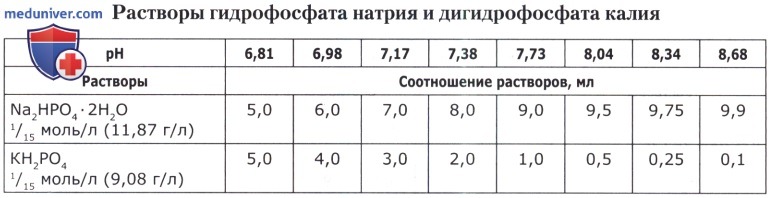
Рецепт 55. Барбиталовые буферные смеси:
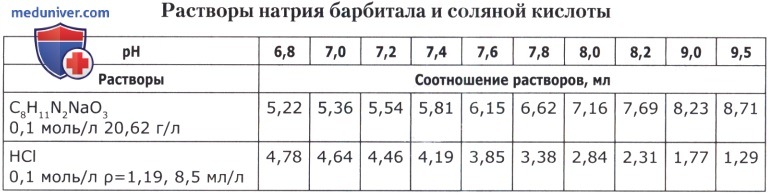
Рецепт 56. Трис-буферные смеси:
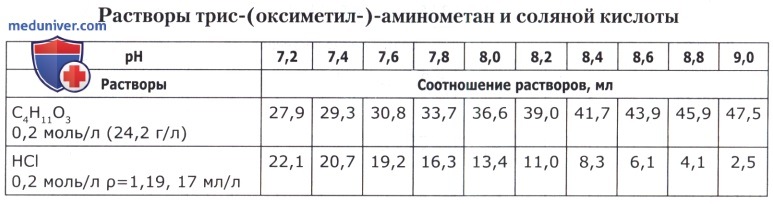
Рецепт 57. Карбонат-бикарбонатные буферные смеси:
- Читать далее "Рецепты питательных сред: мясная вода, пептонная вода, мясопептонный бульон"
Редактор: Искандер Милевски. Дата публикации: 13.09.2019
- Рецепты растворов для окрашивания бактериальных препаратов
- Рецепты кислотно-основных индикаторов для окрашивания бактериальных препаратов
- Рецепты кислотно-основных буферных растворов для окрашивания бактериальных препаратов
- Рецепты питательных сред: мясная вода, пептонная вода, мясопептонный бульон
- Рецепты питательных сред: мясопептонный агар, питательный бульон
- Рецепты питательных сред: трептический перевар, бульон, агар Хоттингера
- Рецепты питательных сред: сахарный бульон, сахарный агар, реактивы на оксидазу
- Рецепты питательных сред: молоко с метиленовым синим, лакмусовое молоко в прописи Минкевича, среда для определения редукции ТТХ
- Рецепты питательных сред: цветные среды Гисса с углеводами
- Рецепты питательных сред: пептонная вода для ферментации углеводов, бульон с феноловым красным
