Возбудитель листериоза (Listeria monocytgenes): морфология и культурально-биохимические свойства
В последние десятилетия XIX в. внимание исследователей привлекла инфекционная болезнь, поражающая преимущественно грызунов. А в 1924 г. в питомнике Кембриджского университета среди кроликов и морских свинок возникла эпизоотия сепсиса. От заболевших животных были выделены не известные в то время грамположительные полиморфные не образующие капсул и спор бактерии.
В последующие годы заболевание, подобное наблюдавшемуся в Кембриджском питомнике, было обнаружено в ряде стран у морских свинок и кроликов (1926), крысоподобного грызуна (1927), овец (1931), птиц (1932), крупного рогатого скота (1934), поросят (1936), лошадей (1948), лисиц (1949), песцов, соболей, нутрий (1964). Стало очевидным, что эта болезнь исключительно широко распространена в животном мире. Первые сообщения о заболевании людей связаны с именами Dumont и Cotonie (Франция, 1918), Atkins (Австралия, 1925).
В 1940 г. Pirie дал название возбудителю болезни — Listeria monocytogenes в честь английского хирурга Джозефа Листера, основоположника метода асептической хирургии, подчеркнув при этом феномен моноцитоза как одного из ранних и наиболее постоянных симптомов листериозной инфекции у животных*. Предложенное название было принято, утверждено Международной классификационной комиссией и используется до настоящего времени.
В 2000 г. мы, анализируя особенности эпидемиологии листериоза, выделили 3 основных этапа во взаимоотношении возбудителя болезни и человеческой популяции.
Первый этап, предшествующий 50-м годам XX в., когда в мире было зарегистрировано всего лишь около 70 случаев листериоза у людей. Возникновение заболеваний наблюдали преимущественно среди работников скотобоен, фермеров-животно-водов и доярок, контактировавших непосредственно с больными животными.
Второй этап, 50-70-е годы. Число зарегистрированных случаев заболеваний ли-стериозом достигло нескольких тысяч случаев. Большая часть из них по-прежнему связана с сельскохозяйственными регионами, контактом с больными животными, в том числе грызунами, употреблением сырого молока.
Третий этап — с 80-х годов XX в. по настоящее время. Характеризуется многочисленными эпидемическими вспышками и спорадическими случаями листериоза в высокоразвитых странах мира (США, Франция, Великобритания, Швейцария, Канада).
Подавляющее большинство регистрируемых случаев болезни связано с употреблением готовых продуктов, главным образом мягких сортов сыра, салатов, мясных и куриных полуфабрикатов. В связи с этим листериоз начинают рассматривать как одну из важнейших пищевых инфекций с высокой летальностью.
В Российской Федерации регистрация листериоза началась в 1956 г. для животных и только в 1992 г. — для людей.
Согласно 9-му изданию определителя бактерий Берджи (1997) листерии относятся к 19-й группе «Грамположительных аспорогенных палочек правильной формы». Анализ гомологии нуклеотидных последовательностей ДНК листерий и близких к ним микроорганизмов, исследование 16S рРНК показали, что листерии филогенетически наиболее близки к роду Brochotrix, занимая промежуточное положение между бациллами и лактобациллами, и несколько более удалены от Streptococcus, Kurthia, Gemella и Erysopelothrix.
В настоящее время род Listeria насчитывает 6 видов: L. monocytogenes, L. seeligeri, L. welshimeri, L. innocua, L. ivanovii, L. grayi. Из них только 2 вида обладают признаками патогенности: L. monocytogenes патогенны для человека и для животных, L. ivanovii — только для животных.
В течение первой половины XX в. листерии рассматривались как типичные возбудители зоонозов. Возбудители листериоза были выделены более чем от 90 видов домашних и диких животных, птиц, рыб, лягушек, моллюсков и некоторых видов клещей. Начиная с 50-х гг. XX в., спорадические случаи и эпидемические вспышки все чаще стали обнаруживаться в человеческой популяции.
Являясь частым компонентом фекальной микрофлоры млекопитающих, листерии широко распространены в почве, подстилке для животных, силосе, часто выделяются из воды открытых водоемов.
Данные последних лет свидетельствуют об исключительно высоких адаптивных способностях листерий, позволяющих размножаться им в природных условиях: на растениях, в почвенных субстратах, водоемах в температурном диапазоне от +4° до 45'С, при колебании pH от 4,8 до 9,0, в присутствии высокой концентрации натрия хлорида и углекислоты.
Высокая метаболическая активность листерий создает возможность легкого перехода их от саирофитической к паразитической форме и наоборот. Поэтому проблема листериоза тесно связана с охраной окружающей среды, особенно с загрязнением почвы и водоисточников вблизи расположения крупных агропромышленных комплексов, где активное проявление листериозной инфекции является прямым следствием глубоких изменений биоценозов под влиянием широкомасштабной и не всегда рациональной человеческой деятельности.
Морфологические, тинкториальные и культурально-биохимические свойства листерий. Микроорганизмы рода листерий, в том числе L. monocytogenes в суточной культуре, представляют собой короткие палочки 0,4-0,5x0,5-2,0 мкм с закругленными концами. В мазках из чистой, особенно жидкой культуры, в ряде случаев образуют короткие цепочки из 3-4 клеток, приближающихся по форме к коккам. В других случаях листерии приобретают вид палочек с булавовидным утолщением на одном конце, обоих концах или в середине, давая основания для предположения, что культура, выделенная в первом случае, представляет собой стрептококки, а во втором случае — бактерии дифтерии.
Палочковидные формы располагаются хаотично, под углом друг к другу в виде римской цифры V, иногда образуют фигуры, напоминающие иероглифы. В стареющих 3-5-суточных культурах наблюдается отчетливо выраженный полиморфизм. Наряду с небольшим количеством мелких типичных форм, в мазке обнаруживаются крупные грубые палочки и даже нити длиной 300 мкм и более.
Свежевыделенные культуры окрашиваются грамположигельно, стареющие — окраску по Граму воспринимают плохо.
Спор и капсул листерии не образуют, кислотоустойчивостью не обладают, при выращивании культур при комнатной температуре до 22°С проявляют подвижность за счет немногочисленных перитрихиально расположенных жгутиков. Листерии, выращенные в термостате при 36-37°С, утрачивают жгутики и, соответственно, подвижность.
Листерии принадлежат к категории микроаэрофилов, культивируемых лучше всего в атмосфере, содержащей 5-10% С02. Являются хеморганотрофами. Имеют метаболизм бродильного типа, сбраживают глюкозу с образованием лактата. Образуют цитохромы.
Характерной чертой L. monocytogenes является двойственность ее природы, проявляющаяся в способности паразитировать в организме человека и различных видов животных и существовать во внешней среде с ничтожным по сравнению с живыми организмами трофическими возможностями в условиях непрерывно меняющейся температуры, влажности и pH среды.
Изучая биохимические механизмы адаптации L. monocytogenes к факторам внешней среды, Л.С. Будалева с соавт. в 1999 г. определила, что у листерий при температуре +(4-6)°С синтезируются «холодовые» изоферменты, более приспособленные к функционированию в этих условиях.
При культивировании листерий в минеральных средах, не содержащих соединений углерода, они способны ассимилировать С02 для синтеза основных полимеров клетки (ДНК, РНК, белки, липиды, углеводы). Следовательно, в условиях внешней среды листерии, как и многие бактерии-сапрофиты, являются микротрофами, использующими хемолитоавтотрофный путь метаболизма.
Существует мнение, что листерии, вышедшие из внешней среды, попав в организм теплокровного животного, сформировали в процессе эволюции компенсаторные генетико-биохимические механизмы, обеспечивающие их жизнеспособность в меняющихся экологических условиях.
Листерии способны размножаться в салатах, молочных продуктах, мясных полуфабрикатах в условиях бытового холодильника даже при +4°С, хотя температурный оптимум их роста 30-37°С.
Размножение листерий происходит в диапазоне pH от 6,0 до 9,0, оптимальной является слабощелочная реакция pH 7,2-7,4.
К питательным средам листерии непритязательны, могут расти на простых питательных средах, содержащих продукты пептического или триптического перевара, МПБ, МПА, агаре Хоттингера, но наилучший рост отмечается на агаре с добавлением крови или сыворотки.
При выделении колоний на поверхности среды в первые сутки они едва заметны невооруженным глазом. Через 48 ч инкубации в термостате они увеличиваются и в зависимости от густоты роста и свойств питательной среды достигают 1,5-2,5 мм в диаметре. Культура имеет своеобразный запах, напоминающий запах творога или сыворотки, очевидно, обусловленный продуктами углеводного обмена, образующимися во время роста культуры.
Изолированные колонии листерий могут быть гладкими в S-форме и шероховатые — в R-форме. Гладкие формы имеют вид росинок, слегка выпуклые в центральной части, с ровным четко очерченным краем. В проходящем свете — прозрачны, в падающем — мутные, серовато-молочного цвета.
В смешанных культурах хорошо дифференцируются при косом освещении. Для этого зеркало устанавливается плоской поверхностью кверху. Осветитель с голубым фильтром размещается под углом примерно 40° на расстоянии 12,5 см от зеркала. Чашки просматриваются без крышек. Колонии листерий в S-форме — выпуклые с резко очерченным краем, сине-зеленого цвета, водянистой консистенции, колонии в R-форме — шероховатые с зазубренным краем и грубозернистой центральной частью. Между крайними S- и R-формами имеется множество переходных вариантов.
На кровяном агаре S-формы образуют мелкие блестящие колонии, окруженные узкой зоной гемолиза, проявляющейся более отчетливо на вторые сутки роста. Значительно лучше гемолиз выявляется после снятия колонии с поверхности агара или инокуляции культуры в толщу агара.
При культивировании листерий в МП Б, бульоне Хоттингера или других жидких средах на вторые сутки культивирования в термостате появляется помутнение в виде легкой дымки. В дальнейшем на дне пробирки концентрируется осадок, который в последующие 7-10 суток при полном просветлении столбика среды приобретает слизистый характер, а при встряхивании пробирки поднимается в виде косички, трудно разбиваемой в разномерную муть. Культуры в R-форме образуют в бульоне хлопьевидный или крошковидный рост с тонкой пленкой и пристеночным кольцом на поверхности бульона.
В полужидком агаре рост листерий идет в виде штриха вдоль укола петли с более интенсивной зоной помутнения на 2-3 сутки, на глубине 3-5 мм от поверхности. Если посевы культивированы при 37,6-37,7°С, в характере роста особых изменений не происходит. Если их выдерживают при 20-22°С, на 2-3 сутки на поверхности агара и верхней части столбика появляется характерный рост в виде открытого зонтика, что свидетельствует о подвижности выделенного микроорганизма.
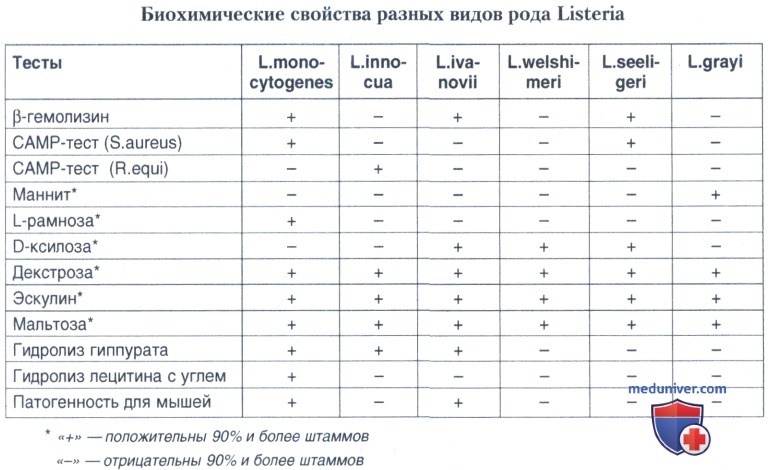
Листерии относят к категории бактерий сравнительно малоактивных в биохимическом отношении. Все виды, относящиеся к этому роду, каталазоположительны. Индол и сероводород не образуют, нитраты не восстанавливают. К углеводам и многоатомным спиртам разные виды листерий относятся неодинаково. Наиболее показательным является определение ферментативных свойств в отношении трех субстратов: рамнозы, ксилозы и маннита. Данный тест позволяет дифференцировать 3 гемолитических вида листерий. L. monocytogenes ферментирует рамнозу и не ферментирует ксилозу и маннит; L. ivanovii и L. seeligeri не ферментирует рамнозу и маннит, но утилизирует ксилозу.
Ферментативные свойства листерий определяют на средах Гисса. Посевы инкубируют 7 дней при 35°С, ежедневно проверяя наступление ферментации, хотя L. monocytogenes ферментирует рамнозу обычно уже на вторые сутки. Более полный ряд ферментации листериями включает: декстрозу, эскулин, мальтозу, рамнозу, маннит и ксилозу. Все виды листерий дают положительную реакцию на декстрозу, эскулин и мальтозу и все виды листерий, за исключением L. grayi, инертны в отношении маннита.
Тест ферментации углеводов для идентификации листерий имеет большое значение, но необходимо помнить, что практически все тесты па углеводы не дают 100% достоверности идентификации вида.
Относительно высокая частота ферментации рамнозы L. innocua и L. welshimeri и отсутствие ферментации ксилозы L. monocytogenes и L. innocua подчеркивают значение β-гемолитического САМР-теста (метод Christie, Atkins, Munch— Peterson) для идентификации L. monocytogenes. Принцип САМР-теста основан на синергизме листериолизина-О L. monocytogenes и L. seeligeri с гемолизином Staphylococcus aureus и листериолизина-О L. ivanovii — с гемолизином Rhodococcus equi.
При совместном культивировании листерий, S. aureus и R. equi на кровяном агаре в точках соединения гемолизинов S. aureus, L. monocytogenes или L. seeligeri или гемолизинов R. equi и L. ivanovii образуются более обширные и четкие зоны гемолиза по сравнению с теми, которые формируются вокруг колоний отдельно высеянного гемолитического микроорганизма.
Другим биохимическим тестом, имеющим большое значение в идентификации L. monocytogenes, является выявление лецитина (фосфатидилхолинспецифическая фосфолипаза). Однако при культивировании L. monocytogenes на обычных или стандартных средах с лецитином лецитиназа не всегда выявляется. В присутствии активированного угля в среде, содержащей лецитин, L. monocytogenes проявляет четко выраженную лецитиназную активность, проявляющуюся в виде плотной зоны помутнения вокруг колоний шириной 2-4 мм в первые сутки и 6-10 мм — на вторые сутки инкубации посевов в термостате. В отличие от L. monocytogenes другие виды листерий, продуцирующие лецитиназу (L. innocua, L. seeligeri), специфической индукции в присутствии активированного угля не проявляют.
- Читать далее "Антигены листерий (Listeria)"
Редактор: Искандер Милевски. Дата публикации: 29.11.2019
- Возбудитель листериоза (Listeria monocytgenes): морфология и культурально-биохимические свойства
- Антигены листерий (Listeria)
- Устойчивость листерий к факторам внешней среды
- Факторы патогенности возбудителя листериоза (Listeria monocytgenes)
- Клинические проявления листериоза
- Иммунитет при листериозе
- Эпидемиология листериоза
- Микробиологическая диагностика возбудителя листериоза
- Лечение и профилактика листериоза
