Методы оценки качества питательных сред по биологическим показателям
Оценка качества питательных сред и их компонентов проводится по следующим показателям, выбираемым в соответствии с назначением среды.
1. Чувствительность. Определяется по максимальному разведению культуры, при котором на всех засеянных чашках (в пробирках) обнаруживается рост. Результат указывается по соответствующему разведению (10-1—10-9) для всех групп питательных сред.
2. Эффективность. Определяется по выходу микробных тел с 1 мл питательной среды в млрд/мл (для накопительных сред и стимуляторов роста).
3. Показатель стабильности основных свойств микроорганизмов. Определяется по отношению числа атипичных по морфологии, биохимическим, серологическим, фаголизабельным и другим свойствам колоний к общему числу колоний на чашках с испытуемой средой в % (для всех сред, кроме предназначенных для контроля качества препаратов).
4. Дифференцирующие свойства. Определяются по выраженности отличительных признаков патогенных микроорганизмов от непатогенных видов и естественных ассоциантов на основании структурных особенностей колоний, их окраски, изменения цвета и других признаков (для дифференциальных сред и сред для идентификации).
5. Скорость роста. Определяется по минимальному времени инкубации после посева культур, достаточному для их выявления, и выражается в часах (для всех групп питательных сред).
6. Показатель ингибиции. Определяется по степени подавляющего воздействия на постороннюю микрофлору. Выражается либо кратностью того минимального разведения, при котором полностью отсутствует рост посторонней микрофлоры, либо величиной отношения числа сформировавшихся клеток тест-штамма к расчетному количеству посеянных при соответствующем разведении клеток (для всех сред, кроме предназначенных для выращивания и для контроля качества препаратов).
7. Показатель прорастания микробных клеток. Данный показатель определяют для плотных питательных сред. Подготовку тест-штаммов для контроля, их посев в среду осуществляют по аналогии с методикой определения показателей чувствительности и скорости роста. Посев осуществляют параллельно на испытуемую и контрольную среду, как правило, из двух разведений, обеспечивающих формирование на чашке Петри не менее 25 и не более 150 колоний. В случае забора клинического материала при помощи тампонов посев на среды осуществляют с соблюдением равнозначности посева материалов на испытуемую и контрольные среды.
В качестве контрольной может быть использована среда, на которой формируется максимальное число колоний из числа засеянных. Показатель прорастания микробных клеток определяют отношением среднего числа колоний, образовавшихся на испытуемой среде, к среднему числу колоний на контрольной среде в процентах.
а) Тест-штаммы культур. Порядок хранения и подготовка для контроля. Набор тест-штаммов для оценки соответствующей питательной среды авторы определяют в процессе экспериментальной работы и рекомендуют их для контроля питательной среды.
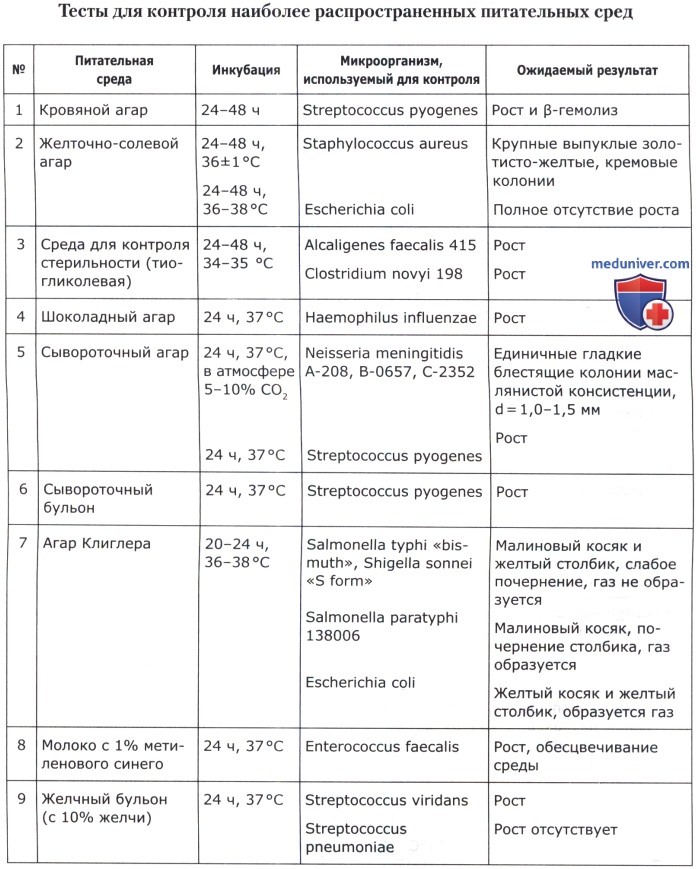
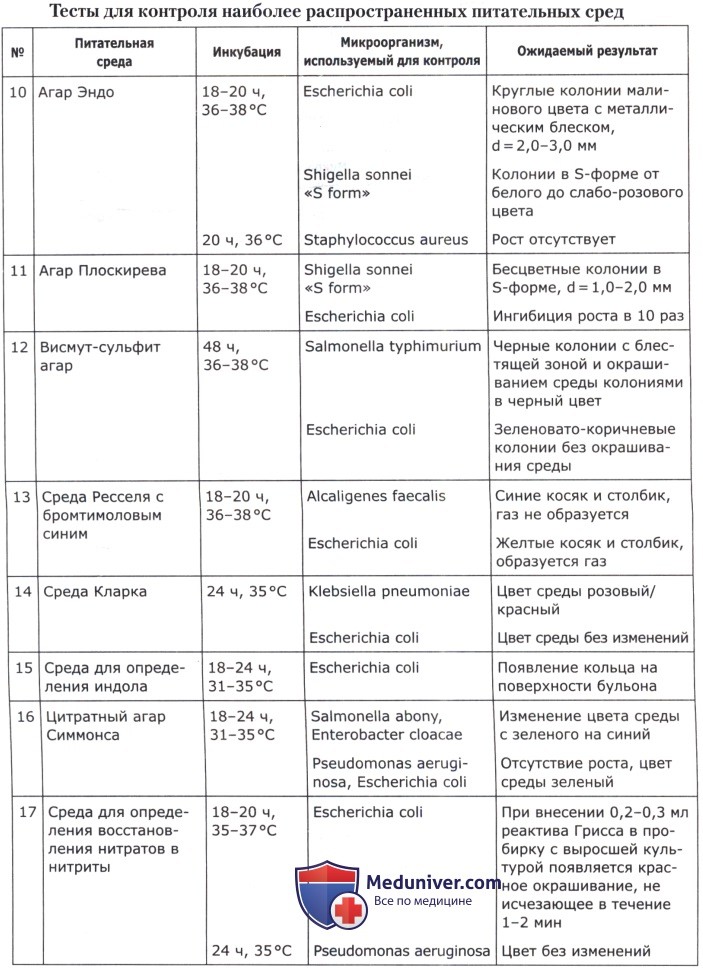
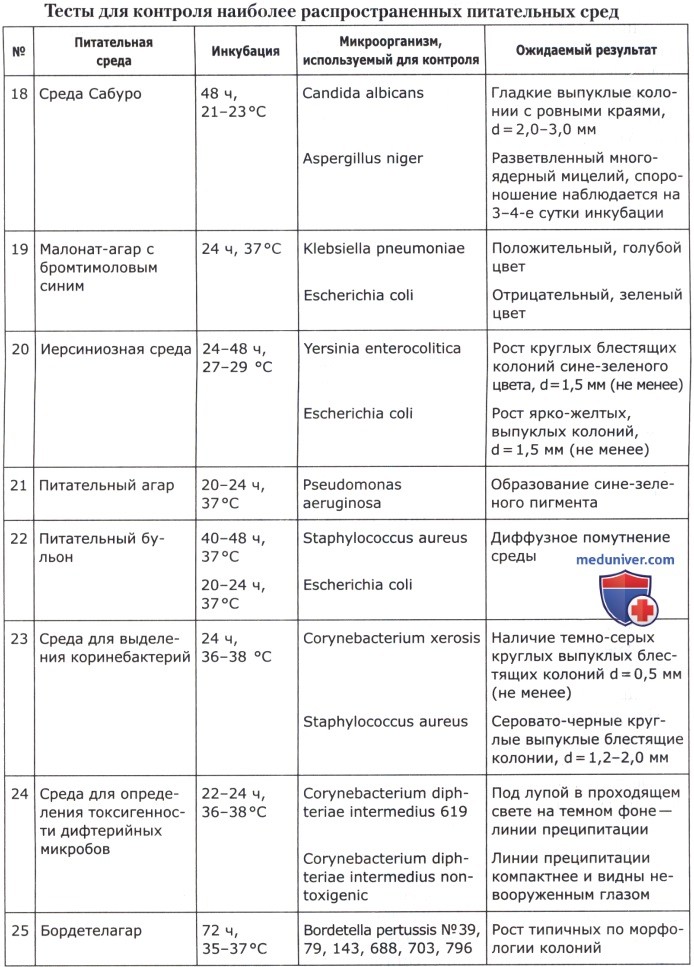
Питательные среды должны обеспечивать рост не менее 100 колониеобразующих единиц (КОЕ) соответствующих тест-штаммов при посеве 0,1 мл микробной взвеси из разведения 10-6. В качестве инокулята можно использовать одну бактериологическую петлю (d = 2 мм) суспензии тест-штамма. Оптическая плотность приготовленной суспензии соответствует стандартному образцу мутности ГИСК им. Л. А. Тарасевича 10 ед. (ОСО 42-28-85 П) или по стандарту раствора сульфата бария Мак-Фарланда. В этом случае результаты оцениваются по интенсивности роста культуры:
— обильный рост — 4+ (++++)
— умеренный рост — 3+ (+++)
— слабый рост — 2+ (++)
— очень слабый рост — 1 + (+)
Необходимым условием качества среды является сохранение тест-культурами своих тинкториальных, морфологических, культуральных и физиолого-биохимических свойств.
Рекомендуемые для контроля свежевыделенные штаммы с момента выделения и получения их в виде чистых культур не должны проходить более 3-5 последовательных пересевов на питательных средах с последующим (обязательным) лиофильным высушиванием в большом количестве ампул.
Для проведения внутрилабораторного контроля качества бактериологическая лаборатория должна иметь коллекцию типовых культур. Эталонные штаммы культур разрешается получать в специализированных коллекциях, функционирующих в системе М3 РФ:
— Государственная коллекция патогенных микроорганизмов Государственного института стандартизации и контроля (ГИСК) им. Л. А. Тарасевича;
— Всероссийская коллекция промышленных микроорганизмов (ВКПМ);
— Всесоюзная коллекция непатогенных микроорганизмов (ИБФМ).
Из международных коллекций:
— Американская коллекция типовых культур (АТСС);
— Английская национальная коллекция типовых культур (ЛСТС);
— другие коллекции.
Из организаций, получивших статус референтных лабораторий.
От коммерческих производителей.
Изоляты микроорганизмов, выделенные из клинического материала и используемые для контроля, должны по свойствам соответствовать микроорганизмам признанных национальных и международных коллекций. Чаще для контроля используют штаммы в лиофилизированном виде.
Лиофилизированные музейные и свежевыделенные культуры хранят при температуре 4-6 °С. Восстановление культур из лиофилизированного состояния проводят с использованием жидкой и плотной питательных сред, принятых для определенной группы микроорганизмов.
Рекомендуемые для контроля штаммы должны проверяться на отсутствие диссоциации по соответствующим тестам:
1. Визуальный просмотр колоний на чашках и в микроскопе в «косо направленном» свете.
2. Проба кипячением 2 млрд взвеси микробных тел агаровой культуры в физиологическом растворе на водяной бане в течение 1 ч. Взвесь должна быть гомогенной.
3. Эмульгирование агаровой культуры на стекле в 0,85 и в 4% растворах NaCl, а также в растворе трипофлавина 1:1000 (для культур, не содержащих поверхностных К-антигенов). В культуре не должны образовываться хлопья.
4. Специфическая реакция агглютинации специфическими сыворотками. Реакция агглютинации должна быть не менее, чем на 3+.
Далее изучают культурально-морфологические и биохимические свойства и определяют стабильность биологических свойств.
б) Определение показателей чувствительности и скорости роста. Культуры тест-штаммов, выращенные на скошенном агаре, смывают физиологическим раствором NaCl и подводят под оптический стандарт мутности ОСО 42-28-85 П, соответствующий 10 ед. мутности. В тех случаях, когда не определен коэффициент пересчета микробных клеток в единицы мутности, отсчеты ведут от 10 ед. мутности по соответствующему разведению.
Из исходной стандартной взвеси готовят 10-кратные разведения путем последовательного переноса не менее 0,5 мл культуры в 8 пробирок с 4,5 мл физиологического раствора, тщательно перемешивая и меняя стерильную пипетку после каждого «шага».
Из 4 последних разведений (10-5, 10-6, 10-7, 10-8) по 0,1 мл взвеси из каждого вносят в 3 хорошо подсушенные чашки (пробирки) с плотной средой или в 3 пробирки с 10 мл жидкой (полужидкой) питательной среды.
При пересеве в жидкие (полужидкие) питательные среды обогащения посевы производят из разведений (10-4, 10-5, 10-6, 10-7) по 1,0 мл взвеси в каждую пробирку с 9 мл среды.
При посевах на чашки и пробирки с плотной средой взвесь культуры распределяют на поверхности среды, используя для каждой чашки новый шпатель, а на пробирках со скошенным агаром взвесь культуры распределяют путем обкатывания. Метод обкатки можно использовать и для чашек. Посевы помещают в соответствующие условия выращивания.
После инкубации производят учет результатов. Чувствительность среды определяют по наибольшему разведению, обеспечивающему формирование колоний или визуально видимый рост на всех засеянных чашках (пробирках) с питательной средой.
При определении показателя чувствительности в жидких средах обогащения в случае отсутствия визуально обнаруживаемого роста после соответствующей инкубации посевов из каждой пробирки производят высев на чашки с питательным агаром, разделенном на 4-8 секторов, на каждый из которых засевают по одной петле культуры из каждой пробирки с жидкой средой.
Учет результатов скорости роста культуры в каждом взятом в опыт разведении микробной взвеси производят для плотных сред через 12-24-48 ч инкубации, для жидких (обогащения) — через 3-6 ч и далее. Показатель скорости роста определяют по минимальному времени инкубации посевов, за которое при соответствующем разведении обеспечен отчетливый видимый невооруженным глазом рост культуры (помутнение, наличие пленки, осадка, роста по уклону и др.) во всех засеянных пробирках с жидкими (полужидкими) питательными средами или формирование типичных легко дифференцируемых колоний на чашках (пробирках) с плотной средой.
в) Определение стабильности биологических свойств культур. Определение этого показателя проводят на чашках, где выросло не менее 25 и не более 100-150 колоний. Изучают свойства культур, выращенных на питательных средах, по культурально-морфологическим, биохимическим, серологическим, фаголизабельным и другим признакам. При этом оцениваются:
1. Характер роста культур (равномерное помутнение среды, формирование пленки на поверхности среды, придонно-пристеночный рост, рост в виде осадка и др. — в жидких средах; равномерное зональное помутнение среды, рост по уколу, сталактитовый рост, в виде елочки и др. — в полужидких средах; форма, структура, характер роста колоний, диаметр — на плотных средах).
2. Морфология микроорганизмов — форма (кокки, палочки, отсутствие полиморфизма в размерах, окраске и др.), расположение (одиночное, парное, гроздевидное, цепочки и др.), строение (наличие капсулы, жгутиков, спор, включений и др.), подвижность.
3. Серологические признаки, которые изучают в реакции агглютинации на стекле с агглютинирующими сыворотками, с антительными диагностикумами или с люминесцирующими сыворотками. Проверяют физико-химическое состояние клеток — стабильность взвеси микробов (отсутствие спонтанной агглютинации) в растворе трипофлавина, в 0,85% и 4% NaCl.
4. Биохимические свойства (ферментация углеводов, образование H2S, индола и др.), пигментообразование.
5. Фаголизабельность.
6. Биологические свойства (гемолиз) и др.
Бактериальный стандарт мутности и работа с ним. При некоторых микробиологических исследованиях возникает необходимость посева определенного количества микробных тел в жидкую или плотную среду. В таких случаях из микробной культуры, предназначенной для посева, в соответствии с бактериальным стандартом мутности готовят взвесь, содержащую в единице объема (1 мл) заданное количество микробных тел.
Мутность бактерийной взвеси определяют визуально методом сравнения. Для этого пользуются отраслевым стандартным образцом мутности (ОСО 42-28-85 П), выпускаемым ГИСК им. Л. А. Тарасевича. Стандарт мутности представляет собой запаянную пробирку из нейтрального стекла, содержащую суспензию мельчайших частиц стекла (приблизительно соответствующих по величине бактериям). Мутность стандарта, равного 10 ед. мутности, эквивалентна 10 международным единицам мутности, которые ориентировочно соответствуют следующим концентрациям клеток в 1 мл:
0,93х109 клеток/мл для микробов кишечной группы;
11 х 109 клеток/мл для микробов коклюшной группы;
1,7х109клеток/мл для микробов бруцеллезной группы;
2,2х109 клеток/мл для холерного вибриона;
5,0x109 клеток/мл для туляремийных микробов.
Для ОСО 5 ед. концентрация соответственно в 2 раза меньше, чем для ОСО 10 ед. мутности. В комплект с эталоном входит: таблица сравнения, содержащая набор полос различной толщины, и 2 пустые пробирки, диаметр, толщина стенок и цвет стекла которых точно соответствует пробирке-эталону, так как при сравнении микробной взвеси одной концентрации, содержащейся в пробирках различного диаметра, мутность жидкости будет неодинаковой.
Проводить измерения при помощи ОСО необходимо при температуре от 10 до 30 °С. Для приготовления микробной взвеси обычно пользуются 18-24-часовыми микробными культурами, выращенными на скошенном мясопептонном агаре или другой плотной среде. Старые культуры микробов непригодны, так как они содержат большое количество погибших микробных клеток. Бактерийную взвесь помещают в стандартную пробирку из комплекта, добавляют около 6-7 мл физиологического раствора, осторожно перемешивают, встряхивая, до гомогенного состояния.
Сравнение степени мутности в опытной и эталонной пробирках производят визуально. Для этого необходимо совместить пробирки с ОСО и исследуемую в вертикальном положении, разместить их на уровне глаз и, плотно приложив к их задним стенкам сравнительную таблицу, осветить их источником света таким образом, чтобы пробирки не экранировали друг друга от света. Если видимые элементы сравнительной таблицы видны через ОСО и пробирку с исследуемой взвесью с одинаковой четкостью, мутность их считают одинаковой и равной мутности, указанной на этикетке ОСО. Если мутность в пробирке с исследуемой взвесью не соответствует мутности ОСО, то необходимо изменить концентрацию взвеси таким образом, чтобы ее мутность совпала с мутностью ОСО. Срок годности ОСО — 12 мес., после чего он вновь должен быть переаттестован в ГИСК им. Л. А. Тарасевича.
Стандарт мутности по Мак-Фарланду служит для аналогичных целей. В качестве эталона бактериальной взвеси в оригинальных стандартах используется суспензия Ba2SO4, а в эквивалентах — латексные частицы. Стандарты Мак-Фарланда 0,5; 1,0; 2,0; 3,0; 4,0; 5,0 ед. содержат суспензию, соответствующую 1,5х108, 3,0х108, 6,0х108, 9,0х108, 12,0х108, 15х108 КОЕ/мл.
Оригинальные стандарты мутности по Мак-Фарланду имеют непродолжительные (до 1/2 года) сроки годности, а эквиваленты долговечны и стабильны.
Безусловным критерием качества приготавливаемых сред является работа на валидированном оборудовании при одновременной закладке как современных химических тестов для контроля стерилизации, так и стандартных буферов для рН-метрии.
- Читать далее "Производители коммерческих питательных сред по микробиологии и их виды"
Редактор: Искандер Милевски. Дата публикации: 20.05.2019
- Требования к питательным средам в микробиологии
- Способы стерилизации питательных сред в микробиологии
- Условия и сроки хранения питательных сред в микробиологии
- Методы определения сроков годности питательных сред в микробиологии
- Методы определения качества питательных сред по физико-химическим показателям
- Методы оценки качества питательных сред по биологическим показателям
- Производители коммерческих питательных сред по микробиологии и их виды
