Методы определения качества питательных сред по физико-химическим показателям
Каждая приготовленная среда для признания ее годности к применению должна быть проконтролирована по физико-химическим и биологическим показателям. Для этого несколько образцов среды засевают лабораторной культурой того организма, для которого она предназначена, и изучают характер его роста. Только после проведения всех видов контроля среды признаются годными и могут быть использованы по назначению.
Используемые в лабораториях коммерческие питательные среды контролируют на предприятиях-производителях, поэтому внутрилабораторный контроль их качества проводят в исключительных случаях, таких как:
— указание на необходимость проведения контроля в приказах М3 РФ и других документах;
— несоответствие клинического диагноза результатам микробиологического исследования в лаборатории;
— неудовлетворительное выполнение внешней оценки качества микробиологических исследований;
— неудовлетворительное качество среды при использовании в практической работе;
— несоответствие величины колоний искомого микроорганизма данному виду бактерий при росте в данной среде;
— позднее появление роста культуры в среде, не соответствующее срокам данного организма;
— отсутствие подавления роста сопутствующей микрофлоры на среде с заявленными ингибирующими свойствами.
Как правило, коммерческие питательные среды в практических лабораториях контролируют по показателям pH с использованием потенциометра, по стерильности с инкубированием в термостате 3-5% каждой приготовленной среды и по биологическим показателям.
Представленными рекомендациями необходимо руководствоваться на этапе конструирования питательных сред, при последующих их испытаниях, а также при серийном промышленном выпуске. Данные рекомендации могут быть использованы и для оценки питательных сред лабораторного изготовления.
При проведении исследований и в практике производства питательных сред могут использоваться самые разнообразные методы оценки их качества. Однако получаемые результаты трудно сопоставимы, что создает определенные неудобства в работе. В связи с этим оценка качества питательных сред проводится по следующим унифицированным показателям: прозрачность и цветность, pH, содержание хлоридов (в пересчете на натрия хлорид), содержание аминного азота, стерильность, прочность студня среды.
а) Методика определения прозрачности и цветности. Прозрачность и цветность являются важными характеристиками среды, так как в значительной степени определяют достоверность визуальных наблюдений за ее стерильностью, за наличием или отсутствием роста микрофлоры исследуемых субстратов.
Прозрачность и цветность большинства питательных сред определяют визуально в растворе или в готовом геле. Что касается мутных растворов, то для определения прозрачности (λ = 540 нм) в кювету с толщиной слоя 3 мм наливают раствор и измеряют оптическую плотность на фотоэлектроколориметре при данной длине волны. Раствором сравнения служит вода.
б) Методика определения pH. Водородным показателем (pH) называется отрицательный десятичный логарифм активности ионов водорода:
pH = -lgaH+
pH — фактор среды, оказывающий влияние как непосредственно на микроорганизмы, так и на окислительно-восстановительный потенциал в среде. Поддерживать определенный уровень pH особенно важно при культивировании патогенных микроорганизмов, которые приспособились к существованию в организме человека и жизнедеятельность которых возможна в определенном достаточно узком диапазоне этого фактора. Большинство микроорганизмов, в том числе и патогенных, особенно активно растут при нейтральном и слабощелочном значении pH.
Потенциометрический метод измерения pH заключается в потенциометрическом определении электродвижущей силы (ЭДС) элемента, состоящего из двух электродов — индикаторного, потенциал которого зависит от активности ионов водорода, и электрода сравнения — стандартного электрода с известной величиной потенциала. Преимуществом данного метода по сравнению с другими известными методами определения pH (например, колориметрическим) является его более высокая точность и меньшее число ограничений, связанных с присутствием в растворе окислителей, восстановителей, с белковой или солевой ошибками, а также возможность его применения при определении pH мутных или гелеобразных растворов.
Для точного определения pH пользуются pH-метром (потенциометром) с применением стеклянного электрода в качестве индикаторного. Применяют высокоомные потенциометры различных систем или pH-метры, шкала которых градуирована в милливольтах либо непосредственно в единицах pH.
Подготовка pH-метра и электродной системы производится согласно инструкциям, прилагаемым к прибору. Перед работой с потенциометром необходимо, пользуясь стандартными буферными растворами со значениями pH при 25 ° С 1,69; 3,55; 4,01; 6,84; 9,14; 12,3,провести калибровку прибора. Для приготовления таких растворов могут быть использованы фиксаналы по ГОСТ 8-135-74.
Различие между показанием прибора и номинальным значением pH буферного раствора не должно превышать 0,04 единицы pH. Если pH контролируемого раствора отличается менее чем на единицу от pH стандартного буферного раствора, то достаточно проверить прибор по одному буферному раствору, величина pH которого лежит в том же диапазоне измерения, что и значения pH контролируемого раствора. Если pH контролируемых растворов находятся в широких пределах, то проверку pH-метра следует производить по двум стандартным буферным растворам в соответствии с инструкцией.
При измерении pH контролируемых растворов отсчет величины pH по шкале прибора производят после того как показания прибора примут установившееся значение. Время установления показаний определяется буферными свойствами и температурой раствора (обычно время установления показаний не превышает 2 мин). Определение pH проводят при 25±2°С, в противном случае необходимо сделать соответствующие поправки, поскольку значение pH зависит от температуры. Так, pH стандартного фосфатного буфера равен 6,98 при 0°С, 6,88 —при 20 °С и 6,84 — при 37 °С.
При измерении pH агаровых сред или других коллоидных систем следует иметь в виду, что полученные значения являются условными.
При потенциомегрии питательных сред необходимо придерживаться следующих правил.
1. Доводить температуру буфера, используемого для калибровки pH-метра, до температуры измеряемой пробы.
2. Определять pH после стерилизации. Автоклавирование приводит, как правило, к снижению pH, поэтому перед стерилизацией pH среды повышают на 0,2 единицы, а после автоклавирования реакцию среды проверяют повторно. Значительный сдвиг pH может происходить даже после стерилизации фильтрованием.
3. Проверять pH среды перед использованием.
В гидролизатах и в готовых жидких средах определение pH проводят непосредственно в растворе.
Для сухих препаратов, не содержащих в своем составе агар, определение проводят в 2% его растворе, pH воды устанавливается предварительно и должен быть равен 7,0-7,2.
Для сухих препаратов, содержащих в своем составе агар, определение pH проводят в экстракте, приготовленном путем разведения 2 г сухого препарата в 100 мл воды (pH 7,0—7,2), настаивания в течение 1 ч при комнатной температуре и последующего фильтрования.
В тех случаях, когда нет необходимости в высокой точности измерений, pH определяют при помощи раствора индикаторного красителя или индикаторной бумаги. При правильном их подборе pH можно измерить с точностью до 0,2 единицы. Индикаторные растворы и бумага, а также их соответствующие стандартные образцы определенного цвета для различных интервалов pH поставляются большинством фирм, производящих реактивы и лабораторное оборудование.
в) Метод определения содержания хлоридов (в пересчете на натрия хлорид). Содержание хлоридов (в пересчете на натрия хлорид) является относительным показателем осмотического давления в среде, соответствия его уровню, необходимому для сохранения жизнедеятельности микроорганизмов.
Метод основан на определении ионов хлора после окисления белков калия пермангаматом в кислой среде в присутствии нитрата серебра, избыток которого оттитровывают раствором роданида аммония.
К 0,2 мл препарата, содержащего 0,5-1,0 мг/мл (оптимальные значения содержания в питательных средах) натрия хлорида, внесенного в коническую колбу, вместимостью 50 мл, прибавляют 5 мл раствора нитрата серебра (0,01 моль/л готовят используя стандарт-титр — фиксанал и 1 мл концентрированной азотной кислоты), осторожно нагревают с использованием асбестовой сетки до кипения. К испытуемому раствору прибавляют по каплям насыщенный раствор калия перманганата до бледно-розового окрашивания, не исчезающего в течение 5 мин. Затем прибавляют глюкозу (около 10 мг) до исчезновения окраски. По охлаждении раствора избыток ионов серебра титруют раствором роданита аммония (0,01 моль/л готовят используя стандарт-титр — фиксанал) до образования розового окрашивания (индикатор —железо-аммонийные квасцы — насыщенный 40% раствор), определяя объем, пошедший на титрование.
Параллельно проводят контрольный опыт — в качестве образца — 0,2 мл дистиллированной воды.
Содержание в средах натрия хлорида в процентах (X) вычисляют по формуле:
Х=((А-В)х К х 0,000585 х 100)/0,2,
где А — количество раствора роданита аммония (0,01 моль/л), пошедшего на титрование в контрольном опыте (мл);
В — количество раствора роданита аммония (0,01 моль/л), пошедшего на титрование испытуемого раствора (мл);
К — поправка к титру раствора роданита аммония;
0,2 — количество испытуемого раствора (мл);
0,000585 —количество натрия хлорида, соответствующее 1 мл раствора роданита аммония (0,01 моль/л) (г);
100 — коэффициент пересчета в проценты.
г) Определение содержания аминного азота. Количество аминного азота является одним из основных показателей сред, так как именно в этой химической форме азот наиболее легко усваивается большинством микроорганизмов.
Содержание аминного азота определяют методом формольного титрования. Принцип метода основан на блокировании формальдегидом при pH 7,0 свободных аминогрупп и титровании щелочью эквивалентного количества карбоксильных групп. Начало и конец титрования определяют потенциомет-рически.
В стакан вместимостью 50 мл наливают необходимый объем (А) анализируемого раствора препарата, содержащего 1,5-5,0 мг аминного азота, и доводят общий объем дистиллированной водой до 20 мл. Электроды потенциометра (см. определение pH) погружают в исследуемый раствор, pH которого доводят до pH 7,0 при помощи раствора натрия гидроксида (0,1 моль/л) или раствора соляной кислоты (0,1 моль/л). Во время определения электроды должны все время оставаться погруженными в раствор. К нейтрализованному раствору добавляют 2 мл нейтрального формалина (pH которого перед каждым определением доводят до 7,0 10%-ным раствором натрия гидроксида), перемешивают и, не вынимая электродов, титруют содержимое раствором натрия гидроксида (0,1 моль/л) до 9,1.
Содержание аминного азота в исследуемом препарате в процентах (X) вычисляют по формуле:
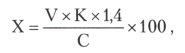
где V — количество раствора натрия гидроксида (0,1 моль/л) в мл, пошедшее на титрование испытуемой пробы от pH 7,0 до 9,1;
К — поправка к титру раствора натрия гидроксида (0,1 моль/л);
1,4 — количество аминного азота в мг, эквивалентное 1,0 мл раствора натрия гидроксида (0,1 моль/л);
С — анализируемая навеска сухого препарата в мг, содержащаяся в титруемом объеме А.
д) Определение стерильности сред. Стерильность — обязательный показатель, так как использованию подлежат только стерильные питательные среды, не содержащие посторонней микрофлоры.
Определение проводят визуально. Просматривают 3-5% каждой партии питательной среды и инкубируют в термостате при температуре 37 °С в течение 2-14 сут в зависимости от типа среды. Помутнение после инкубации жидкой (полужидкой) среды или появление на чашках Петри, в пробирках более 2-4 колоний свидетельствует о ее нестерильности, и вся исследуемая среда подлежит повторному контролю на удвоенном количестве образцов. При повторном подтверждении нестерильности среда подлежит уничтожению.
е) Определение прочности студня среды. В плотных питательных средах определяют также прочность студня, температуру плавления и застудневания среды.
Для культивирования микроорганизмов на поверхности агаризованных сред с целью выделения, хранения, изучения морфолого-культуральных признаков используют среды определенной прочности. При недостаточной, низкой прочности среды наблюдается «текучесть», не позволяющая производить посевы петлей или шпателем, а иногда делает невозможным и сам процесс культивирования.
В случае повышенной прочности студня массообменные процессы между микробными клетками и средой затрудняются, в результате чего снижается ее питательная ценность для микроорганизмов. Для плотных питательных сред предпочтительной прочностью для поверхностного культивирования микроорганизмов является 350±35 г.
Прочность студня среды. Этот показатель измеряется для сред по Валенту с использованием прибора Валента. Сущность метода заключается в определении массы нагрузки, необходимой для разрушения структуры образца. Для приготовления образца студня навеску агара заливают необходимым (по прописи среды) количеством дистиллированной воды и выдерживают для набухания 1ч, нагревают на водяной бане до полного расплавления агара и разливают в металлические стаканчики, которые охлаждают 1 ч при 20 °С.
После застывания агара образцы извлекают из стаканчиков и определяют прочность студня. С этой целью на поверхность студня опускают грибообразную насадку, находящуюся на нижнем конце подвижного вертикально расположенного штока. Нажимают на рычаг и сыпят песок из грузового стакана с отверстием в коническом дне в стакан для приемки груза до тех пор, пока насадка, прорвав студень, не пройдет через него. После этого взвешивают стакан для приема груза с имеющимся в нем песком (абсолютная погрешность должна быть не более 1 г) и рассчитывают прочность студия в граммах, равную массе песка, пошедшего на разрушение образца.
Температура плавления плотной агаризованной среды не должна быть ниже 80 °С, температура застудневания — не ниже 30 и не выше 37 °С. Эти свойства плотных сред позволяют использовать их для культивирования микроорганизмов, растущих при температурах от 36 до 40 °С.
- Читать далее "Методы оценки качества питательных сред по биологическим показателям"
Редактор: Искандер Милевски. Дата публикации: 20.05.2019
- Требования к питательным средам в микробиологии
- Способы стерилизации питательных сред в микробиологии
- Условия и сроки хранения питательных сред в микробиологии
- Методы определения сроков годности питательных сред в микробиологии
- Методы определения качества питательных сред по физико-химическим показателям
- Методы оценки качества питательных сред по биологическим показателям
- Производители коммерческих питательных сред по микробиологии и их виды
