Устойчивость стафилококков во внешней среде, к антибиотикам
Стафилококки довольно устойчивы к действию факторов внешней среды, колебаниям температуры, высушиванию, действию УФ-лучей, с чем связана их способность длительно сохраняться на предметах больничной обстановки и выживать в условиях стационара. В экспериментальных условиях показано, что многие виды способны расти в присутствии высоких концентраций в среде NaCl (до 10 %—15 %) или 40% желчи, при температуре в пределах от 6,5°С до 46°С, при pH 4,2-9,3. Свою жизнеспособность микробные клетки способны сохранять при нагревании до 95°С в течение 15 мин.
Некоторые штаммы S. aureus, S. lugdunensis, S. epidermidis и S. saprophyticus проявляют устойчивость к различным комбинациям тяжелых ионов: кадмию, цинку, висмуту, ртути а также ионам мышьяка и аммония. Гены, контролирующие устойчивость к тяжелым металлам, локализованы на плазмидах и транспозонах, но могут быть интегрированы в хромосому в составе указанных мобильных генетических элементов. Устойчивость к ионам тяжелых металлов и аммонию позволяет стафилококкам успешно противостоять действию целого ряда дезинфицирующих средств.
Стафилококки способны приобретать устойчивость практически ко всем антимикробным препаратам, вводимым в лечебную практику. Уже через несколько лет после начала широкого использования пенициллина в 40-х годах прошлого века появились сообщения о выделении пенициллин-резистентных изолятов S. aureus. Последующее введение в лечебную практику стрептомицина, эритромицина, тетрациклина привело к появлению штаммов, устойчивых и к этим антибиотикам, и формированию к началу 60-х годов изолятов, резистентных одновременно к нескольким антимикробным препаратам. Первый полусинтетический пенициллин — метициллин, устойчивый к действию стафилококковой β-лактамазы, предназначался для лечения инфекций, вызванных пенициллин-резистентными штаммами.
Предполагали, что с его помощью удастся решить проблему стафилококковых инфекций. Однако менее чем через два года после введения этого препарата появились первые сообщения о выделении метициллин-резистентных штаммов золотистого стафилококка, сокращенно называемых MRSA (от английского methicillin-resistant Staphylococcus aureus). Они сделались проблемой для специалистов к середине 70-х — началу 80-х годов прошлого века, когда стало очевидным, что, обладая всеми характерными морфологическими, культуральными, и биохимическими свойствами, характерными для золотистого стафилококка, MRSA имеют свои особенности. Несмотря на то, что впоследствии метициллин был заменен менее токсичными антибиотиками этой группы, такими как оксациллин и диклоксациллин, термин MRSA прочно закрепился в научной литературе.
Нарастающая резистентность S. aureus к антимикробным препаратам, так же как и коагулазонегативных стафилококков, представляет большую клиническую проблему, поскольку снижает эффективность и существенно осложняет лечение стафилококковой инфекции.
Механизмы формирования резистентности к антимикробным препаратам у стафилококков можно классифицировать на две категории: мутации в расположенных на хромосоме бактериальных генах и приобретение генов резистентности от других микроорганизмов с помощью различных видов генетического обмена (трансдукции, трансформации, плазмидно- и фагово-опосредованной конъюгации). В случаях передачи резистентности экзогенные гены, детерминирующие устойчивость к антибиотикам, находятся на мобильных генетических элементах: плазмидах, инсерционных последовательностях, транспозонах, или геномных островах.
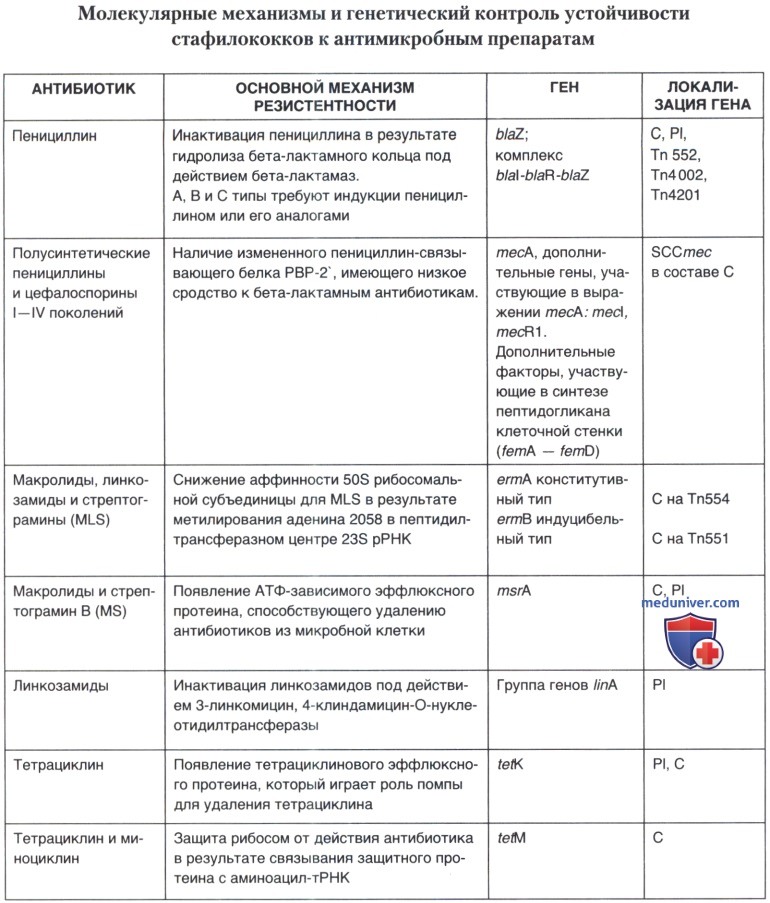
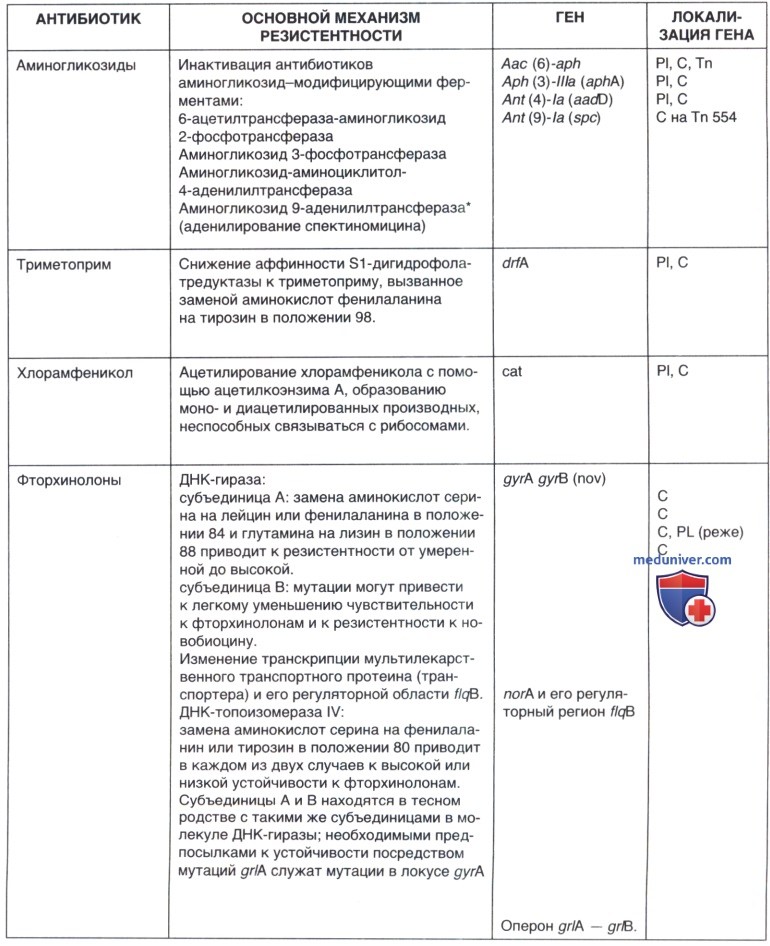
Не имея возможности подробно рассмотреть механизмы резистентности стафилококков к антимикробным препаратам, мы представили эти данные в виде таблицы, позволив себе сконцентрировать внимание на особенностях фенотипической экспрессии устойчивости к метициллину/оксациллину, на некоторых новых фактах о клинической эффективности и механизмах резистентности к препаратам выбора при лечении инфекций, вызванных метициллин-резистентными штаммами стафилококков.
а) Особенности устойчивости стафилококка к метициллину/оксациллину. Уникальность метициллин-резистентности заключается в существовании феномена гетерорезистентности, суть которого состоит в том, что в условиях инкубации при 37°С не все клетки популяции фенотипически проявляют устойчивость к оксациллину. Генетический контроль феномена гетерорезистентности до настоящего времени полностью не расшифрован. Известно только, что на экспрессию устойчивости могут влиять регуляторные гены (Глактамазы, а также ряд дополнительных генов. Сложность регуляции проявляется в фенотипических различиях. Выделяют 4 стабильных фенотипа (класса) резистентности. Первые три класса являются гетерогенными.
Это означает, что в популяциях стафилококков, относящихся к этим классам, присутствуют субпопуляции микробных клеток с разным уровнем резистентности. При этом клоны стафилококков, получаемые из изолированных колоний (образовавшихся при рассеве первичной культуры) по популяционному составу полностью совпадают с исходной культурой.
Класс 1. Рост 99,99% клеток подавляется оксациллином в концентрации 1,5-2 мкг/мл, рост 0,01 % микробов подавляется только при 25,0 мкг/мл.
Класс 2. Рост 99,9% клеток подавляется при концентрации оксациллина 6,0-12,0 мкг/мл, тогда как рост 0,1% микробов подавляется при концентрации > 25,0 мкг/мл.
Класс 3. Рост 99,0-99,9% клеток подавляется при концентрации 50,0—200,0 мкг/мл и только рост 0,1-1% микробной популяции подавляется при концентрации оксациллина 400,0 мкг/мл.
Класс 4. Представители этого класса характеризуются гомогенным уровнем устойчивости, который превышает 400,0 мкг/мл для всей популяции.
Высокий уровень резистентности, по-видимому, возникает в силу действия множества различных механизмов, из которых в настоящее время идентифицированы только несколько. Эксперименты по изучению инсерционной инактивации устойчивости к метициллину привели к идентификации группы генов, локализованных в различных частях хромосомы S. aureus, вне SCCmec, первоначально названных факторами, существенными для экспрессии устойчивости к метициллину, или fem (factors essential for methicillin resistance). Эти факторы, как показали дальнейшие исследования, оказались генами общего метаболизма, присутствующими в хромосоме всех штаммов S. aureus дикого типа. Их активность является критической для экспрессии резистентности. В настоящее время число этих генов превышает 20.
Многие из них играют прямую или опосредованную роль в процессах биосинтеза и утилизации пептидогликана или же выполняют регуляторные функции. Однако ни один из них не влияет на экспрессию пенициллиносвязывающего белка РВР-2 (см. ниже). Наибольшее влияние на резистентность оказывают мутации в генах fmhB, femA и femB, принадлежащих к уникальной группе генов, которые синтезируют боковые ветви в структуре пептидогликана как у S. aureus, так и у других грамположительных микроорганизмов.
Являясь существенным компонентом клеточной стенки стафилококка, тейхоевые кислоты также влияют на устойчивость к метициллину. Посредством изменения своего заряда тейхоевые кислоты контролируют аутолитическую активность и концентрацию ионов магния внутри клетки. Инактивация оперона dlt, вовлеченного в транспорт d-аланина, и нарушение включения данной аминокислоты в состав тейхоевых кислот, увеличивает устойчивость к оксациллину в результате изменений метаболизма клеточной стенки и, как следствие, снижения аутолитической активности. На уровень резистентности влияет и ряд внешних факторов, таких как температура, осмотическое давление, доступность дивалентных ионов, состав питательной среды. Это находит свое отражение в рутинных тестах при идентификации метициллинрезистентности и требует добавления NaCl в питательную среду и снижения температуры инкубации для ее лучшей экспрессии. Именно наличием гетерорезистентности по устойчивости к оксациллину и обусловлены трудности при идентификации MRSA микробиологическими методами.
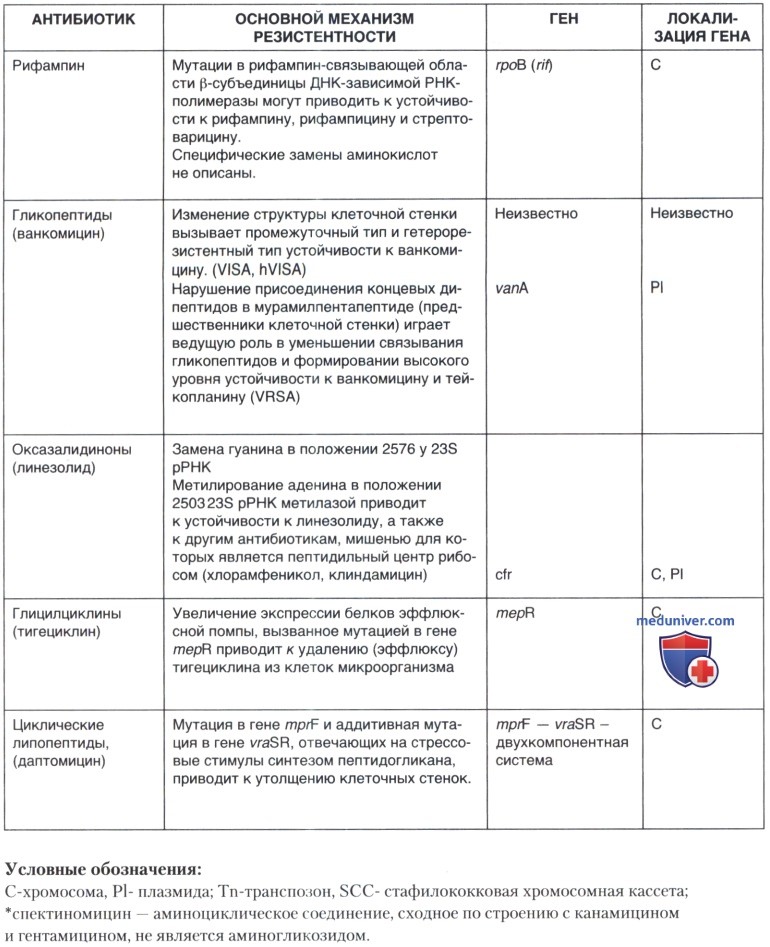
б) Резистентность к ванкомицину. Гликопептидные антибиотики ванкомицин и тейкопланин обладают бактерицидным действием в отношении стафилококков. Взаимодействуя с пептидил-D-аланил-D-аланиновым окончанием предшественников пептидокликана, они препятствуют этапам гликозилирования и транспептидации и тем самым нарушают синтез пептидогликана клеточной стенки. Различия в механизме действия позволяют их использовать для лечения тяжелых инфекций, вызванных стафилококками, устойчивыми к действию бета-лактамов. Однако необходимо иметь в виду, что у этой группы препаратов бактерицидный эффект наступает значительно позднее, а клиническая эффективность существенно ниже, чем у антибиотиков из группы бета-лактамов, и потому их нецелесообразно использовать для лечения заболеваний, вызванных штаммами, чувствительными к действию бета-лактамных антибиотиков.
До недавнего времени выделяли три категории резистентности S. aureus к ванкомицину:
1. S. aureus с промежуточным уровнем резистентности — VISA (сокр. от англ. intermediate-level resistant to vancomycin);
2. S. aureus с гетерогенным типом резистентности — hVISA (сокр. от англ, heteroreistant to vancomycin);
3. S. aureus ванкомицин-резистентный — VRSA (сокр. от vancomycin-resistant S. aureus).
C 1997 г., согласно критериям NCCLS (National Committee for Clinical Laboratory Standards — США), к ванкомицин-резистентным относили штаммы, для которых минимальная ингибирующая концентрация (МИК) составляла >32 мкг/мл. Таких штаммов к настоящему времени во всем мире выделено всего 12, в большинстве случаев от пациентов в США. Вначале к категории hVISA были отнесены штаммы, в популяции которых обнаруживались единичные микробные клетки, способные расти на среде с содержанием ванкомицина от 8 до 16 мкг/мл. К категории VISA были отнесены штаммы, способные расти на среде с 4 мкг/мл антибиотика. Однако отсутствие клинической эффективности при лечении ванкомицином некоторых пациентов заставило американских и европейских экспертов пересмотреть эти критерии.
Согласно новым критериям EUCAST {англ. The European Committee on Antimicrobial Susceptibility Testing) 2010 г., к VRSA следует относить штаммы с уровнем резистентности 4 и более мкг/мл, а согласно CLSI {англ. Clinical Laboratory Standards Institute), преемницы NCCLS, к категории VRSA следует относить штаммы с уровнем устойчивости 2 мкг/мл и более. Именно эту концентрацию антибиотика необходимо считать пограничной, т. к. при выделении штаммов с таким уровнем устойчивости получить клинический эффект при лечении ванкомицином, как правило, не удается.
в) Механизмы резистентности к линезолиду, даптомицину и тигециклину. За последние 20 лет только три новых антибиотика были созданы для лечения инфекций, вызванных MRSA. Это линезолид, препарат из группы оксазолидинонов, циклический липопептид — даптомицин, а также препарат из группы глицилциклинов — тигециклин. Все препараты зарегистрированы в РФ. Однако, несмотря на ограниченное использование этих антибиотиков, уже описаны клинические изоляты S. aureus, устойчивые к этим препаратам, и расшифрованы некоторые механизмы резистентности. Представитель группы оксазолидинонов линезолид — антибиотик, полностью синтезированный химическим путем. Основным механизмом действия линезолида является взаимодействие с пептидил-трансферазным центром рибосом и блокирование синтеза белка микробной клеткой. Полагали, что полная синтетическая структура препарата будет препятствовать появлению резистентных штаммов. Однако уже идентифицированы несколько механизмов резистентности S. aureus к этому препарату.
Один из них детерминирован мутацией, приводящей к изменению структуры мишени в результате замены гуанина в положении 2576 у 23S рРНК.
Другой механизм резистентности обусловлен геном cfr, кодирующим cfr-метилтрансферазу, метилирующую аденин в позиции 2503 в 23S рРНК в большой субъединице рибосомы. Этот механизм резистентности обеспечивает устойчивость и к другим препаратам, которые реагируют с пептидил-трансферазным центром большой субъединицы рибосомы, в том числе к фениколам (хлорамфеникол, флорфеникол), линкозамидам (клиндамицин). Ген расположен на плазмиде pSCF1, кодирующей дополнительно устойчивость к макролидам, линкозамидам и стрептограмину, которая способна передаваться между различными видами стафилококка. Появление плазмиды, кодирующей устойчивость сразу к нескольким классам антимикробных препаратов — как природных, так и синтетических — вызывает наибольшую тревогу у специалистов.
Идентифицированный в настоящее время механизм резистентности к тигециклину обусловлен активацией выброса (эффлюкса) антибиотика из микробной клетки. Механизм резистентности к даптомицину обусловлен утолщением клеточной стенки и в чем-то сходен с механизмами резистентности к ванкомицину. Показано, что изоляты S. aureus со сниженной чувствительностью к ванкомицину, менее чувствительны и к даптомицину.
- Читать далее "Факторы патогенности стафилококков (Staphylococcus)"
Редактор: Искандер Милевски. Дата публикации: 10.3.2020
- Род Staphylococcus: представители, характеристика бактерий
- Морфологические, культуральные, биохимические свойства стафилококков (Staphylococcus)
- Устойчивость стафилококков во внешней среде, к антибиотикам
- Факторы патогенности стафилококков (Staphylococcus)
- Генетические особенности стафилококков (Staphylococcus)
- Внутривидовая дифференциация Staphylococcus aureus и других видов стафилококка
- Экспериментальные модели стафилококковой инфекции
- Клиника стафилококковой инфекции
- Эпидемиология стафилококковой инфекции
- Лабораторная диагностика стафилококковой инфекции
- Профилактика и лечение стафилококковых инфекций
