Пути торможения окисления. Оценка антиоксидантной активности (АОА)
Тормозящее действие различных добавок при окислении может быть обусловлено двумя типами реакций: вещество либо непосредственно реагирует с перекиспыми радикалами, умеьшая их концентрацию, либо разрушает гидроперекись, являющуюся разветвляющим агентом (реакция 3). По первому пути действуют, как правило, вещества, имеющие подвижный атом водорода и условно обозначаемые InH, например, фетголы и амины. По второму пути реагируют многие серосодержащие органические соединения (меркамии, цистеин, диалкилсульфиды, комплексы металлов переменной валентности и др.). В этом разделе действие таких соединений рассматриваться не будет.
Ингибитор, введенный в среду окисления, реагирует с перекиспыми радикалами по реакции:
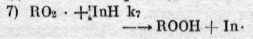
В общей схеме окислепия углеводородов необходимо учитывать реакции, в которые вступает радикал In-, образовавшийся из молекулы ингибитора:

Тормозящее действие ингибитора зависит от двух обстоятельств: от скорости реакции взаимодействия переписных радикалов с ингибиторами по реакции 7 и от активпости радикалов, образующихся из молекул ингибиторов (чем менее активен радикал In-, тем сильнее эффект торможения).
Относительная активность радикала In определяется соотношением констант скоростей к10/к2 реакций продолжения цепей 10 и 2. Чем меньше это соотношение, тем сильпее тормозящее действие ингибитора.
При достаточно большой концентрации ингибитора, при которой все радикалы RО2 будут реагировать с ингибитором, приводя к образованию радикала In-, активность ипгибитора будет определяться скоростью реакции 10.
Ингибитор, из которого образуются неактивные радикалы (к10/к2 очень мало), способен практически остановить реакцию и, по определению Е. Т. Денисова, его следует считать сильным. Если радикал способеп продолжать реакцию (0,1 <к10/к2<1), то цепная реакция в присутствии ингибитора будот протекать, но с меньшей скоростью. Ингибитор, введение которого даже в большой концентрации не останавливает реакцию, а лишь замедляет ее, следует считать слабым.

Таким образом, антиокислительная активность является сложной величиной и определяется, вообще говоря, соотношением скоростей реакции с 1 по 10. Если сравнение активности соединений проводится на одной и той же модели и в одинаковых условиях, то активность соединений определяется скоростями следующих реакций:
1) скоростью реакции обрыва цепи окисления на молекулах ингибитора (7), в которой в большей или меньшей степени происходит замена роакционноспособного порекисного радикала на малоактивный радикал.
Величина константы скорости этой реакции характеризует способность веществ реагировать со свободными радикалами, т. е. их антирадикальную активность;
2) участием радикала In- в реакции продолжения цепи (10) и соотношением констант скоростей реакций 10 и 2 (k10/ka);
3) способностью ипгибитора или его радикала реагировать с гидроперекисью без образования свободных радикалов.
Ни один из этих факторов в отдельности не может характеризовать в целом величину антиокислительной активности.
Мы хотели бы остановиться па сопоставлении значений антиокислительной и антирадикальной активности соединений. Безусловно, эти величины могут быть связаны друг с другом. Из двух соединений большей антирадикалыюй активностью обладает соединение, имеющее более высокую константу к7. Чем выше значение к7, тем выше будет и величина антиокислительной активности этого соединения, если активность радикалов In, образующихся из молекул этих соединений, одинакова.
Если же активность радикалов In- различна, то увеличение значений к7 может и не перекрыть снижения антиокислительной активности из-за протекания реакции 10.
Таким образом, антирадикальная активность характеризует способность соединений реагировать со свободными радикалами, а антиокислительная активность определяет способность этих соединений тормозить процесс окисления в целом.
- Читать "Определение антиокислительной активности (АОА) веществ. Определение активности липидов"
Оглавление темы "Оценка антиокислительной активности антиоксидантов в онкологии":- Антиоксиданты. Что такое антиоксиданты?
- Общая антиокислительная активность (АОА). Антиокислительная активность липидов
- Пути торможения окисления. Оценка антиоксидантной активности (АОА)
- Определение антиокислительной активности (АОА) веществ. Определение активности липидов
- Окисление метилового эфира олеиновой кислоты. Влияние температуры на антиоксиданты
- Методы хемилюминесценции для оценки антиоксидантной активности (АОА). Метод инициированного окисления углеводородов
- Методы электрохемилюминесценции (ЭХЛ). Значение ЭХЛ в определении антиоксидантной активности (АОА)
- Модель окисленной олеиновой кислоты. Влияние антиоксидантов на окисление олеиновой кислоты
- Изучение процесса окисления липидов. Окисление ненасыщенных жирных кислот
- Определение активности липидов по методу Глевинда. Различия антиокислительной и антирадикальной активности
