Классификация психоактивных препаратов по нейромедиаторным системам
Люди использовали психоактивные препараты в терапевтических и рекреационных целях практически с того момента, как стали людьми. Наши ближайшие родственники, в том числе шимпанзе, бонобо и гориллы, целенаправленно ищут и вдыхают или наносят на кожу вещества, позволяющие предупредить или уменьшить вредные эффекты патогенов и токсинов.
Такое поведение называют зоофармакогнозией (от слов «животное» + «лекарство» + «знание») (Kapadia et al., 2014). Человеку удалось сделать шаг вперед, научившись культивировать определенные растения и грибы, а также экстрагировать, очищать, исследовать и синтезировать их психоактивные компоненты. Люди сумели извлечь из этого большую пользу. Со временем человечеству удалось получить огромное количество психоактивных препаратов. Большинство таких препаратов имеет природное происхождение (Campbell, 1996).
Создать универсальную классификацию психоактивных препаратов практически невозможно. Любая из существующих классификаций имеет ряд ограничений, поскольку препараты со схожей химической структурой могут оказывать разный эффект, а препараты с разной структурой действовать одинаково. Кроме того, один и тот же препарат воздействует на множество нейрохимических систем, вызывая различные эффекты.
Для понимания действия любого лекарства необходимо подробное описание, как в медицинских справочниках. Описания поведенческих аспектов применения препаратов подлежат постоянному пересмотру, что находит отражение в новых изданиях Диагностического и статистического руководства по психическим расстройствам (DSM). Разработанное Американской психиатрической ассоциацией и на текущий момент выдержавшее пять изданий DSM предлагает систему классификации неврологических и поведенческих расстройств, в том числе вызванных применением определенных препаратов.
В статье на сайте мы объединили психоактивные препараты в группы в соответствии с нейромедиаторными системами, на которые они преимущественно воздействуют, по тому же принципу, что и нейромедиаторные системы, рассмотренные в отдельной статье на сайте - просим пользоваться формой поиска выше. Конечно, наша система классификации тоже имеет определенные ограничения. Подавляющее большинство назначаемых в терапевтических целях препаратов не предназначено для воздействия на специфическую нейромедиаторную систему; препараты были протестированы на различных группах пациентов, а их применение для лечения определенных заболеваний было одобрено на основании анализа их эффективности.
В таблице 1 приведена классификация психоактивных препаратов по нейромедиаторным системам, на которые они воздействуют. В каждую группу может входить как несколько веществ, так и несколько тысяч веществ. В последующих разделах мы рассмотрим действие препаратов на нейрохимические системы мозга и синаптическую передачу. Следует отметить, что многие назначаемые в терапевтических целях препараты также используются в рекреационных целях и ими могут злоупотреблять.
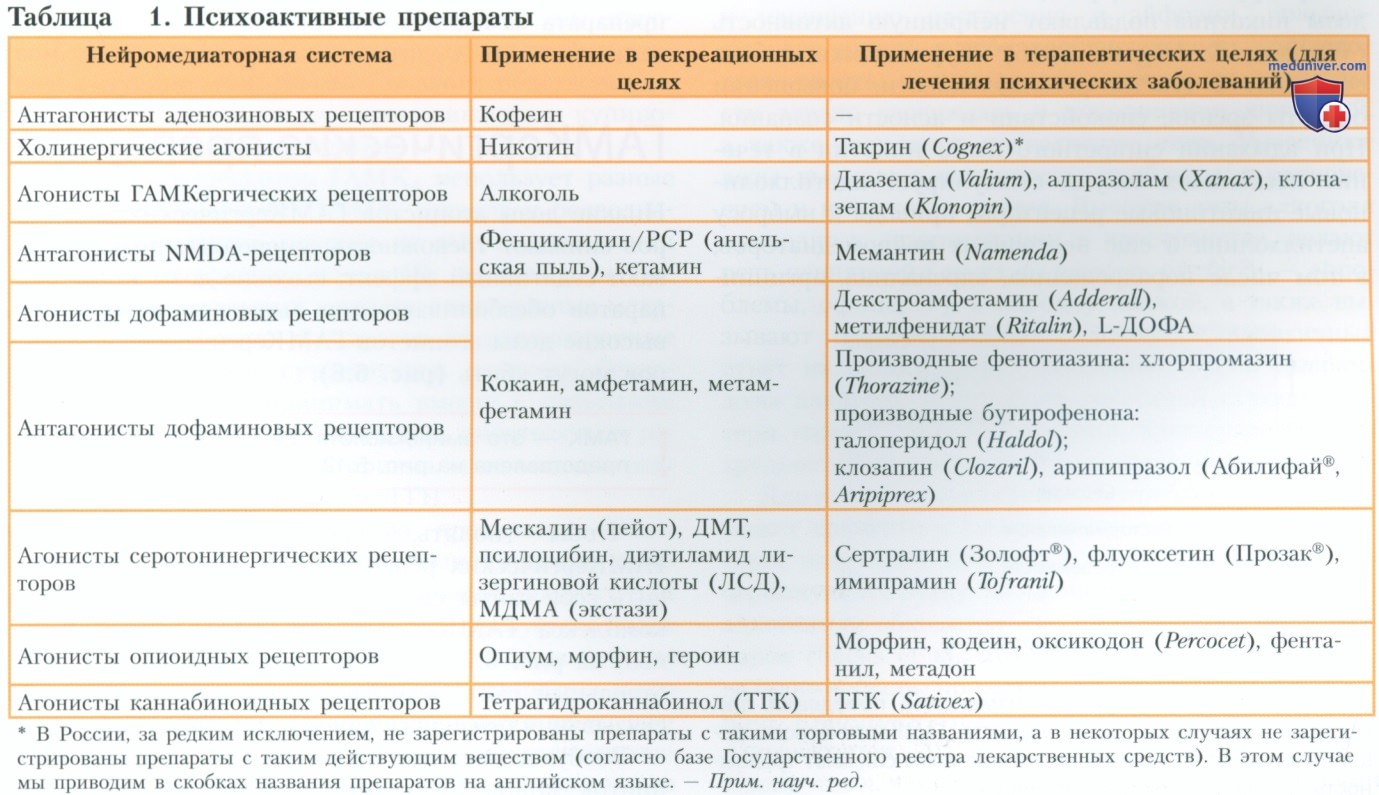
Многие психоактивные препараты имеют три названия — название действующего вещества, международное непатентованное название и торговое название. Название действующего вещества описывает химическую структуру препарата; международное непатентованное название не является объектом интеллектуальной собственности, его записывают строчными буквами; являющееся объектом интеллектуальной собственности торговое название, которое присваивает препарату изготавливающая его фармацевтическая компания, начинается с заглавной буквы. У некоторых психоактивных веществ также есть «народные» названия.
а) Аденозинергические препараты. Давайте начнем с самого активно употребляемого психоактивного вещества в мире — кофеина. Примерно 85% взрослого населения США ежедневно употребляют кофеинсодержащие напитки, такие как кофе, чай, тонизирующие и энергетические напитки. Одна чашка кофе содержит около 100 мг кофеина; большинство распространенных тонизирующих напитков содержат примерно столько же; в некоторых энергетических напитках может быть до 500 мг кофеина. Возможно, вы употребляете больше кофеина, чем можете себе представить.
По своей структуре кофеин очень похож на аденозин, поэтому он связывается с аденозиновыми рецепторами, вызывая их активацию. Таким образом, он блокирует эффект аденозина, выступая в роли антагониста аденозиновых рецепторов. Эндогенный аденозин вызывает сонливость, а кофеин оказывает противоположное воздействие, заставляя нас чувствовать себя бодрее. Чрезмерная доза кофеина может вызвать дрожь в конечностях. Однако кофеин оказывает и другие эффекты — он ингибирует фермент, который обычно расщепляет вторичный мессенджер, циклический аденозинмонофосфат (цАМФ).
Связанное с этим повышение уровня цАМФ приводит к повышению выработки глюкозы, увеличивая запас энергии и ускоряя клеточные процессы. Кофеин также способствует высвобождению других нейромедиаторов, таких как дофамин и ацетилхолин. Этим обусловлено стимулирующее действие кофеина, которое увеличивает быстроту реакций, обеспечивает бодрость, улучшает концентрацию и координацию движений (Nehlig, 2010).
Ежедневное употребление кофеина приводит к формированию зависимости. Когда человек отказывается от кофеина, у него появляются такие симптомы, как сонливость, головная боль и раздражительность. Таких симптомов синдрома отмены можно избежать, продолжив ежедневно употреблять кофеин. Следует отметить, что при отказе от кофеина указанные симптомы постепенно сходят на нет (в течение 4-7 дней).
Самым известным источником кофеина являются плоды (с 1-3 семенами внутри) кофейного дерева. Однако кофеин также содержится в семенах, орехах, листьях и нектаре некоторых других растений, произрастающих в Восточной Азии и Южной Америке.
Зачем некоторые растения насыщают свои ткани кофеином? Чтобы правильно ответить на этот вопрос, нам нужно проанализировать жизнь растения.
Растение сталкивается с множеством проблем, таких как поедание травоядными животными, воздействие патогенов (в том числе грибов) и необходимость привлечения опылителей. Указанные факторы в сочетании с многими другими факторами привели к появлению различных адаптаций. Одной из таких адаптаций стало насыщение тканей растения токсинами, в том числе кофеином. Кофеин действует как природный пестицид, который отпугивает или убивает насекомых-вредителей и ингибирует рост патогенных грибов. Содержащий кофеин нектар способствует более высокой активности опылителей, в том числе пчел, улучшая распространение пыльцы (Wright et al., 2013). Человек внес огромный вклад в культивирование кофейного дерева и чайного куста, широко распространив их по планете в ущерб аборигенным видам растений и животных, а также аборигенным экосистемам.
б) Холинергические препараты. Никотин содержится в листьях табака (Nicotiana tabacum). Как и кофеин, он действует как репеллент — в свое время никотин широко использовали в качестве инсектицида. В малых количествах никотин также присутствует в картофеле, томатах и баклажанах.
Способность никотина влиять на настроение отличает его от большинства других психоактивных веществ. Низкие дозы никотина оказывают стимулирующий эффект, однако очень высокие дозы никотина подавляют нейронную активность (Wadgave & Nagesh, 2016). Курильщики табака сообщают о чувстве расслабленности, повышении остроты зрения, спокойствии и ясности сознания. При вдыхании сигаретного дыма никотин в течение нескольких секунд стимулирует ацетилхолиновые никотиновые рецепторы, приводя к выбросу ацетилхолина и еще нескольких нейромедиаторов, в том числе норадреналина, адреналина, аргинин-вазопрессина, серотонина, эндорфинов и дофамина. Именно высвобождение дофамина обеспечивает усиление тяги к никотину.
Никотиновая зависимость обусловлена как психологическими, так и физиологическими факторами. Отказ от курения приводит к повышенной тревожности, раздражительности, повышенному аппетиту, неспособности испытывать удовольствие и тремору.
Никотин представляет собой смертельный яд; инъекция содержащегося в одной сигарете никотина не имеющему опыта его употребления человеку может привести к летальному исходу. Однако толерантность к никотину возникает быстро, поэтому курильщики со стажем способны выдерживать гораздо более высокие дозы вещества. Респираторные заболевания, рак легких и другие негативные последствия курения в большей степени связаны с воздействием присутствующих в табачном дыме опасных веществ, а не с воздействием самого никотина. Этот факт лежит в основе популярности вейпинга, позволяющего вдыхать никотин без табачного дыма. Долгосрочные последствия курения электронных сигарет, по-видимому, являются менее тяжелыми, чем последствия курения табака, однако пока они изучены недостаточно.
Хотя курение является фактором риска развития болезни Альцгеймера, агонисты холинергических рецепторов применяют для лечения этого заболевания. Ингибиторы ацетилхолинестеразы, такие как такрин (Cognex), повышают уровень ацетилхолина и могут способствовать небольшому улучшению состояния пациента (Birks et al., 2015). Следует отметить, что доказательств способности какого-либо препарата замедлить или остановить прогрессирование болезни Альцгеймера не существует.
в) ГАМКергические препараты. Низкие дозы агонистов ГАМКергических рецепторов снижают тревожность; умеренные дозы оказывают седативный эффект; высокие дозы таких препаратов обезболивают или вызывают кому. Очень высокие дозы агонистов ГАМКергических рецепторов могут убить (рис. 1).
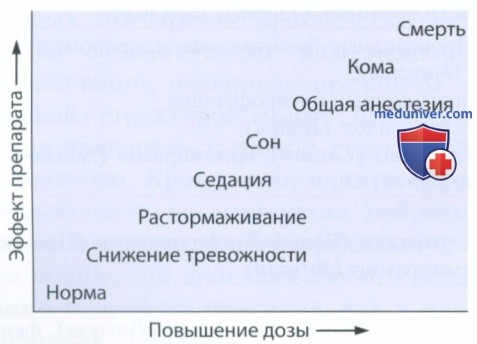
Чтобы понять, как работают агонисты ГАМКергических рецепторов, нам следует представить себе сайты связывания и канал рецепторного комплекса ГАМКA . Рецептор ГАМКA изображенный на рис. 2, содержит сайт связывания ГАМК, отдельный сайт связывания молекул этанола, сайт связывания бензодиазепинов и хлорный канал (Cl-).
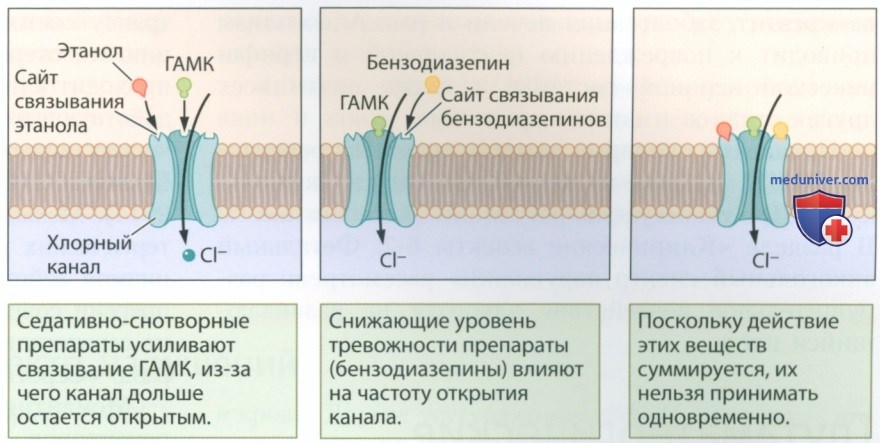
Возбуждение рецептора ГАМКA обеспечивает приток ионов Cl- через соответствующий канал.
Приток ионов Cl- способствует росту отрицательного заряда на внутренней стороне клеточной мембраны, гиперполяризации мембраны и менее активному распространению потенциала действия. Таким образом, ГАМК оказывает ингибирующий эффект, снижая уровень возбуждения нейрона. Снижение возбуждения большого числа нейронов лежит в основе поведенческих эффектов препаратов, воздействующих на синапс ГАМКA.
Бензодиазепины — это класс веществ, к которому относятся диазепам (Valium), алпразолам (Xanax) и клоназепам (Klonopin), назначаемые для снижения тревожности. Бензодиазепины часто принимают люди, которым трудно справиться со значительным физическим и психическим стрессом, например возникшим в результате травмирующей ситуации или смерти близкого родственника. Их также применяют для премедикации и купирования судорожных приступов.
Поскольку рецептор ГАМКA использует разные сайты для связывания ГАМК, этанола и бензодиазепинов, активация каждого из сайтов связывания способствует притоку ионов Cl-, однако в основе связывания указанных веществ лежат разные механизмы. Воздействие препаратов на рассмотренные сайты связывания суммируется, поэтому бензодиазепины нельзя принимать вместе с алкоголем. Известно, что в США ежегодная смертность в результате одновременного приема этих веществ равна ежегодной смертности в ДТП.
Характерной особенностью препаратов бензодиазепинового ряда является возникновение толерантности при многократном приеме, поэтому для достижения желаемого эффекта требуется более высокая доза. Кросс толерантность возникает, когда толерантность к одному препарату, например к одному из препаратов бензодиазепинового ряда, распространяется на другой препарат из соответствующей группы. Существование кросс толерантности также позволяет объяснить схожее воздействие бензодиазепинов и алкоголя на нервную систему.
Присутствующий в алкогольных напитках алкоголь (этиловый спирт, или этанол) является невероятно популярным психоактивным веществом, которое используют в рекреационных целях. Он особенно популярен среди студентов колледжей. Ферментация сахара для получения этилового спирта является древнейшим из используемых человеком биотехнологических процессов — ее начали применять около 9000 лет назад. Употребление алкоголя вызывает краткосрочные психологические и физиологические эффекты, которые зависят от нескольких факторов, в том числе от дозы алкоголя и концентрации этилового спирта, продолжительности употребления алкоголя, количества съеденной пищи, а также массы тела потребителя и его алкогольного опыта.
Малые дозы алкоголя обычно приводят к улучшению настроения и эйфории, повышают уверенность в себе и общительность, снижают тревожность, негативно сказываются на способности здраво рассуждать и координации движений, а также вызывают покраснение лица. Умеренные дозы вызывают сонливость, проблемы с равновесием и нечеткость зрения. Высокие дозы алкоголя приводят к дезориентации в пространстве, делают речь невнятной («wats da proplem, ossifer?» — «проблемы, офицер?»), а походку шаткой, а также вызывают головокружение и рвоту — адаптивный ответ на алкогольное отравление. Очень высокие дозы алкоголя могут стать причиной ступора, потери памяти, потери сознания, жизнеугрожающих трудностей с дыханием и вдыхания рвотных масс.
Длительное регулярное употребление алкоголя может привести к алкоголизму — заболеванию, которое разрушает личность и семью, а также создает огромную нагрузку на экономику; только в США алкоголизм обходится государству в 249 млрд долларов (Sacks et al., 2015). В 2015 г. в США алкоголиками были признаны 8% мужчин и 4% женщин (Substance Abuse and Mental Health Services Administration, 2015). Алкоголики часто недоедают. Кроме того, у них чаще встречаются хронический панкреатит, заболевания печени и рак. Алкоголизм приводит к повреждению центральной и периферической нервной системы, а также почти всех других органов и систем организма.
Препараты, которые воздействуют на рецепторы ГАМК, влияют и на развитие мозга, поскольку ГАМК участвует в регуляции развития мозга. Ниже рассмотрено разрушительное воздействие алкоголя на развивающийся плод.
1. Клинические аспекты. Фетальный алкогольный спектр нарушений. Термин «фетальный алкогольный синдром» (ФАС) был предложен в 1973 г., чтобы описать врожденные физические и психические дефекты, наблюдаемые у детей, рожденных злоупотребляющими алкоголем матерями. Теперь такие дефекты называют фетальным алкогольным спектром нарушений (ФАСН). У детей с ФАСН встречаются лицевые аномалии, в том числе слишком широко расставленные глаза. Мозг таких детей имеет целый ряд аномалий, от мозга малых размеров с дефектными извилинами до аномальных клеточных кластеров и нарушения клеточной структуры коры больших полушарий.
С указанными мозговыми аномалиями связаны определенные поведенческие симптомы, свойственные большинству детей с ФАСН. У таких детей наблюдаются различные трудности с обучением и низкий уровень интеллекта, а также гиперактивность и прочие социальные проблемы. Люди с ФАСН в 19 раз чаще попадают в тюрьму, чем люди без ФАСН (Popova et al., 2011).
Было проведено множество исследований, посвященных оценке заболеваемости ФАСН в США, результаты которых показали, что заболеваемость может составлять 1-10% или более, поскольку показатели заболеваемости для разных сообществ различаются и не подлежат обобщению.
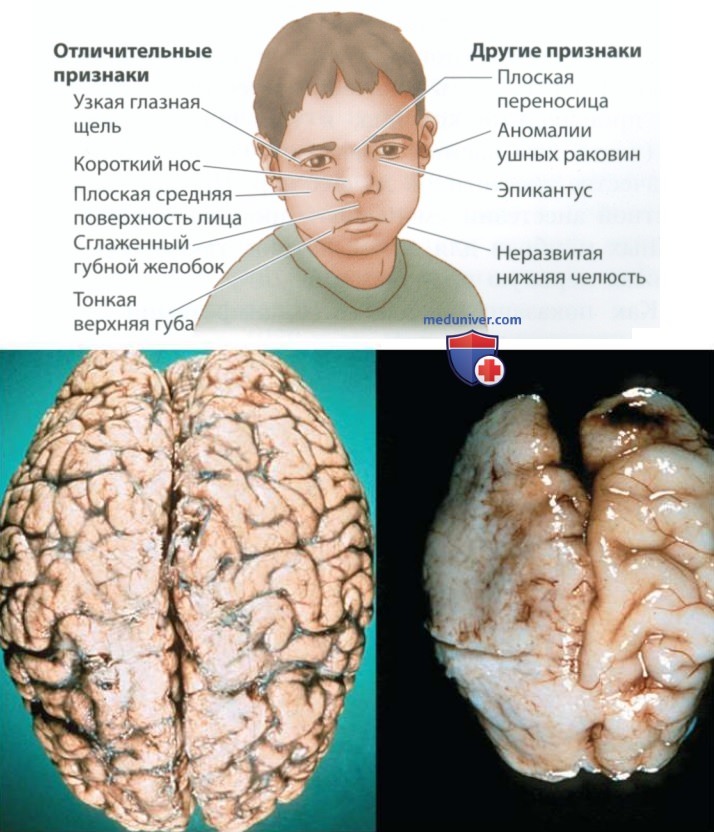
Внизу: извилины мозга здорового ребенка в возрасте 6 месяцев (слева) и недоразвитые извилины мозга ребенка с ФАСН (справа)
Женщины с наиболее высоким риском рождения детей с ФАСН — это женщины малообразованные, с низким уровнем доходов, их проблемы с алкоголем начинаются до беременности, и у них нет доступа к качественной медицинской помощи. Зачастую бывает трудно разъяснить этим женщинам, насколько опасно употребление алкоголя для плода, чтобы убедить их воздерживаться от принятия алкоголя до и во время беременности.
Вызванные употреблением алкоголя аномалии варьируют от еле заметных физических и психических нарушений до выраженного ФАСН. Выраженность симптома коррелирует с количеством и частотой употребления алкоголя во время беременности. Тяжесть симптомов выше в том случае, если употребление алкоголя пришлось на первый триместр беременности, во время которого происходят органогенез и интенсивный синтез ДНК. Риски усугубляются тем, что многие женщины на этом этапе еще не знают, что беременны.
Тяжелая форма ФАСН чаще всего связана с алкоголизмом и постоянным высоким уровнем алкоголя в крови. Другие усугубляющие ФАСН факторы — это плохое питание матери и употребление матерью других психоактивных веществ, в том числе никотина. Следует отметить, что употребление алкоголя матерью и отцом до зачатия может приводить к метилированию некоторых генов, что также влияет на тяжесть симптомов ФАСН (Lee et al., 2015).
Основной связанный с ФАСН вопрос состоит в том, сколько алкоголя можно выпить во время беременности. Чтобы полностью обезопасить себя, лучше всего воздерживаться от употребления алкоголя в течение нескольких месяцев до беременности и во время беременности. В пользу этого утверждения говорит информация о том, что одна порция алкоголя в день во время беременности приводит к снижению интеллекта у ребенка.
г) Глутаматергические препараты. В состав глутаматергической системы входит несколько рецепторов — в том числе NMDA-рецепторы, АМРА-рецепторы и каинатные рецепторы. Антагонисты NMDА-рецепторов, такие как фенциклидин (1-(1-фенилциклогексил)-пиперидин, или ангельская пыль) и кетамин, могут вызывать галлюцинации и эффект «выхода из тела». Исследования показали, что фенциклидин ингибирует никотиновые ацетилхолиновые рецепторы, а также обратный захват дофамина. Таким образом, фенциклидин одновременно является агонистом дофаминергических рецепторов, что может объяснять некоторые из его психотропных эффектов.
P.S. Глутамат (глутаминовая кислота) — это основной возбуждающий нейромедиатор переднего мозга и мозжечка.
Фенциклидин и кетамин также известны как диссоциативные анестетики — вещества, которые вызывают ощущение отчужденности (диссоциации) от окружающей среды и самого себя за счет искажения зрительного и слухового восприятия.
Кетамин применяют в медицинских целях в качестве средства для наркоза. Он создает подобное трансу состояние, обеспечивая обезболивание, седацию и потерю памяти. В настоящее время кетамин проходит клинические испытания в качестве быстродействующего антидепрессанта и 3-ю фазу клинических испытаний в качестве средства для лечения большого депрессивного расстройства (Caddy et al., 2014). Механизм его действия как агониста глутаматергических рецепторов сильно отличается от механизмов действия большинства назначаемых при депрессии современных препаратов, которые нацелены на серотониновую и норадреналиновую системы.
Мемантин (Namenda) — это антагонист NMDA-рецепторов, который назначают при болезни Альцгеймера для предупреждения потери нейронов.
д) Дофаминергические препараты. Вначале мы рассмотрим агонисты дофаминовых рецепторов, которые используют в рекреационных (кокаин, амфетамин) и терапевтических целях (декстроамфетамин (Adderall), метилфенидат (Ritalin) и L-ДОФА). Затем мы рассмотрим антагонисты дофаминовых рецепторов, которые назначают при шизофрении и вызванном психоактивными веществами психозе — хлорпромазин (Thorazine), галоперидол (Haldol), клозапин (Clozaril) и арипи-празол (Абилифай®, Aripiprex).
1. Агонисты дофаминовых рецепторов. Используемые в рекреационных целях агонисты дофаминовых рецепторов — это кокаин, амфетамин и метамфетамин. Кокаин получают из листьев куста коки (рис. 3), а амфетамин и метамфетамин представляют собой синтетические вещества.

Многие поколения коренных народов Перу жевали листья коки, чтобы повысить свою выносливость в условиях высокогорья. Очищенный кокаин вдыхают или употребляют в виде инъекций. Кокаиновые наркоманы, которые не хотят вводить кокаин внутривенно или не могут позволить себе порошок, нюхают или курят крэк — кристаллический кокаин (на рис. 3 изображен справа). Благодаря своей химической структуре крэк испаряется при низкой температуре, что позволяет вдыхать его пары.
Зигмунд Фрейд (1974) популяризировал кокаин в конце 1800-х гг., считая его антидепрессантом. Некогда кокаин широко использовали при производстве тонизирующих напитков и винных смесей с тонизирующим эффектом.
От слова «кокаин» произошло торговое название «Кока-кола», в состав которой когда-то входил кокаин (рис. 4). Однако вскоре стала очевидной его способность вызывать зависимость, поэтому во всех указанных продуктах кокаин был заменен кофеином.

Фрейд также рекомендовал использовать кокаин в качестве местного анестетика. Кокаин доказал свою эффективность в качестве анестетика, а многие производные кокаина, в том числе ксилокаин (часто называемый новокаином), применяются в качестве анестетиков до сих пор. Препараты для местной анестезии уменьшают проницаемость клеточных мембран для ионов натрия, таким образом снижая нервную проводимость.
Как показано на рис. 5, амфетамин относится к агонистам дофаминовых рецепторов. Он препятствует обратному захвату дофамина, меняя направление транспорта, из-за чего дофамин продолжает взаимодействовать с постсинаптическими дофаминовыми рецепторами D2.
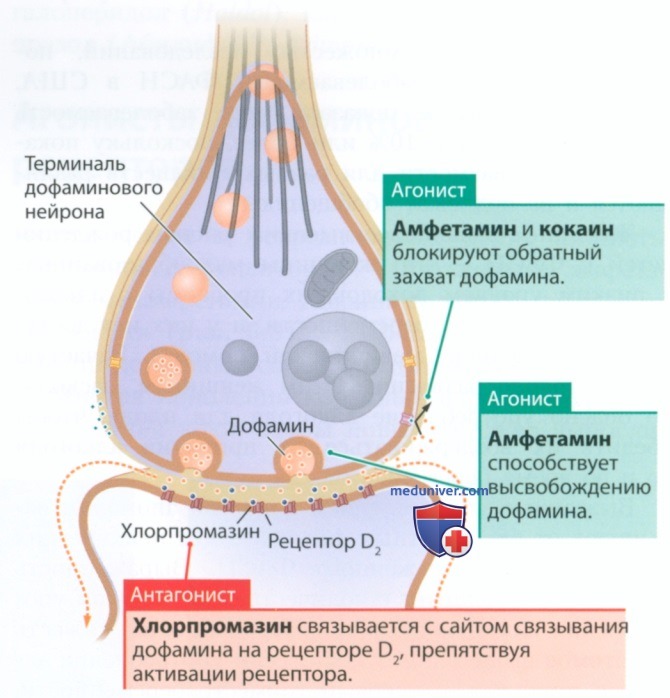
Амфетамин — это синтетическое вещество. Его открыли при попытке синтезировать нейромедиатор ЦНС адреналин, который также действует как гормон, мобилизуя организм при стрессе (см. рис. 5). И амфетамин, и кокаин являются агонистами дофаминовых рецепторов. Амфетамин действует, меняя направление транспорта при обратном захвате дофамина, а кокаин блокирует транспортер. В обоих случаях в синаптической щели остается больше дофамина, однако амфетамин также меняет направление транспортера, отвечающего за упаковку дофамина в везикулы, таким образом удаляя уже упакованный дофамин и увеличивая его уровень на синаптической терминали.
Затем присутствующий на синаптической терминали транспортер закачивает предварительно упакованный в везикулы дофамин в синаптическую щель. Таким образом, амфетамин действует двумя различными путями, увеличивая уровень дофамина в синапсах и таким образом обеспечивая стимуляцию дофаминовых рецепторов. Производные амфетамина широко используют для лечения СДВГ.
Benzedrine, один из препаратов на основе амфетамина, был разработан для лечения астмы. Benzedrine в форме ингалятора продавали без рецепта вплоть до 1940-х гг. Вскоре люди сообразили, что могут открыть контейнер и принять внутрь содержимое, чтобы взбодриться. Амфетамин широко использовали во время Второй мировой войны, чтобы помочь пехотинцам и летчикам быть начеку, сделать их более уверенными и агрессивными, а также повысить их боевой дух — это продолжают практиковать и в наше время. Гражданские лица использовали амфетамин для повышения производительности труда рабочих в военное время. Сейчас амфетамин является популярным средством для снижения веса. Многие нелегально распространяемые стимуляторы и средства для снижения веса по своему действию похожи на амфетамин.
Широко используемым рекреационным производным амфетамина является метамфетамин. Распространенность употребления метамфетамина в течение жизни среди населения США (процент населения, употреблявшего этот наркотик хотя бы раз в жизни), по некоторым оценкам, достигает 8% (Durell et al., 2008) — это связано с простотой его производства в нелегальных лабораториях, а также с его эффективностью; все это делает метамфетамин относительно недорогим, но потенциально опасным наркотиком. Незаконный характер производства метамфетамина не позволяет сделать какие-либо выводы об эффектах метамфетаминов в сравнении с легально используемыми амфетаминами.
Амфетамин {Adderall) и метилфенидат (Ritaline) применяют для лечения СДВГ — расстройства, характеризуемого чрезмерной активностью, трудностями с контролем поведения и концентрацией внимания (при этом люди с СДВГ могут достаточно долго концентрироваться на выполнении задач, которые кажутся им интересными). Рекреационная (нерегулярная) доза каждого из препаратов примерно в 50 раз превышает терапевтическую дозу. Продолжительное злоупотребление этими препаратами приводит к психозам — поведенческим расстройствам, сопровождающимся галлюцинациями (ложные восприятия), бредом (болезненные представления), паранойей, разорванным мышлением и многими другими симптомами. Такие симптомы также характерны для пациентов с шизофренией.
2. Антагонисты дофаминовых рецепторов. Дофаминовая гипотеза шизофрении предполагает, что некоторые формы данного заболевания могут быть связаны с избыточной выработкой дофамина, особенно в лобных долях. Если избыток дофамина образуется при медикаментозно вызванном психозе или некоторых формах шизофрении, то антагонисты дофаминовых рецепторов должны помочь справиться с симптомами этих состояний (см. рис. 5). Применение антагонистов дофаминовых рецепторов, которые связывались с рецепторами D2, улучшало состояние пациентов с шизофренией. С 1955 г., когда антагонисты дофаминовых рецепторов (антипсихотические препараты) начали применять повсеместно, число пациентов с шизофренией в государственных и муниципальных психиатрических клиниках США значительно сократилось.
Шизофренией заболевает примерно один из 100 человек, что делает применение антагонистов дофаминовых рецепторов важным достижением в медицине. Хотя применение антагонистов дофаминовых рецепторов для лечения психозов делает эти психические расстройства управляемыми, оно не позволяет полностью излечить заболевание. В действительности, согласно данным Национального института исследований инвалидности, самостоятельного образа жизни и реабилитации (National Institute on Disability, Independent Living and Rehabilitation Research), при относительно небольшом числе пациентов в психиатрических клиниках примерно 75% бездомных и 50% заключенных имеют психические заболевания.
По оценкам Human Rights Watch, в 2015 г. в США в тюрьмах было в 10 раз больше душевнобольных, чем в психиатрических клиниках.
Антагонисты дофаминовых рецепторов широко используют для лечения психозов начиная с середины 1950 гг., когда были разработаны антипсихотические препараты первого поколения. Они относятся к классам фенотиазинов (напр., хлорпромазин; Thorazine) и бутирофенонов (галоперидол; Haldol). Действие антипсихотических препаратов первого поколения преимущественно основано на блокировке дофаминового рецептора D2, мгновенно приводящей к снижению двигательной активности и чрезмерного возбуждения у некоторых пациентов с шизофренией. Однако из-за того, что в развитие шизофрении вовлечены не только рецепторы D2, изменения в дофаминергических синапсах нс позволяют описать природу заболевания или эффекты антагонистов дофаминовых рецепторов.
Начиная с 1980-х гг. начали появляться антипсихотические препараты второго поколения, такие как клозапин (Clozaril), и некоторые другие. Антипсихотические препараты блокируют не только дофаминовые рецепторы D2, но и серотониновые рецепторы 5-НТ2.
Терапевтическое действие антагонистов рецепторов D2 остается не вполне ясным, а продолжительный прием таких препаратов может привести к появлению многих нежелательных эффектов, в том числе к тардивной (поздней) дискинезии (ТД). ТД — это двигательное расстройство, которое характеризуется непроизвольными движениями, такими как гримасничанье, высовывание языка или причмокивание губами, а также быстрыми раскачивающимися или медленными закручивающимися движениями туловища.
Напомним, что агонисты дофаминовых рецепторов, такие как L-ДОФА, поднимают уровень дофамина, способствуя восстановлению двигательной функции при болезни Паркинсона. Таким образом, дофамин играет ключевую роль в поддержании нормальной двигательной функции и психического здоровья.
д) Серотонинергические препараты. В этом разделе мы рассмотрим агонисты серотониновых рецепторов, стараясь не забывать о том, что большинство агонистов серотониновых рецепторов обладает адренергической активностью.
Широко известна способность агонистов серотониновых рецепторов изменять восприятие реальности — чувства, ощущения и зрительное восприятие (зрительные галлюцинации), вызывая особое психоделическое состояние («трип»). Психоделики были частью молодежной субкультуры 1960-х гг., в наше время их продолжают использовать в рекреационных целях и в рамках духовных практик. Некоторые из этих веществ, такие как мескалин (пейот; 3,4,5-триметоксиамфетамин), ДМТ (N,N-диметилтриптамин) и псилоцибин, выделяют из растений и грибов, а другие, такие как диэтила-мид лизергиновой кислоты (ЛСД) и МДМА (экстази, 3,4-метилендиоксиметамфетамин), являются синтетическими.
В прошлом столетии убежденные защитники агонистов серотониновых рецепторов в США пропагандировали их применение для «расширения сознания и самопознания». Мескалин, получаемый из кактуса пейот, легально используется коренным населением США (американскими индейцами) в рамках духовных практик. Психоделические переживания, вызванные приемом агонистов серотониновых рецепторов, могут быть приятными, они могут сопровождаться приподнятым настроением или эйфорией, отключением от реальности, расторможенностью и убежденностью в чрезвычайной ясности ума или наличии сверхспособностей. Психоделические переживания также могут быть связаны с иррациональными страхами, паническими атаками, паранойей, быстрыми сменами настроения, навязчивыми мыслями о безнадежности существования, желанием причинить вред другому человеку и суицидальными идеями.
Многократный прием психоделиков может привести к проблемам со сном, настроением, памятью и вниманием. В наше время эти используемые в рекреационных целях вещества не назначают в качестве лекарств — их распространяют нелегально. Однако существуют и другие агонисты серотониновых рецепторов, которые применяют для лечения большого депрессивного расстройства.
Большое депрессивное расстройство (депрессия) — это аффективное расстройство, характеризуемое сохраняющимся в течение длительного периода ощущением собственной никчемности и чувством вины, нарушениями пищевого поведения и сна (бессонницей), общей заторможенностью и суицидальными мыслями. В наше время около 6% взрослого населения США страдают большим депрессивным расстройством (major depression). (Данный термин употребляется только в США. Он входит в 5-е издание Диагностического и статистического руководства по психическим расстройствам (DSM-5). Согласно международной классификации болезней 10-го пересмотра (МКБ-10) различают несколько заболеваний подобного спектра, в том числе депрессивный эпизод (F32) и рекуррентное депрессивное расстройство (F33). Однако они не могут быть использованы как полноценные русскоязычные аналоги термина «major depression»).
В течение жизни как минимум один депрессивный эпизод продолжительностью в несколько месяцев или более переживают около 30% населения. Большое депрессивное расстройство вдвое чаще диагностируют у женщин, чем у мужчин.
Факторами риска развития депрессии являются плохое питание, стресс из-за тяжелых жизненных обстоятельств, функциональные изменения нейронов и повреждение нейронов головного мозга. Указанные факторы могут быть взаимосвязаны: дефицит питательных веществ может повысить уязвимость к стрессу; стресс может повлиять на функцию нейронов; в отсутствие коррекции изменение функции нейронов может привести к повреждению нейронов. Более подробную информацию о стрессе можно найти в разд. 6-5.
В связи с этим существует несколько подходов к медикаментозному лечению депрессии. Они предполагают нормализацию уровня гормонов стресса, регуляцию ответа нейронов и стимуляцию их восстановления.
1. Антидепрессанты. Для лечения депрессии применяют три типа агонистов серотониновых рецепторов ингибиторы моноаминоксидазы (МАО); трициклические антидепрессанты, получившие свое название из-за особенностей химической структуры — наличия трех колец; селективные ингибиторы обратного захвата серотонина (СИОЗС). В молекулах СИОЗС нет трех колец, однако по своему действию они похожи на трициклические антидепрессанты.
Считается, что назначаемые при депрессии препараты действуют, улучшая синаптическую передачу в серотониновых, норадреналиновых, гистаминовых и ацетилхолиновых синапсах, а также, возможно, в дофаминовых синапсах. Действие ингибиторов МАО, трициклических антидепрессантов и СИОЗС на примере серотонинового синапса рассмотрено на рис. 6. Препараты указанных трех групп действуют как агонисты, но используют различные механизмы повышения доступности серотонина.
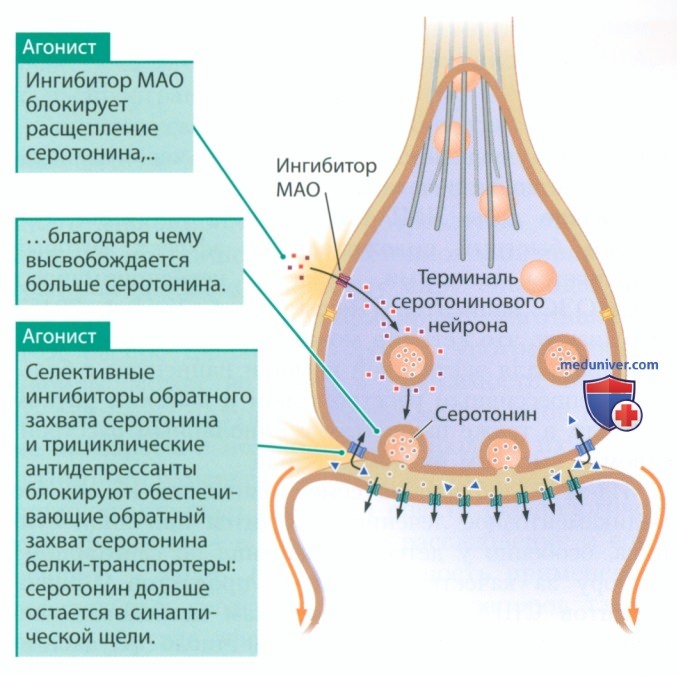
Ингибиторы МАО увеличивают выброс серотонина с каждым потенциалом действия за счет ингибирования моноаминоксидазы — фермента, который расщепляет серотонин в терминали аксона. Трициклические антидепрессанты и СИОЗС, напротив, блокируют транспортер, который обеспечивает обратный захват серотонина. Из-за блокировки транспортера серотонин задерживается в синаптической щели, продолжая воздействовать на рецепторы постсинаптической мембраны.
Несмотря на то что все перечисленные препараты начинают воздействовать на синапсы очень быстро, их эффект проявляется спустя недели после начала приема. Отчасти это можно объяснить тем, что такие препараты, в особенности СИОЗС, стимулируют активацию восстановления поврежденных из-за стресса нейронов вторичными мессенджерами. В этой связи следует отметить, что такой СИОЗС, как флуоксетин (Прозак®), стимулирует образование новых нейронов в гиппокампе — лимбической структуре височной доли. В отдельной статье на сайте (просим пользоваться формой поиска выше) можно прочитать о том, что гиппокамп уязвим к вызванным стрессом повреждениям, а его восстановление под воздействием флуоксетина по-видимому лежит в основе антидепрессантного эффекта этого препарата (Hill et al., 2015).
Большинству пациентов удается справиться с депрессией в течение года с момента появления симптомов. В отсутствие лечения среди пациентов с депрессией наблюдается высокий уровень суицидов — об этом можно прочитать в разд. «Клинические аспекты 6-3: Большое депрессивное расстройство». Среди психофизиологических расстройств большое депрессивное расстройство является одним из самых легко излечимых заболеваний. Самым эффективным способом лечения указанного расстройства является применение когнитивно-поведенческой терапии с медикаментозной поддержкой (Comer, 2011).
Несмотря на успехи в лечении депрессии, около 20% пациентов с депрессией остаются невосприимчивыми к антидепрессантам. Депрессия может быть вызвана различными причинами, в том числе дисфункцией других нейромедиаторных систем и даже повреждениями мозга (например повреждениями лобных долей), которые не могут быть устранены с помощью агонистов серотониновых рецепторов. Кроме того, некоторым людям не удается справиться с побочными эффектами антидепрессантов — повышенной тревожностью, сексуальной дисфункцией, вялостью, сухостью во рту, нарушением четкости зрения и расстройствами памяти.
P.S. Обратный захват, обеспечивающий инактивацию нейромедиатора, — это один из пяти этапов синаптической передачи.
е) Опиоидергические препараты. Опиоид — это любое эндогенное или экзогенное соединение, которое связывается с опиоидными рецепторами, продуцируя морфиноподобные эффекты. Такие психоактивные вещества обладают снотворным (наркотическим) и обезболивающим (анальгезирующим) действием. По происхождению опиоиды делят на три группы: растительные (морфин, кодеин), полусинтетические (героин, оксикодон) и синтетические (фентанил, метадон).
В результате исследований было выделено пять классов опиоидных пептидов — динорфины, энкефалины, эндорфины, эндоморфины и ноцицептин. Четыре рецептора, связывающие опиоидные пептиды, — это рецепторы дельта-, каппа-, мю- и ноцицептиновые (ORL1) рецепторы. Все опиоидные пептиды и их рецепторы встречаются во многих отделах ЦНС и других отделах организма, в том числе в энтеральной нервной системе (ЭНС). Морфин наиболее близок к эндоморфинам, в основном он активирует мю-рецепторы.
Клинические аспекты. Большое депрессивное расстройство. П. X., 53-летний преподаватель вуза, испытывал все меньшее удовлетворение от работы, несмотря на популярность среди студентов. Его брак трещал по швам, потому что он стал апатичным и не стремился общаться или ездить в совместные поездки. Ему было трудно вставать по утрам и вовремя приходить на работу.
В конце концов П. X. обратился к терапевту с жалобами на сильные боли в грудной клетке, которые, по его мнению, могли быть симптомом надвигающегося инфаркта. В беседе с терапевтом он признался, что инфаркт мог бы стать долгожданным облегчением, поскольку он мог бы положить конец проблемам П. X. Терапевт понял, что П. X. страдает депрессией, и направил его к психиатру.
С 1950-х гг. для лечения депрессии применяют серотонинергические препараты и различные варианты когнитивно-поведенческой терапии, а в случае неэффективности медикаментозной терапии используют электросудорожную терапию (ЭСТ), которая предполагает пропускание электрического тока через одно полушарие мозга. Для большого депрессивного расстройства характерен высокий риск суицида и самоповреждающего поведения, особенно у подростков с депрессией, невосприимчивых к СИОЗС (Asarnow et al., 2011). Даже у пациентов, восприимчивых к СИОЗС, улучшение возникает лишь через несколько недель после начала лечения.
Низкие дозы NMDA-антагониста кетамина оказывают быстрый положительный эффект, который сохраняется неделями, даже у невосприимчивых к СИОЗС пациентов (Reinstatler & Youssef, 2015). Это значит, что кетамин можно применять в качестве препарата для экстренной помощи пациентам с большим депрессивным расстройством и высоким риском суицида, а также пациентам с биполярным расстройством и высоким риском суицида.
Из-за жалоб членов семей пациентов на то, что медикаментозное лечение становится причиной суицида, особенно у детей, Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США поручило медикам исследовать побочные эффекты СИОЗС, в том числе флуоксетина (Прозак®), сертралина (Золофт®) и пароксетина (Паксил®, Seroxat). Результаты исследования показали отсутствие различий в частоте суицидов между детьми и подростками, получавшими СИОЗС и плацебо. Кроме того, после сокращения числа выписываемых препаратов по приказу Управления по санитарному надзору за качеством пищевых продуктов и медикаментов частота суицидов возросла (Isacsson & Rich, 2014).
Опиум — это белое смолистое вещество, получаемое из коробочек снотворного мака (Papaver somniferum), представленного на рис. 7 (слева). Опиум, главным активным веществом которого является морфин, на протяжении тысяч лет использовали для улучшения настроения, обезболивания, в качестве снотворного средства, а также для лечения диареи и кашля. В 1805 г. фармацевт Фридрих Сертюрнер (Friedrich Serturner) выделил из опиума два химических вещества — кодеин и морфин. Кодеин часто используют в качестве компонента рецептурных препаратов от кашля и обезболивающих препаратов. В печени вырабатывается фермент, который превращает кодеин в морфин, однако у некоторых светловолосых и голубоглазых людей этот фермент отсутствует. Морфин, изображенный на рис. 7 (в центре), названный в честь Морфея, греческого бога сновидений, меняет наше восприятие боли.

Помимо природных опиоидов, с мю-рецепторами взаимодействуют полусинтетические опиоиды, такие как героин и оксикодон. Героин, который представлен на рис. 7 (справа), является производным морфина. Он обладает более выраженным эффектом, является более жирорастворимым, а также быстрее преодолевает гематоэнцефалический барьер — этим обусловлено его более быстрое, но менее долговременное психотропное действие. В некоторых странах героин легализован, однако в остальных странах, в том числе в США, его распространяют нелегально.
Синтетические опиоиды, такие как фентанил, применяют в медицинских целях для обезболивания. Все опиоиды обладают способностью вызывать зависимость, а злоупотребление применяемыми в медицинских целях опиоидами является серьезной проблемой по всему миру. Опиоиды также часто нелегально модифицируют, изготавливают и распространяют. У людей, употребляющих опиоиды, может возникнуть зависимость; некоторые пациенты получают несколько рецептов на такие препараты и незаконно перепродают их.
Помимо измененного восприятия боли, прием опиоидов вызывает широкий спектр физиологических эффектов — в том числе расслабление и сон, эйфорию и запор. (Да, популярность применения слабительных средств для лечения запоров также растет.) Другие эффекты опиоидов — это угнетение дыхание, которое является основной причиной гибели опиоидных наркоманов, снижение артериального давление, сужение зрачка, гипотермия, сухость слизистых оболочек (например сухость во рту), снижение полового влечения, покраснение кожи и нарушение терморегуляции.
P.S. «Cold turkey» («холодная индейка») — так называют симптомы, которыми сопровождается синдром отмены опиоидов: кожа становится холодной, а волоски вздыбливаются, из-за чего кожа становится похожей на кожу ощипанной индейки. Это эффект, противоположный наблюдаемому при приеме опиоидов, когда кожа становится горячей. (Название происходит от английского идиоматического выражения «to go cold turkey», которое часто употребляется для описания симптомов, возникающих после отмены наркотических препаратов, алкоголя или табака).
Многократное употребление опиоидов приводит к толерантности, а эффективная доза может возрастать в десять раз. После этого многие желаемые эффекты получить не удается. Зависимый человек не может просто прекратить употреблять наркотик, не испытав на себе его нежелательные эффекты: в случае внезапного прекращения употребления наркотика возникает тяжелый синдром отмены, физиологические и поведенческие симптомы которого противоположны возникающим при приеме наркотика.
Поскольку употребление опиоидов приводит и к толерантности, и к сенситизации, оно всегда связано с высоким риском передозировки. Ненадежность информации о степени очистки «уличных» опиоидов делает риск передозировки еще выше. В США и Канаде передозировка опиоидами является основной причиной смерти людей в возрасте до 50 лет!
Такие препараты, как налоксон (Narcan, Nalone), действуют как антагонисты опиоидных рецепторов. Налоксон представляет собой конкурентный ингибитор — он конкурирует с опиоидами, связываясь с рецепторами нейронов. Благодаря своей способности мгновенно проникать в мозг, конкурентные ингибиторы быстро блокируют действие опиоидов, поэтому они могут быть использованы в качестве антидота при лечении передозировки опиоидами. Многие опиоидные наркоманы используют конкурентный ингибитор для профилактики передозировки. Благодаря пролонгированному действию, конкурентные ингибиторы можно применять для лечения опиоидной зависимости у наркоманов, переживших синдром отмены.
Ученые тщательно изучили возможность применения вырабатываемых в мозгу опиоидных пептидов в качестве не вызывающих привыкания обезболивающих препаратов. Возможность их медицинского применения пока остается под вопросом, поскольку анальгезирующий эффект в отсутствие привыкания достаточно трудно реализовать. В некоторых странах, например в Японии, хроническую боль не лечат опиоидами, что позволяет избежать связанных с применением опиоидов проблем. Разработка неопиоидных обезболивающих препаратов остается важным направлением исследований.
ж) Каннабиноидные препараты. Тетрагидроканнабинол (ТГК) — это один из 84 каннабиноидов и основной психоактивный компонент каннабиса (который некорректно называют марихуаной). Его получают из конопли, изображенной на рис. 8. ТГК влияет на настроение за счет взаимодействия с каннабиноидными рецепторами СВ1 нейронов, а также рецепторами СВ2, присутствующими в глиальных клетках и других клетках организма. Каннабис отличается крайне низкой токсичностью — ни один человек в мире не умер от передозировки гашиша. Каннабис может пагубно влиять на настроение и память, при этом оказывать положительный эффект при умственных перегрузках.
Человеческий организм вырабатывает два эндогенных вещества, способных связываться с рецепторами СВ1 и СВ2, — анандамид и 2-AG. Результаты множества исследований показали, что анандамид может снижать тревожность и способствовать забыванию. Анандамид может защищать связанные с памятью системы мозга от переполнения поступающей изо дня в день информацией.
Есть данные об эффективности ТГК и каннабидиола (другого каннабиноида) в отношении целого ряда заболеваний. Каннабис справляется с тошнотой и рвотой (побочными эффектами химиотерапии) у пациентов с онкологическими заболеваниями, а также стимулирует аппетит у пациентов с синдромом анорексии/кахексии. Установлено, что каннабис помогает при хронической боли благодаря механизмам, отличным от механизмов действия опиоидов. Каннабис позволяет уменьшить дозу опиоидов при лечении болевого синдрома.

Каннабис также показал свою эффективность при лечении глаукомы (повышенного внутриглазного давления), спастических явлениях, в том числе при рассеянном склерозе, заболеваниях, связанных с повреждениями спинного мозга, а также при некоторых формах эпилепсии. Каннабис может обладать определенными нейропротективны-ми свойствами. Многие люди по собственной воле применяют каннабис в качестве лекарства от многих заболеваний, в том числе при ПТСР (Roitman et al., 2014).
P.S. Марихуана — испанское название каннабиса с непонятным значением, которое ввели в обиход мексиканцы в начале 1900-х гг. Это название сделало растение пугающим и чуждым для белых американцев, что привело к росту расистских настроений и ксенофобии в отношении мексиканцев.
P.S. Анандамид (в переводе с санскрита «блаженство» или «идеальное счастье») воздействует на рецептор СВ1, который в норме ингибирует аденилатциклазу — компонент вовлеченной в процесс сенситизации системы вторичного мессенджера.
Синтетический ТГК и его производные были получены прежде всего для того, чтобы обойти правовые ограничения в отношении применения ТГК. Тем не менее, исследование его полезных лечебных свойств затруднено из-за правовых ограничений в отношении каннабиса и его производных.
з) Закрепление изученного материала. Прежде чем продолжить, проверьте себя.
1. _______ , самое активно употребляемое психоактивное вещество в мире, связывается с _______ рецепторами, но также имеет другие механизмы действия.
2. Препараты, которые снижают тревожность и оказывают седативный эффект, воздействуют на рецептор, обеспечивая гиперполяризацию нейрона за счет притока _______ .
3. Антидепрессанты прежде всего воздействуют на _______ ергическую систему.
4. Опиоиды действуют как _______ , связываясь с теми же рецепторами.
5. Амфетамин стимулирует _______ , а кокаин блокирует _______ в _______ синапсе.
6. На какие нейромедиаторы воздействуют психотропные препараты?
и) Ответы на вопросы:
1. Кофеин; аденозиновыми.
2. ГАМКA; ионов хлора (Cl-).
3. Серотонин.
4. Эндорфины.
5. Высвобождение транспортера; транспортер; дофаминергическом.
6. Психотропные препараты воздействуют на многие нейромедиаторы, в том числе на ацетилхолин, анандамид, дофамин, адреналин, глутамат, норадреналин и серотонин.
- Читать далее "Причины индивидуальной реакции на психоактивный препарат"
Редактор: Искандер Милевски. Дата публикации: 28.7.2023
- Возможно ли улучшить умственную деятельность лекарствами и препаратами?
- Как препараты попадают в нервную систему? Гематоэнцефалический барьер (ГЭБ)
- Действие препаратов на синапсы: агонисты и антагонисты
- Холинергический синапс: примеры действия препаратов
- Толерантность (синдром привыкания) на примере алкоголя
- Сенситизация к психоактивным препаратам
- Классификация психоактивных препаратов по нейромедиаторным системам
- Причины индивидуальной реакции на психоактивный препарат
- Причины зависимости от психоактивных веществ и ее лечение
- Гормоны и их влияние на мозг, поведение
- Резюме по влиянию психоактивных препаратов и гормонов на мозг, поведение
