Нейрокогнитивные расстройства - с точки зрения нейрофизиологии
Нейрокогнитивные расстройства — это расстройства, которые характеризуются прогрессирующими нарушениями функции нейронов и/или потерей нейронов. Такие расстройства делят на малые и большие, в зависимости от способности пациента к самообслуживанию. Человеческое общество впервые переживает демографический переход. С 1900 г. доля пожилых людей в общей популяции неуклонно увеличивалась. В 1900 г. доля доживших до 65 лет в популяции составляла около 4%. К 2030 г. доля людей старше 65 лет достигнет примерно 20% — только в США их количество составит около 50 млн человек.
Увеличение доли пожилых людей влечет за собой серьезные последствия, связанные с возрастными нейрокогнитивными расстройствами. Распространенность нейрокогнитивных расстройств у людей старше 65 лет составляет 1-6%, а их распространенность у людей старше 80 лет достигает 10-20%.
На каждого человека с большим нейрокогнитивным расстройством приходится несколько человек с малыми нейрокогнитивными расстройствами, влияющими на их качество жизни. В настоящее время в США большие нейрокогнитивные расстройства диагностированы более чем у 6 млн людей. По прогнозам, к 2050 г. число таких людей вырастет примерно до 15 млн. К тому времени в США ежегодно будут выявлять по одному миллиону новых случаев. Экстраполяция данных на другие развитые страны позволяет оценить величину социальных и экономических издержек (Khachaturian & Khachaturian, 2015).
По оценкам Всемирной организации здравоохранения, к 2050 г. заболеваемость нейрокогнитивными расстройствами в мире вырастет до 135,5 млн человек.
Нейрокогнитивные расстройства — это сравнительно недавно выделенная группа расстройств, ранее называвшихся деменциями. Поскольку многие классификации продолжают использовать старые названия, мы расскажем немного о новой классификации, а затем перейдем к обсуждению двух наиболее распространенных нейрокогнитивных заболеваний, для которых характерны симптомы деменции, — болезни Альцгеймера и болезни Паркинсона.
а) Деменция. Деменция — это приобретенное стойкое слабоумие. Основные особенности деменции: 1) расстройства памяти и другие когнитивные нарушения и 2) социальная дезадаптация и утрата профессиональных навыков. Деменция возникает при различных нейрокогнитивных расстройствах. Причины деменции можно разделить на две большие группы — дегенеративные и недегенеративные причины (табл. 7).

Недегенеративные деменции — это гетерогенная группа расстройств различной этиологии. Перечисленные в правой колонке табл. 7 причины деменции — это заболевания сердечно-сосудистой и эндокринной систем, воспаление, недостаточность питания и воздействие токсинов. Чаще всего встречаются сосудистые деменции. Наиболее значимыми факторами риска недегеративных деменций (как и сердечно-сосудистых заболеваний) являются гипертония, ожирение, малоподвижный образ жизни, курение и диабет. Перечисленные в левой колонке таблицы дегенеративные деменции также возникают из-за разных причин, в том числе генетических факторов, воздействия токсинов и повреждений нервной системы.
б) Болезнь Альцгеймера. Болезнь Альцгеймера — это большое нейрокогнитивное расстройство и одна из самых частых причин дегенеративной деменции. Рост числа пожилых людей и соответствующее увеличение числа случаев болезни Альцгеймера, доля которой составляет около 65% от всех нейрокогнитивных расстройств, побудило ученых направить свои усилия на поиск возможных причин заболевания (Kumar & Tsao, 2018). Текущие исследования направлены на изучение вклада образа жизни, присутствующих во внешней среде токсинов, высокого уровня микроэлементов (например, алюминия) в крови, аутоиммунных реакций, медленно действующих вирусов, ухудшения кровоснабжения полушарий мозга и генетической предрасположенности в развитие заболевания.
Высокая заболеваемость болезнью Альцгеймера в ряде семей указывает на то, что 40-70% случаев заболевания могут иметь генетические причины.
До недавнего времени единственным способом диагностики и изучения болезни Альцгеймера были посмертные патологоанатомические исследования. Данный метод по-прежнему является единственным способом, позволяющим поставить окончательный диагноз. Залогом успеха при лечении и профилактике заболевания является ранняя диагностика — в ходе болезни или даже до ее начала. По мере прогрессирования заболевания в корковых структурах и в ряде нейромедиаторных систем возникают многочисленные изменения. Диагностировать заболевание помогают нейропсихологическое тестирование, нейровизуализация и анализ крови (Nakamura et al., 2018).
Основным нейроанатомическим признаком болезни Альцгеймера является появление амилоидных бляшек (белковых скоплений из погибших нейронов и астроцитов) прежде всего в коре больших полушарий. Количество амилоидных бляшек в коре коррелирует со степенью выраженности когнитивных нарушений. Амилоидные бляшки принято считать неспецифическим признаком, поскольку они встречаются у пациентов, не страдающих болезнью Альцгеймера, и у пациентов с другими нейрокогнитивными расстройствами известной этиологии.
К анатомическим коррелятам болезни Альцгеймера также относят нейрофибриллярные клубки (скопления микротрубочек из погибших клеток), встречающиеся в неокортексе и аллокортексе. При этом в задних отделах гиппокампа их обычно больше, чем в передних. Нейрофибриллярные клубки обычно находят в человеческих тканях; они встречаются в тканях пациентов с синдромом Дауна и болезнью Паркинсона.
P.S. Нейрофиламенты — это тип трубочек цитоскелета, которые отвечают за прочность клетки, позволяют клетке двигаться и обеспечивают транспорт белков.
Следует отметить, что связанные с болезнью Альцгеймера изменения неокортекса не являются однородными. Как показано на рис. 1, по мере прогрессирования болезни кора больших полушарий атрофируется и может потерять до одной трети объема. Исследование клеток под микроскопом показало, что некоторые области, в т. ч. первичные сенсорные зоны и первичная моторная кора (в особенности зрительная и сенсомоторная кора), сравнительно мало пострадали. Лобные доли поражены в меньшей степени, чем задняя кора.
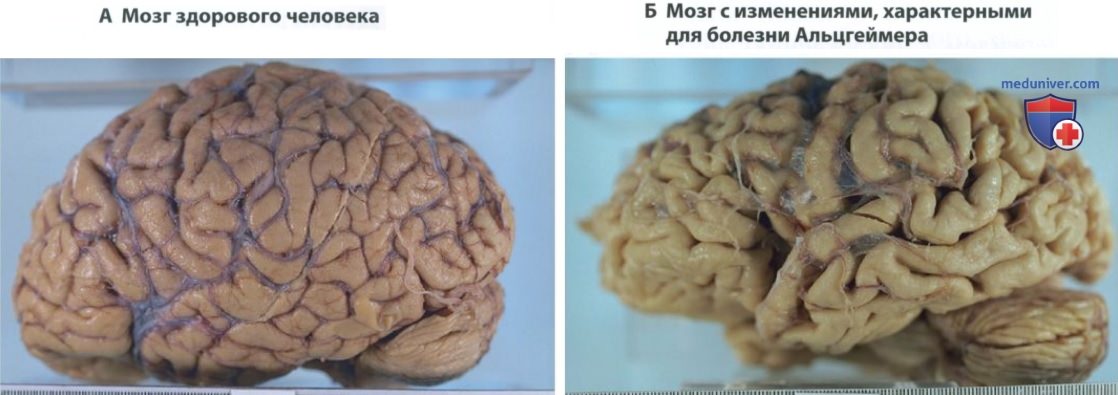
В областях коры наблюдаются наиболее значительные изменения. В первую очередь заболевание поражает энторинальную кору — там наблюдается наиболее тяжелое поражение. Энторинальная кора представляет собой основное связующее звено, обеспечивающее обмен информацией между гиппокамповой формацией и неокортексом. Поражения энторинальной коры связаны с нарушениями памяти — ранним и устойчивым симптомом болезни Альцгеймера.
Результаты многих исследований указывают на потерю клеток коры больших полушарий у пациентов с болезнью Альцгеймера, однако это остается предметом дискуссии. Похоже, что происходит значительное уменьшение объема крупных нейронов, однако такие клетки скорее уменьшаются в размерах, чем исчезают. Более частой причиной атрофии коры больших полушарий, по-видимому, является уменьшение сложности дендритного ветвления (рис. 2).
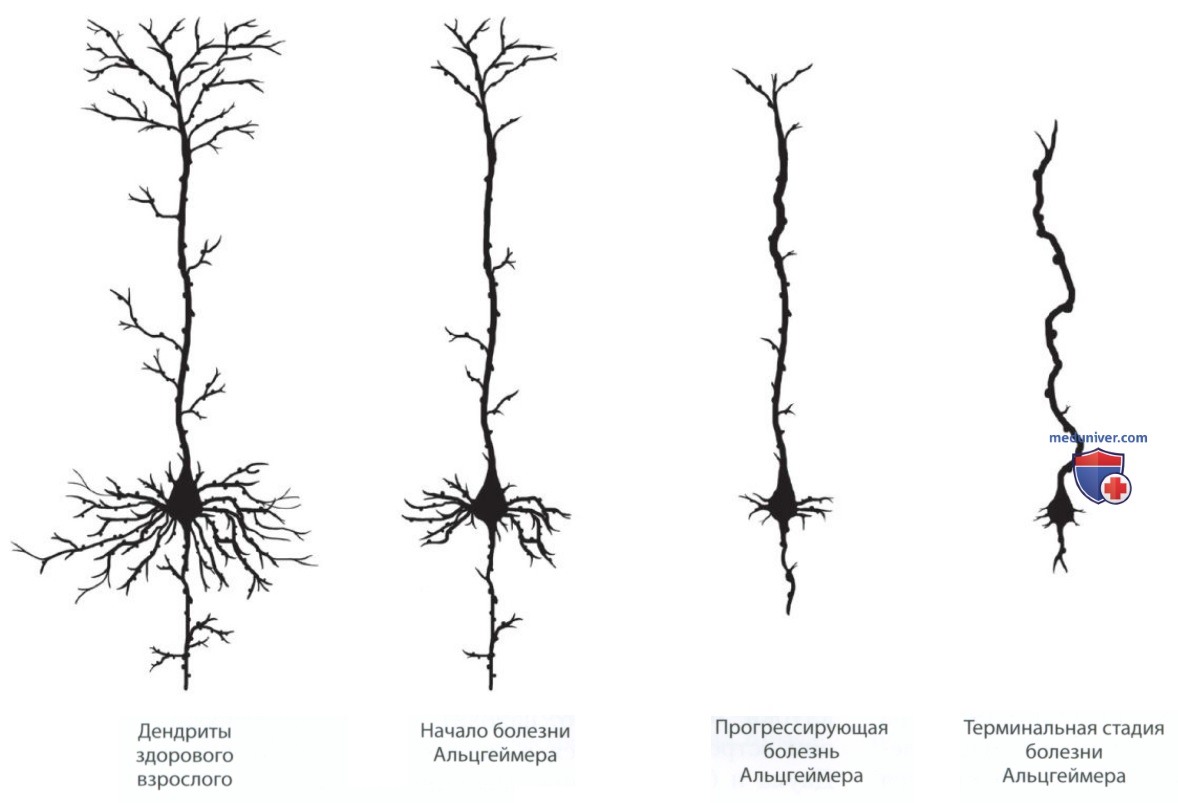
Помимо потери клеток и уменьшения клеток в размерах, имеют место изменения в выработке другими клетками нейромедиаторов. В 1970-х гг. исследователи считали, что им удастся найти лекарство от болезни Альцгеймера, подобное применяемому при болезни Паркинсона препарату L-ДОФА. Основным веществом-кандидатом был и остается нейромедиатор ацетилхолин, а один из методов лечения болезни Альцгеймера предполагает применение препаратов, повышающих уровень ацетилхолина в переднем мозге.
Холинергические агонисты, назначаемые перорально или в виде пластыря на коже, могут быть эффективными на ранней стадии заболевания. К сожалению, патогенез болезни Альцгеймера оказался значительно сложнее — заболевание сопровождается изменениями уровня как ацетилхолина, так и других нейромедиаторов. Наблюдается снижение уровня норадреналина, дофамина и серотонина, а также глутаматных рецепторов NMDA и АМРА. Были проведены сотни клинических испытаний, направленных на поиск способов лечения болезни Альцгеймера, однако исследователям удалось добиться скромных успехов (Knight et al., 2018).
в) Болезнь Паркинсона. Болезнь Паркинсона — еще одно большое нейрокогнитивное расстройство, сопровождающееся замедлением движений и связанное с различными двигательными, эмоциональными и когнитивными нарушениями. Болезнь Паркинсона поражает до 1% населения. Поскольку заболевание значительно чаще возникает в пожилом возрасте, в ближайшие десятилетия показатели заболеваемости, вероятно, будут расти в связи со старением населения. Заболевание связано с дегенерацией черной субстанции и соответствующим снижением уровня вырабатываемого в черной субстанции и высвобождаемого в стриатуме нейромедиатора дофамина. Таким образом, изучение заболевания позволяет получить представление об участии черной субстанции и дофамина в управлении движением.
Сложность изучения данного неврологического расстройства обусловлена огромным разнообразием симптомов болезни Паркинсона. Основной причиной заболевания является дегенерация определенной группы клеток, однако заболевание также поражает многие другие области мозга, поэтому симптомы у разных пациентов различаются. Многие симптомы удивительно похожи на изменения двигательной активности, возникающие в результате старения. Таким образом, изучение болезни Паркинсона позволяет получить представление о более общей проблеме возрастных изменений в нервной системе.
Первые симптомы практически незаметны часто это тремор в одной руке или небольшая скованность в дистальных отделах конечностей. Движения замедляются, а лицо становится маскообразным. В конце концов пациент утрачивает способность моргать, а его лицо кажется лишенным эмоций. Затем спина становится сутулой, походка шаркающей, а неподвижные руки висят вдоль тела. Речь может замедлиться и стать монотонной, а трудности с глотанием могут вызвать слюнотечение. При появлении первых симптомов пациенты часто не обращают на них внимания -они не осознают происходящие с ними изменения.
Несмотря на прогрессирование заболевания, у разных людей ухудшение наступает с разной скоростью. Лишь в редких случаях болезнь прогрессирует настолько быстро, что пациент становится инвалидом в течение 5 лет. Обычно проходит 10-20 лет, прежде чем симптомы приводят к потере трудоспособности. Одной из особенностей болезни Паркинсона является нерегулярность ее проявлений — симптомы могут внезапно появляться и так же внезапно исчезать.
Кратковременная частичная ремиссия также может возникать в ответ на интересную или стимулирующую ситуацию. Невролог Оливер Сакс (Oliver Sacks, 1998) описал случай, когда обездвиженный пациент с болезнью Паркинсона выпрыгнул из инвалидного кресла на берегу моря и бросился в воду, чтобы спасти тонущего человека. Сразу после этого он упал обратно в кресло и вернулся в прежнее неактивное состояние. Ослабление некоторых симптомов в ситуациях, требующих активных действий, является обычным делом, однако описанный выше случай отличается особым драматизмом.
Например, такая простая вещь, как звуки знакомой музыки, может заставить обычно неактивного пациента встать и начать танцевать. Или пациент, которому трудно ходить, может, казалось бы, без особых усилий кататься на велосипеде или коньках. Казавшийся обездвиженным пациент может быстро поймать брошенный мяч. Способность пациента реагировать на такие побуждающие к действию стимулы делает возможным применение лечебной физкультуры. Лечебная физкультура очень важна, поскольку она может замедлить прогрессирование заболевания.
Четыре главных симптома болезни Паркинсона — это тремор, мышечная ригидность, снижение спонтанной двигательной активности (гипокинезия) и постуральная неустойчивость (синдром, при котором возникают затруднения в удержании равновесия в определенной позе или при смене нозы). Симптомы могут возникать в разных частях тела в различных комбинациях. Поскольку одни симптомы связаны с аномальным поведением (позитивные симптомы), появившимся в результате болезни, а другие связаны с утратой нормальных форм поведения (негативные симптомы), мы рассмотрим обе основные категории симптомов отдельно.
- ПОЗИТИВНЫЕ СИМПТОМЫ. Считается, что распространенные у пациентов с болезнью Паркинсона позитивные симптомы подавляются у здоровых людей и проявляются у больных благодаря нарушению процессов торможения. Ниже перечислены три наиболее часто встречающихся симптома:
1. Тремор в покое. Дрожание конечностей наблюдается в покое и прекращается при выполнении произвольных движений или во время сна. Тремор рук часто напоминает скатывание пилюль большим и указательным пальцами.
2. Мышечная ригидность. Одновременное повышение тонуса мышц-разгибателей и сгибателей становится особенно заметным во время пассивных движений в суставе. Мышцы сопротивляются движению, однако при приложении значительного усилия мышцы позволяют совершить небольшое движение, а затем движение снова останавливается. Таким образом, пассивное сгибание-разгибание конечности в суставе происходит в несколько этапов — это называют симптомом «зубчатого колеса». Выраженная ригидность может ограничивать все движения -пациент двигается как в замедленной съемке, при этом он не способен двигаться быстрее.
3. Непроизвольные движения. Общее бездействие может сопровождаться небольшими движениями или изменениями позы, которые иногда называют акатизией, или неусидчивостью, часто возникающей без какой-либо видимой причины. Такие движения могут ослаблять тремор и общую скованность. Другие непроизвольные движения — это сохраняющиеся в течение нескольких минут или часов нарушения постуральных рефлексов, аналогичные наблюдаемым при окулогирном кризе (спазм взора, непроизвольное отклонение головы и глазных яблок в сторону).
P.S. Позитивные симптомы — это варианты поведения, которые в норме у человека не наблюдаются.
P.S. Негативные симптомы — это отсутствие типичного поведения или неспособность заниматься какой-либо деятельностью.
- НЕГАТИВНЫЕ СИМПТОМЫ. Тщательно проанализировав негативные симптомы, Жан Пруден Мартен (Jean Prudin Martin, 1967) разделил симптомы пациентов с тяжелой болезнью Паркинсона на пять групп:
1. Нарушения позы. Первая подкатегория это нарушения фиксации позы, которые проявляются в неспособности удерживать часть тела в ее нормальном положении по отношению к другим частям тела. Голова пациента может заваливаться вперед, а у стоящего пациента могут подгибаться ноги, из-за чего он в конце концов встает на колени. Вторая подкатегория — это нарушения равновесия и устойчивости, из-за которых пациент зачастую не может стоять или даже сидеть без поддержки. В менее тяжелых случаях пациентам трудно стоять на одной ноге, а если такого пациента слегка толкнуть в спину, он может упасть, не предприняв никаких попыток предотвратить падение.
2. Нарушения при изменении положения тела. Пациент не может встать из положения лежа на спине. Пациенты с запущенным заболеванием с трудом могут перевернуться.
3. Двигательные нарушения. Нормальная локомоторная функция обеспечивает удержание тела от действия силы тяжести, позволяет человеку ходить, обеспечивает сохранение равновесия при переносе тяжести тела с одной ноги на другую, а также продвижение вперед. При ходьбе пациентам с болезнью Паркинсона трудно начать движение, они передвигаются шаркающей походкой, довольно широко расставляя ноги, поскольку им трудно сохранять равновесие при переносе тяжести тела с одной ноги на другую. Для пациентов с болезнью Паркинсона характерна семенящая походка — они шагают все быстрее и быстрее, в конце концов переходя на бег.
4. Речевые нарушения. Одним из наиболее заметных для родственников симптомов является практически полное отсутствие выразительности в речи пациента.
5. Гипокинезия. Снижение спонтанной двигательной активности может проявляться бедностью реакции лицевой мимики, редким морганием или уменьшением размахивания руками при ходьбе, отсутствием спонтанной речи или нормальных попыток сменить позу. Акинезия также проявляется трудностями при выполнении повторяющихся движений (например, постукивания) даже в отсутствие мышечной ригидности. У пациентов, которые часами сидят неподвижно, гипокинезия проявляется особенно ярко.
Принцип 10. Нервная система функционирует благодаря чередованию процессов возбуждения и торможения.
- КОГНИТИВНЫЕ СИМПТОМЫ. Хотя болезнь Паркинсона обычно рассматривают как двигательное расстройство, она также сопровождается изменения ми когнитивных функций. Нервно-психические симптомы, встречающиеся у пациентов с болезнью Паркинсона, не менее разнообразны, чем двигательные. Тем не менее у многих пациентов возникают когнитивные симптомы, связанные с эмоциями, памятью и мыслительными процессами. Пациенты могут часами сидеть, по-видимому, не имея желания начинать или продолжать какую-либо деятельность. Наблюдается общее замедление мыслительных процессов. Болезнь Паркинсона часто причисляют к нейрокогнитив-ным расстройствам, поскольку пациенты не воспринимают содержание беседы. Это может быть связано со значительным замедлением процессов обработки информации.
P.S. Снижение когнитивных функций у пациентов с болезнью Паркинсона имеет ряд общих черт с когнитивными нарушениями, наблюдаемыми при болезни Альцгеймера.
- ЭТИОЛОГИЯ ПАРКИНСОНИЗМА. Причиной болезни Паркинсона является утрата клеток черной субстанцией, которая может быть следствием заболевания (например, энцефалита или сифилиса) или воздействия препарата (например, МФТП). В ряде случаев причины остаются неизвестными. Идиопатический (спонтанно возникший) паркинсонизм может быть обусловлен загрязнением окружающей среды, воздействием инсектицидов и гербицидов, а также генетическими факторами. Изучение демографических данных пациентов, столкнувшихся с болезнью в относительно молодом возрасте, позволило предположить, что в воде и воздухе могут содержаться токсины, которые по своему действию похожи на МФТП (1-метил-4-фенилпиридиний) — примесь, которая встречается в синтетическом героине и вызывает болезнь Паркинсона.
- ЛЕЧЕНИЕ БОЛЕЗНИ ПАРКИНСОНА. Лечение болезни Паркинсона должно либо останавливать дегенерацию клеток черной субстанции, либо обеспечивать замену этих клеток. Но до сих пор не удалось достичь ни одной из указанных целей. В настоящее время применяют медикаментозное лечение, направленное на обеспечение поддержки и комфорта.
Психологические факторы влияют на основные симптомы болезни Паркинсона, а исход заболевания зависит от усилий самого пациента. Пациентам следует как можно раньше обратиться за лечением, ориентированным на изменение поведения, а также за консультированием по симптомам и природе заболевания — это даст им возможность прожить долгую продуктивную жизнь. Физиотерапия предполагает применение простых методов, таких как прогревание и массаж, для облегчения болезненных мышечных спазмов, а также упражнений, чтобы справиться с двигательными нарушениями. Применение музыки и физических упражнений в терапевтических целях позволяет улучшить целый ряд аспектов поведения, в т. ч. равновесие и походку, и замедлить прогрессирование заболевания.
Медикаментозное лечение направлено прежде всего на повышение активности оставшихся дофаминергических синапсов. Предшественник дофамина L-ДОФА в мозге преобразуется в дофамин, обеспечивая повышение эффективности дофаминовой передачи и таким образом ослабляя симптомы заболевания. Такие препараты, как амантадин, амфетамин, ингибиторы моноаминоксидазы и трициклические антидепрессанты, могут стимулировать оставшиеся дофаминергические нейроны, что также способствует ослаблению симптомов. Антихолинергические препараты, такие как атропин, скополамин, бензтропин (Cogentin) и тригек-сифенидил (Artane), блокируют холинергические системы мозга, повышенная активность которых наблюдается в отсутствие нормальной активности дофаминовой системы.
Следует отметить, что по мере прогрессирования заболевания медикаментозная терапия становится все менее эффективной, поскольку остается все меньше дофаминергических нейронов, которые можно стимулировать. Одним из последствий уменьшения доступности дофамина является увеличение количества рецепторов дофамина. Поэтому действие оставшегося дофамина на большее количество рецепторов приводит к появлению побочных эффектов, в т. ч. двигательных нарушений. В случае возникновения тяжелых побочных эффектов терапия, направленная на стимуляцию выброса дофамина, перестает приносить пользу. Есть данные о том, что препараты, стимулирующие напрямую дофаминовые рецепторы, приводят к повышению сексуальной активности и увеличению числа случаев патологического пристрастия к азартным играм.
Причиной этого также является избыток рецепторов.
Применение хирургических методов лечения возможно благодаря тому, что повышенная активность нейронов бледного шара подавляет двигательную функцию. Повреждение внутренней части бледного шара позволяет уменьшить мышечную ригидность и тремор. Гиперактивность нейронов бледного шара можно уменьшить хирургическим способом посредством электростимуляции нейронов (глубинная стимуляция мозга, см. рис. 5).
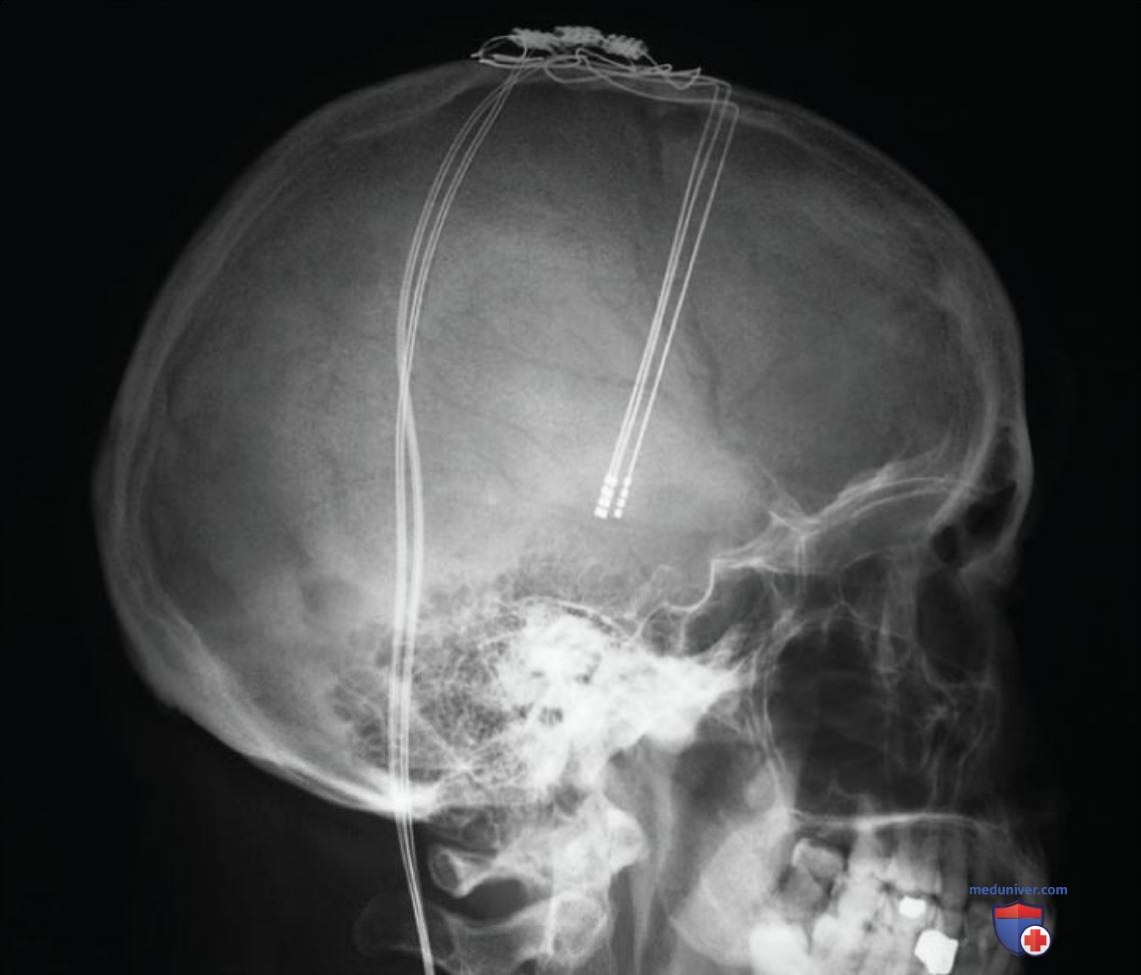
Стимулирующий электрод имплантируют в бледный шар или соседнюю область — субталамическое ядро. Пациенты носят с собой небольшой портативный электростимулятор, который можно включать, чтобы провести глубинную стимуляцию мозга и таким образом уменьшить мышечную ригидность и тремор. Возможно последовательное применение описанных методов: если при прогрессировании заболевания эффективность глубинной стимуляции мозга начинает снижаться, можно применить хирургическую деструкцию бледного шара.
Перспективный метод лечения болезни Паркинсона предполагает увеличение популяции вырабатывающих дофамин клеток. Для этого можно использовать трансплантацию зародышевых дофаминовых клеток в базальные ядра. В 1980-х и 1990-х гг. такое лечение применяли в той или иной мере успешно. Однако результаты исследования последствий такого лечения не вызывают доверия по причине использования неадекватных методов оценки на этапе подготовки исследования и интерпретации его результатов. Новые методы лечения предполагают либо трансплантацию стволовых клеток, способных впоследствии превратиться в дофаминергические нейроны, либо стимуляцию миграции эндогенных стволовых клеток в базальные ядра.
Преимущество метода состоит в том, что стволовые клетки могут быть получены не только из эмбриональной ткани. Они могут быть взяты из различных источников, в т. ч. из организма пациента.
Все рассмотренные методы лечения являются экспериментальными. Увлекательную историю исследований рассказывают пионеры этой отрасли, Бьерклунд и Линдвалл (Bjorklund, Lindvall, 2017). Для того чтобы метод трансплантации клеток начал приносить пользу, необходимо решить несколько вопросов — определиться с источником клеток и областью для вживления в мозге, а также обеспечить встраивание новых клеток в существующие нейронные сети мозга. Стволовые клетки не позволяют быстро излечить болезнь Паркинсона, однако инновационные исследования по использованию стволовых клеток при этом заболевании в будущем могут способствовать применению этой технологии и при других заболеваниях.
г) Могут ли все нейрокогнитивные расстройства быть проявлениями одного заболевания? Ни болезнь Паркинсона, ни болезнь Альцгеймера не связаны с какой-либо одной структурой или областью мозга, хотя они в наибольшей степени затрагивают дофаминовую систему в первом случае и ацетилхолиновую систему во втором. Общие черты в патогенезе этих заболеваний указывают на участие некоего общего нейродегеиеративного процесса. Дональд Калн (Donald Caine; Caine & Mizuno, 2004) отметил, что ученые, уехавшие на Гуам в конце Второй мировой войны, чтобы исследовать широко распространенную форму деменции, которую считали похожей на болезнь Альцгеймера, на самом деле выявили высокую заболеваемость болезнью Альцгеймера. Много лет спустя Калн и его коллеги, эксперты по болезни Паркинсона, обследовали ту же самую группу пациентов и выяснили, что они страдают болезнью Паркинсона.
Калн отметил: «Если вы будете искать у пациентов болезнь Альцгеймера, вы найдете ее, но не заметите симптомы болезни Паркинсона, и наоборот».
Главным признаком, объединяющим эти два заболевания, является наличие телец Леви (рис. 3) — сферических цитоплазматических нейронных включений. Считается, что причиной их образования являются нарушения метаболизма нейрофиламентов. До недавнего времени тельца Леви чаще всего обнаруживали в области черной субстанции среднего мозга и считали характерным признаком болезни Паркинсона. При этом амилоидные бляшки считали маркером болезни Альцгеймера. В действительности тельца Леви образуются при различных нейрокогнитивных расстройствах, в том числе и при болезни Альцгеймера. Описаны случаи пациентов с нейрокогнитивными расстройствами альцгеймеровского типа, у которых не было амилоидных бляшек и нейрофибриллярных клубков, зато было обнаружено множество телец Леви в коре больших полушарий.
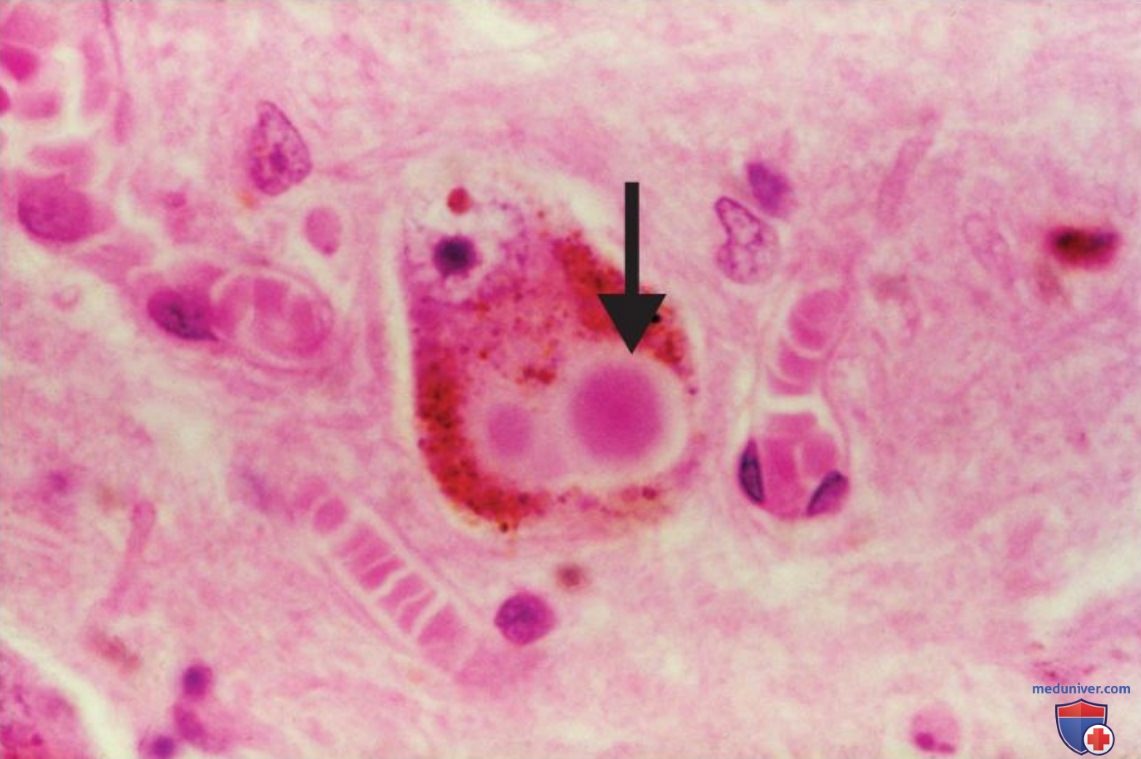
д) Прионная теория прогрессирующих нейрокогнитивных расстройств. Сходство симптомов болезни Альцгеймера и болезни Паркинсона может быть обусловлено одинаковой этиологий заболеваний. Идея о том, что несколько дегенеративных заболеваний мозга (в т. ч. болезнь Гентингтона, PC и БАС) могут быть обусловлены одними и теми же причинами, легла в основу прионной теории (прионы — инфекционные белковые частицы), предложенной в 1982 г. Стенли Прузинером (Stanley В. Prusiner). За свои работы в 1997 г. Стенли Прузинер получил Нобелевскую премию. Прион — это белок с аномальной третичной структурой, который катализирует аналогичное изменение структуры гомологичных нормальных белков (рис. 4). Неправильно свернутые молекулы менее функциональны.
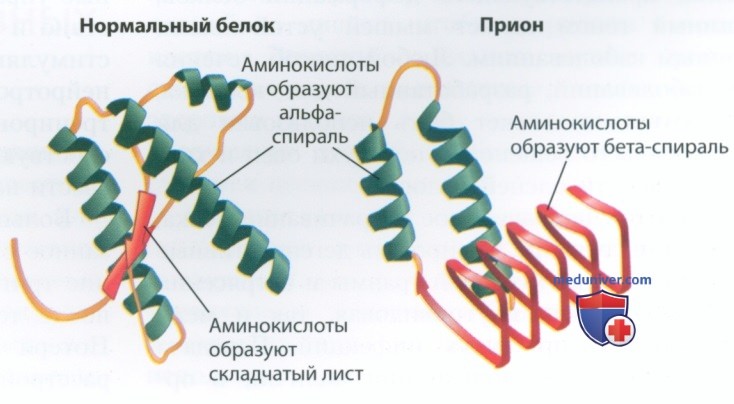
Прионы склонны образовывать белковые агрегаты, которые приводят к гибели клеток. Прионы также могут инфицировать соседние клетки мозга и остального организма, что приводит к дегенерации мозга и атрофии мышц. Такое распространение инфекции вызывает прогрессирующие нейродеге-неративные заболевания. Прионные заболевания могут быть наследственными или спонтанными, а также возникать в результате травм или употребления содержащей прионы пищи.
Прионы были идентифицированы при изучении нейродегенеративных заболеваний человека и других животных. Болезнь Крейтцфельдта—Якоба, редкое, стремительно прогрессирующее дегенеративное заболевание человека, получила широкую известность в 1990-х гг. Люди заболевали этой болезнью после употребления в пищу мяса коров, у которых наблюдались симптомы нейродегенеративного заболевания губчатой энцефалопатии крупного рогатого скота (коровьего бешенства), сопровождающейся атрофией мышц. Коровье бешенство, в свою очередь, похоже на заболевание, называемое скрепи, или почесухой овец (больные животные часто чешутся), также приводящее к атрофии мозга и тела. Хронической слабостью называют схожее заболевание оленей и лосей.
Инфекционный характер одного из таких заболеваний удалось выявить в 1950-х гг. в процессе изучения болезни аборигенов племени форе, живущих в Папуа—Новой Гвинее. Многие в племени форе умирали от болезни, приводящей к атрофии мышц, называемой «куру» (в переводе с местного языка «куру» означает «трястись»). Оказалось, что заражение происходило при ритуальном каннибализме — форе поедали мозг умерших родственников (некоторые из них умерли от куру), так как верили, что таким образом защищают свои души. В рамках эксперимента по изучению заболевания останками жертв куру кормили шимпанзе, который заразился этой болезнью. Возбудителем заболевания является прион.
Есть предположение, что болезнь Паркинсона может быть связана с аномальным сворачиванием белка альфа-синуклеина. Он накапливается прежде всего в клетках черной субстанции, образуя тельца Леви. При болезни Альцгеймера накапливающийся белок образует амилоидные бляшки, поражая в основном клетки коры больших полушарий. Белки с аномальной третичной структурой в олигодендроглии могут быть причиной демиелинизации, характерной для PC и БАС.
Прионная теория открывает новые горизонты для поиска способов лечения нейродегенеративных заболеваний, в том числе для разработки препаратов, удаляющих прионы, препятствующих их образованию или меняющих структуру белков, у которых часто возникают аномалии третичной структуры (Ullah & Khan, 2018). Кроме того, устойчивость к нейродегенеративпым заболеваниям, может быть, неким образом связана с некоторыми атрибутами образа жизни, в том числе здоровым питанием, физическими упражнениями и образованием, помогающими организму противостоять формированию прионов и их последствиям. Для выведения крупного рогатого скота, не несущего аллелей, кодирующих аномальные формы белков, применяют селекцию — это позволяет предотвратить заболевание коровьим бешенством.
Внедрение человеческого аллеля, препятствующего деформации белков, в мышиный геном делает мышей устойчивыми к прионным заболеваниям. Любой способ лечения данных заболеваний, разработанный для человека, предположительно, может быть использован для лечения коровьего бешенства, почесухи овец и хронической слабости оленей и лосей.
Предотвратив неправильное сверачивание белка, можно, хотя бы отчасти, купировать дегенеративные последствия черепно-мозговой травмы и сотрясения мозга. Возможна как внутривидовая, так и межвидовая передача прионных инфекций. Передача инфекции происходит только при наличии в организмах животных схожих нормальных белков. Исследования показали, что среди продуктов разных аллелей одного и того же гена некоторые белки в большей степени склонны к неправильному сворачиванию, чем другие. Индивиды, несущие аллели, продукты которых не подвержены неправильному сворачиванию (например, аборигены из племени форе, которые не заразились куру), обладают устойчивостью к прионным заболеваниям.
е) Возрастное снижение когнитивных функций. У большинства доживших до старости людей не развиваются нейрокогнитивные расстройства. При этом практически у всех наблюдается возрастное снижение когнитивных функций — даже у тех, кто ведет активную, здоровую и продуктивную жизнь. Старение сопровождается возникновением нарушений восприятия (в особенности зрительного, слухового и обонятельного), а также, угасанием двигательных, когнитивных и исполнительных (планирование) функций. Пожилые люди, как правило, медленнее учатся и не достигают такого же уровня владения новыми навыками, как более молодые.
Исследования с применением неинвазивных методов нейровизуализации показали, что старение связано с уменьшением объема белого вещества, вероятно, по причине утраты миелина. Это поддается коррекции. Доказательств потери нейронов при типичном старении мало, хотя снижение нейрогенеза в гиппокампе действительно происходит. По сравнению с более молодыми, у пожилых людей, как правило, наблюдается активация более обширных областей, отвечающих за внимание и исполнительные функции сетей (теменная и префронтальная кора) при выполнении тестов для оценки сложных когнитивных и исполнительных функций. Такая усиленная активация коррелирует со снижением производительности при выполнении тестов на рабочую память, на внимание и исполнительные функции.
Доказано, что возрастное снижение функций можно замедлить. Первый способ — это аэробные упражнения, позволяющие улучшить самочувствие и усиливающие пластичность мозга за счет стимуляции нейрогенеза, глиогенеза и выработки нейротрофических факторов. Второй способ — это тренировка мозга с использованием стратегий, способствующих нейропластичности и позволяющих свести на нет эффект выученного неиспользования.

Большинству из нас знакомо раздражение, связанное с потерей навыка (это может быть как знание тригонометрии, так и умение играть в теннис) после того, как мы перестаем его практиковать. Потеря навыка не связана с нейрокогнитивным расстройством — она возникает исключительно из-за его неиспользования. Программы тренировки, направленные на стимуляцию пластичности соответствующих мозговых сетей, включают в себя когнитивные тренировки, а также развитие двигательного, слухового или зрительного внимания. Методы тренировки мозга предназначены для стимуляции пластичности, а не для восстановления утраченных функций.
Связанные со старением изменения мозга следует рассматривать в контексте старения всего организма. Например, нейрокогнитивное расстройство может быть проявлением хронического цереброваскулярного заболевания, высокого артериального давления. Подъем артериального давления может привести к микрокровоизлияниям в головном мозге, прежде всего в белом веществе. Возникающие в течение многих лет или даже десятилетий микрокровоизлияния имеют кумулятивный эффект -со временем они все больше и больше нарушают когнитивные функции. Сначала может возникнуть легкое когнитивное расстройство, которое медленно прогрессирует вследствие кумулятивного эффекта микрокровоизлияний, в конце концов превращаясь в нейрокогнитивное расстройство. Именно поэтому здоровый образ жизни, способствующий поддержанию здоровья тела, также помогает сохранить здоровье мозга.
- Читать далее "Лечение нейрокогнитивных расстройств - с точки зрения нейрофизиологии"
Редактор: Искандер Милевски. Дата публикации: 13.12.2023
- Поведенческие расстройства - с точки зрения нейрофизиологии
- Расстройства шизофренического спектра - с точки зрения нейрофизиологии
- Аффективные расстройства - с точки зрения нейрофизиологии
- Черепно-мозговые травмы (ЧМТ) - с точки зрения нейрофизиологии
- Инсульт - с точки зрения нейрофизиологии
- Эпилепсия - с точки зрения нейрофизиологии
- Рассеянный склероз (РС) - с точки зрения нейрофизиологии
- Нейрокогнитивные расстройства - с точки зрения нейрофизиологии
- Лечение нейрокогнитивных расстройств - с точки зрения нейрофизиологии
- Проблемы исследований поведенческих расстройств - с точки зрения нейрофизиологии
- Резюме по поведенческим расстройствам - с точки зрения нейрофизиологии
