Пренатальное и постнатальное развитие сердечно-сосудистой системы
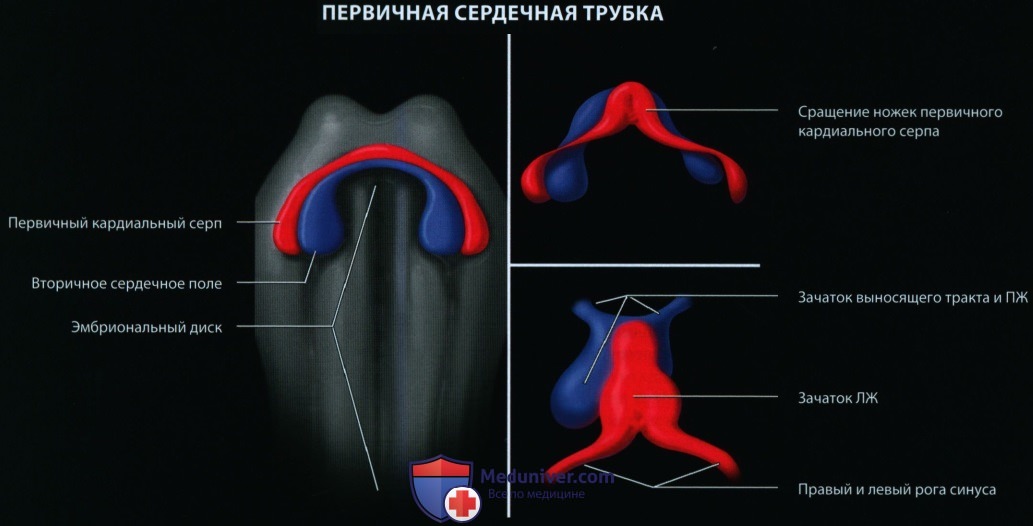
а) Формирование сердечно-сосудистой системы у эмбриона. Сердце — первый функциональный орган эмбриона, который формируется между 2-й и 8-й неделями беременности. На 15-й день мезодерма дифференцируется из эктодермы и дает начало прямой сердечной трубке, которая формирует предсердия, желудочки, луковицу сердца и артериальный ствол. Примитивная сердечная трубка начинает биться на 23-й день, а на 30-й день дает начало эмбриональному кровообращению.
Различные факторы, включающие разные темпы роста, сужения на местах будущих структур, генетические факторы, клеточную дифференцировку, воздействия окружающего перикарда и клеток шаперона невральной пластинки, в течение последующих нескольких недель формируют сердце.
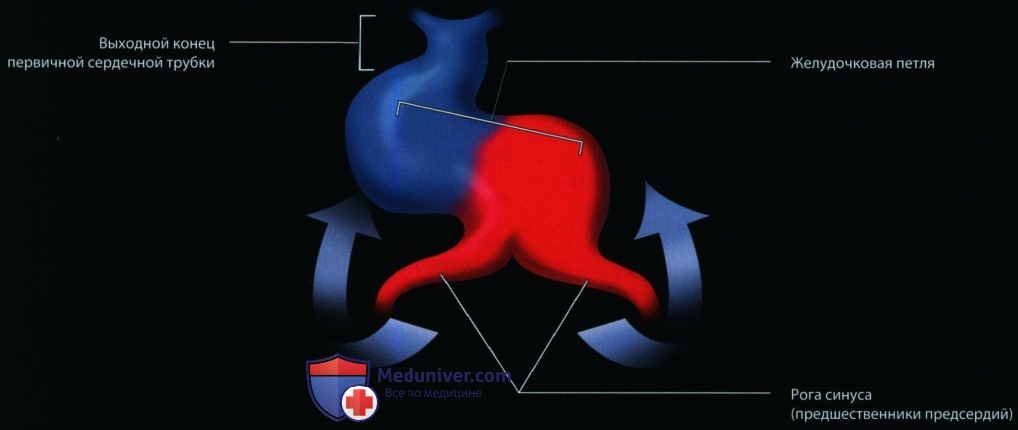
За следующие 4—6 нед структура сердца формируется почти полностью до состояния, которое сохраняется в таком же виде до конца беременности. За счет формирования сердечной петли на 21-й день происходит изгиб примитивной сердечной трубки на себя, что приводит к перемещению формирующихся камер сердца и периферических сосудов в их будущее взаиморасположение.
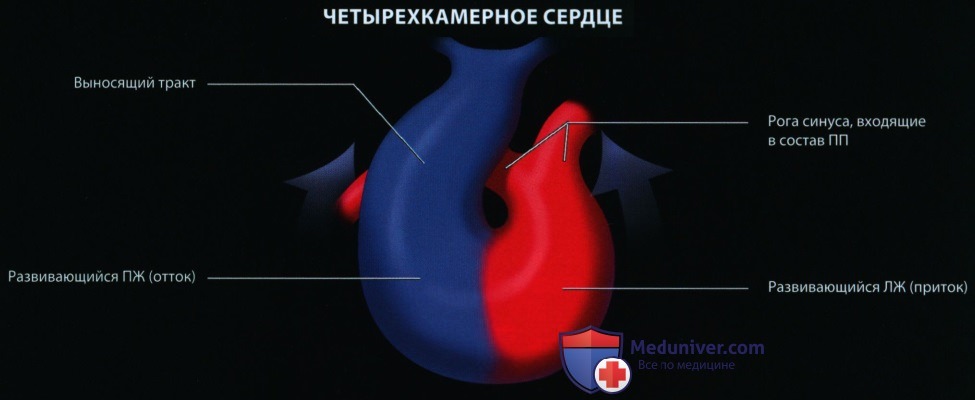
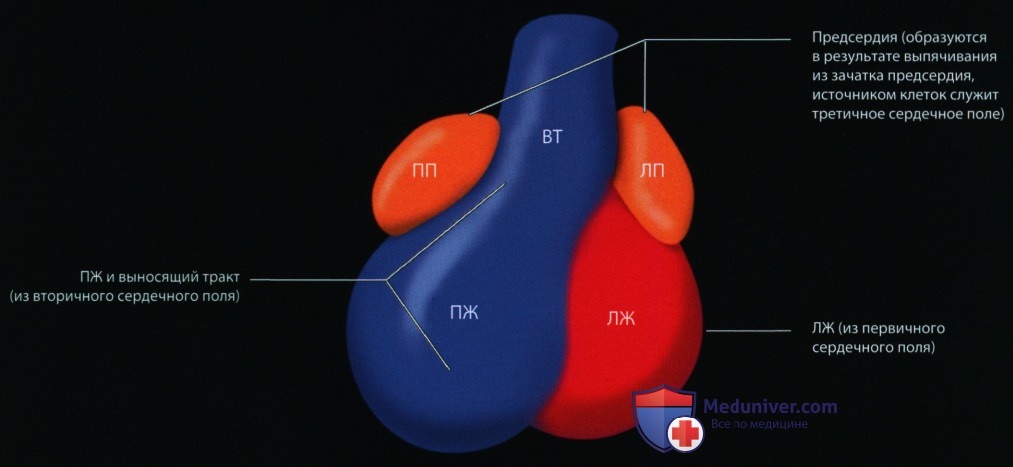
Последующее развитие включает образование перегородок и формирование камер и клапанов сердца, легочно-сосудистой системы, проводящей системы и системы коронарных артерий, септацию и формирование путей оттока и крупных артерий. Неправильное развитие сердца, приводящее к ВПС, вероятнее всего происходит из-за сложных взаимодействий генетических факторов и факторов окружающей среды в период внутриутробного развития. Дальнейшее обсуждение эмбриологии выходит за рамки этой главы, но заинтересованный читатель может найти в литературе превосходные обзоры на эту тему.
б) Постнатальное развитие сердечно-сосудистой системы. Несмотря на то что механика сокращения миокарда в эмбриональном состоянии качественно не отличается от таковой в детстве, существует несколько немаловажных различий, которые влияют на функцию сердца в целом. По сравнению со взрослым незрелый миокард новорожденного не может осуществлять ту же самую силу сокращений.
Миокард новорожденного состоит из меньшего количества сокращающихся элементов и большего количества соединительной ткани, чем у взрослых, при этом миофибриллы в миокарде новорожденного менее организованы. Для сократимости он использует большее количество внеклеточного кальция по сравнению с непосредственным выходом кальция и захватом саркоплазматическим ретикулумом у взрослых, что объясняет повышенную чувствительность младенцев к гипокальциемии при быстрой трансфузии препаратов крови.
Дополнительные причины меньшей сократительной способности миокарда в период новорожденности включают незрелость сократительных белков, неэффективное аккумулирование и использование энергии и незрелость регуляции потенциала действия в сравнении со взрослыми.
Традиционно считалось, что сердечный выброс новорожденного прежде всего зависит от ЧСС, но это представление было опровергнуто. Сердце новорожденного действительно отвечает на изменение пред- и постнагрузки, но этот эффект не так выражен, как у взрослых. Низкая растяжимость желудочков и, вероятно, очень узкая кривая Франка—Старлинга предрасполагают сердце новорожденного к меньшей возможности изменять сердечный выброс за счет ударного объема, пост- и преднагрузки, что выражается в большей зависимости сердечного выброса от ЧСС.
В целом из-за высоких метаболических потребностей сердца и других развивающихся тканей сердце новорожденного большую часть времени работает в режиме практически максимальной интенсивности.
Сердце новорожденного и даже эмбриона отвечает на стимуляцию симпатической нервной системы. Симпатическая иннервация сердца, однако, при рождении недоразвита. В этом периоде доминирует парасимпатическая иннервация, приводящая к повышению вагусных реакций на множество различных стимулов. Симпатическая нервная система созревает в более позднем грудном возрасте.
Видео эмбриогенез (развитие) сердца и его аномалии
- Читать далее "Фетальное, переходное и взрослое кровообращение"
Редактор: Искандер Милевски. Дата публикации: 17.11.2022
- Трахеобронхиальные нарушения при анестезии у детей
- Болезни паренхимы легких при анестезии у детей
- Рестриктивные дыхательные расстройства при анестезии у детей
- Пренатальное и постнатальное развитие сердечно-сосудистой системы
- Фетальное, переходное и взрослое кровообращение
- Влияние анестетиков на сердечно-сосудистую систему
- Влияние вазоактивных препаратов на сердечно-сосудистую систему
- Сердечно-сосудистые эффекты при ингаляционной анестезии у детей
- Вазоактивные лекарственные препараты при анестезии у детей
- Цианотические пороки сердечно-сосудистой системы при анестезии у детей
