Причины и механизмы развития аневризмы брюшной аорты
Термин «аневризма аорты» означает патологическое расширение нормального аортального просвета, вовлекающее один или несколько сегментов. Общепринятого критерия патологического расширения аорты (Ао) нет, но чаще всего аневризмой аорты (Ао) считают постоянное ограниченное расширение, имеющее диаметр по крайней мере в 1,5 раза больше, чем диаметр данного сегмента аорты (Ао) в норме.
Аневризмы обычно описывают по локализации, размеру, морфологическому виду и происхождению. Морфологически аневризма Ао обычно бывает либо веретенообразной (наиболее частая форма), либо мешотчатой. Веретенообразная аневризма имеет довольно однородную форму с симметричным расширением, в которое вовлекается стенка Ао по всей окружности. Мешотчатая аневризма имеет более ограниченное расширение в виде выпячивания только части стенки Ао.
Кроме того, встречается псевдоаневризма (ложная аневризма) аорты (Ао), которая фактически является не аневризмой, а скоплением крови и соединительной ткани снаружи сосудистой стенки. Этот дефект может быть результатом ограниченного разрыва стенки Ао.
Наличие аневризмы аорты (Ао) может свидетельствовать о более распространенном заболевании аорты (Ао). Приблизительно 13% пациентов с диагнозом «аневризма аорты» имеют множественные аневризмы; например, у пациентов с аневризмами грудного отдела Ао в 25-28% случаев выявляют сопутствующие аневризмы брюшного отдела Ао. В связи с этим у пациента с аневризмой Ао любой локализации следует обследовать всю Ао для выявления других аневризм.
Аневризмы брюшного отдела аорты (Ао) встречаются намного чаще, чем аневризмы грудного отдела. Наиболее важным ФР развития аневризм брюшного отдела является возраст. Частота возникновения аневризм брюшного отдела Ао быстро растет среди мужчин > 55 лет и женщин > 70 лет. Аневризмы брюшного отдела Ао встречаются в 5-10 раз чаще у мужчин, чем у женщин. При скрининговом УЗИ у 5% мужчин в возрасте > 65 лет обнаруживают аневризмы брюшного отдела аорты (Ао).
Истинную распространенность аневризм этой локализации установить трудно, т.к. результаты могут различаться в 10 раз и во многом зависят от диагностических критериев, используемых методов визуализации, возраста, иола и исходных ФР исследуемой популяции. Количество выявлений аневризм брюшного отдела Ао за последние 30 лет увеличилось в 4 раза. В некоторой степени это отражает более широкое распространение скринингового метода и частое применение КТ брюшной полости, при которой аневризмы Ао выявляют случайно, когда выполняют исследование с другими диагностическими целями. Тем не менее эти данные лишь частично отражают истинную распространенность аневризм.
Чаще всего аневризмы брюшного отдела аорты (Ао) локализуются ниже отхождения почечных артерий; эти аневризмы называют инфраренальными. Только незначительное количество аневризм возникает на границе между диафрагмой и почечными артериями; эти аневризмы называют супраренальными. В результате нарушения кровотока через пораженный аневризмой сегмент Ао кровь может застаиваться вдоль стенок и способствовать формированию пристеночного тромба.
Такой тромб, а также фрагменты атеросклеротической бляшки (АБ) могут давать эмболии и способствовать нарушению кровотока в дистальных артериях. Однако главная опасность аневризм брюшного отдела Ао заключается в их разрыве. 80% аневризм разрываются в ретроперитонеальном пространстве, которое может сдерживать разрыв, из оставшихся аневризм большинство разрывается в брюшную полость и вызывает неконтролируемую кровопотерю и быструю сосудистую недостаточность.
Целый ряд факторов риска (ФР) способствует развитию аневризм. Курение наиболее убедительно ассоциируется с аневризмами брюшного отдела Ао, следующими ФР являются мужской пол, возраст, АГ, ГЛП и атеросклероз. Продолжительность курения также связана с риском аневризмы брюшного отдела Ао, однако интенсивность курения, т.е. количество выкуриваемых сигарет при контроле длительности курения, на риск не влияет. Курение также увеличивает риск расширения аневризмы и ее разрыва.
Вероятность наличия аневризмы диаметром > 4 см в брюшном отделе Ао в 10 раз выше у мужчин, чем у женщин. Однако у женщин с аневризмами риск разрыва достоверно выше, чем у мужчин. Лица с аневризмами брюшного отдела Ао в семейном (первой линии родства) анамнезе имеют повышенный риск: родные братья и сестры тех, у кого диагностирована аневризма Ао, имеют риск, равный 19%, по сравнению с 2-5% в общей популяции. Кроме того, пациенты с аневризмами в семейном анамнезе более молодые и имеют более высокую частоту разрыва аневризм, чем лица со спорадическими аневризмами. Данные результатов генеалогического анализа и тот факт, что пока еще не установлен дефект определенного гена, свидетельствуют, что повышенный риск является, вероятно, полигонным.
Аортальная стенка резистентна к расширению из-за устойчивости ее внеклеточного матрикса, в частности эластина и коллагена. Деградация этих структурных белков, обусловленная любым ФР, в конечном итоге ослабляет аортальную стенку и способствует развитию аневризм. По мере расширения Ао напряжение в сосудистой стенке растет в соответствии с законом Laplace (напряжение пропорционально произведению давления и радиуса). Дальнейшее расширение приводит к еще большему напряжению стенки Ао и ускоренному росту аневризмы. В результате возникает порочный круг, в котором дилатация часто быстро прогрессирует.
Традиционно атеросклероз считают главной причиной развития аневризмы брюшного отдела аорты (Ао). Инфраренальный отдел Ао наиболее часто поражается атеросклеротическим процессом, поэтому является обычным местом формирования аневризмы; только часть аневризм являются супраренальными и, как правило, возникают вследствие расширения торакоабдоминальной аневризмы грудного отдела Ао. Атеросклеротический процесс реже поражает грудной отдел Ао. Атеросклеротическое поражение Ао может вызвать либо стенотическую обструкцию (процесс, который ограничен инфраренальным отделом Ао), либо аневризматическую дилатацию; какой процесс будет преобладающим у данного индивидуума, неизвестно.
Ясно, что атеросклероз Ао способствует развитию этого процесса, но продолжающиеся исследования свидетельствуют о многофакторном патогенезе аневризм брюшного отдела Ао. Генетические факторы, факторы окружающей среды, гемодинамические и иммунологические факторы — все они вносят свой вклад в развитие и прогрессирование аневризм. Одно время полагали, что атеросклероз и воспаление аневризм брюшного отдела Ао — разные состояния, по в наши дни стало ясно, что они имеют общую патофизиологию (воспаление аневризм — это, скорее всего, крайнее состояние атеросклеротических аневризм).
Воспаление в стенке Ао может способствовать деградации внеклеточного матрикса (основного межклеточного вещества ткани). Существуют гистологические доказательства наличия воспалительных инфильтратов, в частности макрофагов и Т-лимфоцитов, внутри медии и адвентиции аневризм, что свидетельствует о первичном воспалении как реакции на неизвестные стимулы. Инфекция — одна из возможных причин, т.к. в некоторых исследованиях выявлены вирусные или бактериальные антигены в тканях стенки аневризмы.
Какой бы ни был стимул, макрофаги и Т-лимфоциты продуцируют протеолитические ферменты, которые разрушают эластин, коллаген и другие белки матрикса аортальной стенки. Однако следует отметить, что существует также конкурентный синтез белка, поэтому в конечном счете процесс является динамическим балансом между разрушением и синтезом, ведущим к ремоделированию стенки Ао. Т-лимфоциты могут вызвать апоптоз ГМК в стенках аневризмы. Поскольку ГМК продуцируют эластин и коллаген, потеря клеток может вести к нарушению функции поддержания и восстановления внеклеточного матрикса на фоне продолжающейся его деградации.
Матриксными металлопротеиназами являются цинк- и кальций-зависимые ферменты, которые продуцируются ГМК и воспалительными клетками, причем некоторые из этих протеиназ могут принимать участие в образовании аневризм брюшного отдела Ао. Действительно, определенные матриксные металлопротеиназы могут разрушать эластин и коллаген, основные компоненты внеклеточного матрикса стенки Ао. Уровень некоторых магриксных металлопротеиназ (например, ММП-2, ММП-8, ММП-9, ММП-14) достоверно увеличивается в стенках аневризмы по сравнению с контролем. В одном исследовании было обнаружено, что уровень ММП-9 (отражение информационной рибонуклеиновой кислоты) в 4 раза выше в больших (5,0-6,9 см) аневризмах, чем в малых (3,0-4,9 см).
Уровни циркулирующих ММП-9 повышаются у > 50% пациентов с аневризмами брюшного отдела Ао, а затем снижаются после хирургического или эндоваскулярного устранения аневризм. Недавнее исследование разорвавшихся аневризм выявило, что уровни ММП-8 и ММП-9 были достоверно выше в месте разрыва по сравнению с неразорвавшейся стенкой. Это позволило предположить, что увеличенный распад коллагена может быть предвестником разрыва. Существуют доказательства связи матриксных металлопротеиназ с образованием аневризм, однако только косвенные. В экспериментальных моделях образования аневризм с повышенными уровнями ММП-2 и ММП-9 мыши с дефицитом ММП-2 и ММП-9 были резистентны к образованию аневризм. Снижение уровня тканевых ингибиторов металлопротеиназ в стенках аневризм может усилить разрушение матрикса матриксными металлопротеиназами.
Фармакологическое ингибирование протеолиза у человека может замедлить скорость роста аневризм. Тетрациклины слабо подавляют матриксные металлопротеиназы через механизм, прямо не связанный с их антибиотической активностью. В моделях аневризмы брюшного отдела Ао на животных терапия производными либо доксициклина, либо тетрациклина без антибиотической активности уменьшала образование в стенке Ао ММП-9, приводила к сохранению эластина в медии и уменьшала аневризматическое расширение.
В одной модели на мышах применение доксициклина уменьшило рост аневризм с 33 до 66% при циркулирующих уровнях доксициклина, аналогичных достижимым у человека при назначении стандартных доз. Обнадеживающими являются данные, полученные в исследованиях с участием людей. Curci J.A. и соавт. обнаружили, что дооперационное лечение доксициклиномper os приводило к снижению в 5 раз уровня ММП-9, экспрессируемой в тканях стенки аневризмы, резецированной во время хирургического вмешательства. В результатах многоцентрового исследования, проведенного Thompson R., сообщается о безопасности продолжительного (6 мес) применения доксициклина (100 мг 2 раза в день) у пациентов с аневризмами брюшного отдела Ао. Кроме этого, лечение приводило к постепенному снижению уровней ММП-9 в плазме.
В относительно небольшом исследовании 92 пациентов терапия рокситромицином в течение 28 сут уменьшала скорость расширения аневризм на 44% в первый год наблюдения, но только на 5% — в следующий год. Chlamydia pneumoniae может способствовать воспалительному процессу, лежащему в основе формирования аневризм. Поскольку доксициклин является эффективным препаратом для лечения инфекции С. pneumoniae, возможно существование другого механизма, с помощью которого препарат сможет замедлять рост аневризм.
Совсем недавно появились данные, что ингибиторы ГМГ-КоА-редуктазы могут предотвращать развитие аневризм. В экспериментах на крысах лечение аневризм симвастатином уменьшало экспрессию ММП-9, увеличивало экспрессию тканевых ингибиторов матриксных металлопротеиназ 1 и сопровождалось сохранением эластина в медии и ГМК в стенке сосуда. Важно, что у мышей с ГХС и без ГХС терапия симвастатином подавляла развитие аневризм Ао. Действительно, у пациентов, подвергавшихся выборочному хирургическому устранению аневризмы брюшного отдела Ао, дооперационная терапия различными статинами сопровождалась снижением уровня ММП-9 в аортальной стенке. В настоящее время проводят клинические исследования, и первые сообщения о результатах многообещающие.
Кроме матриксных металлопротеиназ в образовании аневризм могут принимать участие и другие протеиназы, включая активаторы плазминогена, сериновые эластазы и катепсины. Катепсины S и К являются мощными эластазами, гиперэкспрессируемыми в АБ человека. Повышенные уровни катепсина S были обнаружены как в АБ, так и в аневризмах. Напротив, более низкий уровень цистатина С, эндогенного ингибитора катепсина S, ассоциируется с большими аневризмами и более быстрым их ростом.
Совсем недавно в ткани аневризмы брюшного отдела аорты (Ао) был обнаружен высокий уровень JNK — энзима, который увеличивает деградацию и уменьшает синтез внеклеточного матрикса. Важно отметить, что в экспериментах на мышах селективное подавление JNK не только предупреждало развитие аневризм, но также вызывало регрессию уже существующих.
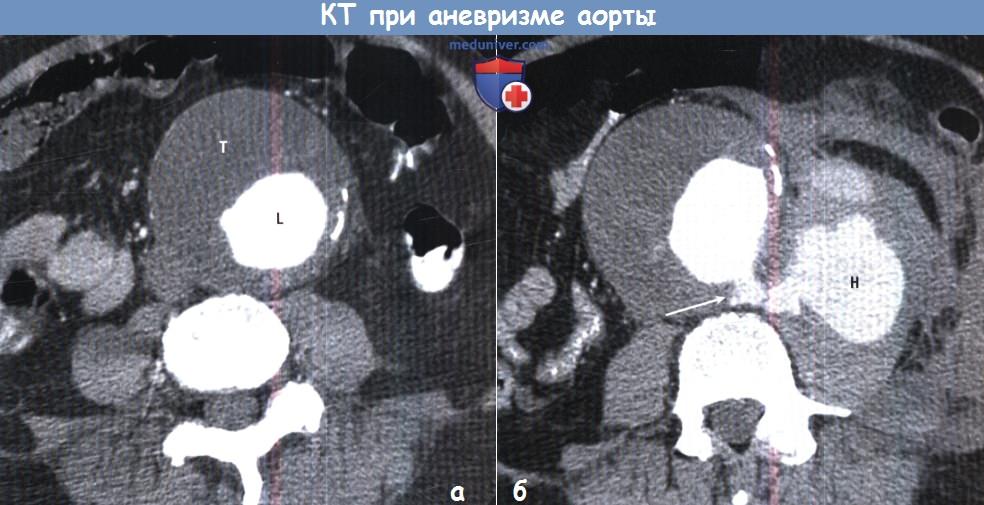
Просвет аневризмы (L) сужен обширным пристеночным тромбом (Т).
(Б) Аналогичная КТ той же аневризмы сразу после ее разрыва (стрелка) в ретроперитонеальное пространство.
Материал высокой плотности изливается из аневризмы в левое околопочечное пространство рядом с ограниченной гематомой (Н).
- Читать "Симптомы и клиника аневризмы брюшной аорты"
Оглавление темы "Аневризма аорты.":- Аорта в норме и ее функции
- Возрастные изменения аорты от старости
- Методы обследования аорты при болезни
- Причины и механизмы развития аневризмы брюшной аорты
- Симптомы и клиника аневризмы брюшной аорты
- Методы обследования при аневризме брюшной аорты
- Каков риск разрыва аневризмы брюшной аорты? Прогноз
- Методы лечения аневризмы брюшной аорты и их эффективность
- Причины и механизмы развития аневризмы грудной аорты
- Симптомы и клиника аневризмы грудной аорты
