Ограничение размера поражения при инфаркте миокарда
Одним из важных прогностических факторов у пациентов с ИМ↑ST является размер поражения при ИМ. Пациенты, у которых причиной летального исхода становится кардиогенный шок, как правило, умирают либо от единственного обширного ИМ, либо в результате поражения малого или среднего размера, но развившегося на фоне множественных предыдущих ИМ.
У больных, переживших обширные ИМ, часто в позднем периоде заболевания снижается функция ЛЖ, а коэффициент смертности в отдаленном периоде выше, чем среди больных с небольшими ИМ, у которых не развивается сердечная декомпенсация.
Концепция ограничения размера поражения при инфаркте миокарда (ИМ) привлекла внимание многих исследователей и клиницистов. Предпринимаемые попытки ограничения размера инфарцированной зоны обусловили развитие нескольких разных, порой продолжающих друг друга подходов:
(1) ранней реперфузии;
(2) снижения энергетических потребностей миокарда;
(3) влияния на источники выработки энергии в миокарде;
(4) предотвращения реперфузионных повреждений миокарда.
Несмотря на преимущества реперфузионной терапии при ИМ↑ST, на практике решение о тактике ведения конкретного пациента является сложным и неоднозначным. Основным фактором, ограничивающим широкое применение реперфузионной терапии при ИМ↑ST, является не вполне ясное понимание соотношения риска и пользы у пожилых пациентов, а также у доставляемых в поздние сроки от начала болевого синдрома.
а) Динамическая природа инфаркта миокарда. ИМ↑ST возникает не одномоментно, а развивается в течение многих часов, т.е. это динамический процесс. Оказать влияние на ишемизированную ткань можно в основном путем сохранения перфузии миокарда, уменьшения микроваскулярного повреждения в зоне ИМ, снижения потребности миокарда в кислороде, предотвращения аккумуляции или увеличения вымывания токсичных метаболитов, увеличения способности субстрата к анаэробному метаболизму или уменьшения повреждающих эффектов медиаторов, которые нарушают структуру и функцию внутриклеточных органелл и клеточных мембран.
Результаты экспериментальных исследований на животных, а также данные, полученные при наблюдении за пациентами, показывают, что ишемическое прекондиционирование — форма эндогенной защиты при ИМ↑ST — до момента формирования окклюзии К А уменьшает размер поражения при ИМ и ассоциируется с более благоприятным прогнозом, а также снижает риск расширения инфарктной зоны и рецидива ишемических событий. Кратковременные эпизоды ишемии в одном из сосудистых бассейнов могут вызывать прекондиционирование миокарда в отдаленной зоне, что обусловливает уменьшение размера поражения при прогрессировании коронарной окклюзии.
Максимальное снижение перфузии миокарда отмечается в момент формирования окклюзии КА. У = 30% пациентов в первые 12-24 час развивается спонтанная реканализация окклюзированной КА. Эта замедленная спонтанная реперфузия можетулучшатьфупкцию ЛЖ за счет ускорения процессов заживления некротизированной ткани, предотвращать ремоделирование миокарда, а также улучшать кровообращение в гибернирующем миокарде.
С целью максимального спасения миокарда у пациентов без спонтанной реперфузии инфаркт-связанной КА разработаны методы фармакологической и интервенционной реперфузионной терапии. Самым важным условием применения реперфузионной терапии является время от начала развития заболевания. Наиболее выраженное снижение показателей смертности при ИМ↑ST отмечается в ранние сроки назначения реперфузии.
Наряду с реперфузионной терапией дополнительное влияние на ограничение размера поражения при ИМ могут оказать устранение коронарного вазоспазма, предотвращение повреждения МЦР, улучшение показателей системной гемодинамики (увеличение коронарного перфузионного давления и снижение КДД в ЛЖ), а также развитие коллатерального кровообращения. Немедленное начало терапии и поддержка перфузии миокарда дадут достаточное время для развития анатомических и физиологических компенсаторных процессов, что в результате ограничит размер поражения при ИМ.
Разработанные методы защиты ишемизированного миокарда в начальные сроки заболевания также могут снизить частоту случаев пролонгированного течения и раннего развития рецидива ИМ.
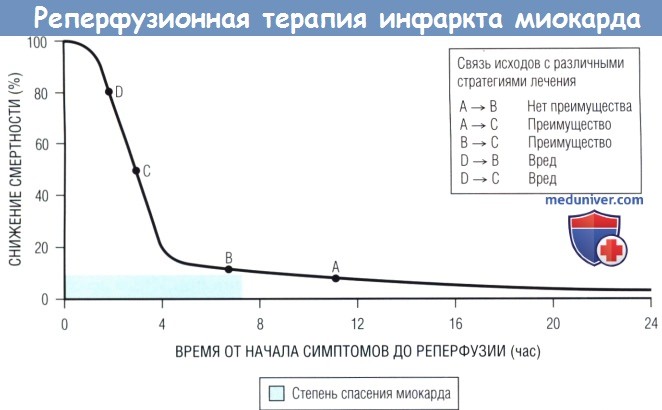
Наиболее вероятный результат вмешательства — спасение миокарда.
На длительность этого раннего критинеского периода могут повлиять такие факторы, как наличие функционирующих коллатералей коронарных артерий,
предшествующая ишемия, потребность миокарда в кислороде и продолжительность ишемии.
По прошествии этого раннего периода преимущество реперфузионной терапии в отношении смертности резко уменьшается (кривая снижения смертности сглаживается),
и фактор времени проведения реперфузии становится менее важным.
Преимущество при смещении от точки А или В к точке С будет значительным, а при смещении от точки А к точке В — небольшим.
Лечебная стратегия, отдаляющая начало терапии в ранний критический период, например транспортировка пациента для проведения ЧКВ, может приносить вред (смещение от точки D к точке С или В).
б) Рутиннные методы ограничения размера поражения при инфаркте миокарда. Несмотря на то что реперфузионная терапия является наиболее важным условием сохранения жизнеспособности миокарда, в ведении больных ИМ↑ST также используют несколько рутинных методов, помогающих добиться желаемого результата независимо от реперфузионного лечения. Описываемые далее методы лечения можно начать использовать в ОНИ и продолжить в ОКБ.
Чтобы спасти максимально большой объем жизнеспособной ткани, окружающей зону инфаркта миокарда (ИМ), необходимо поддерживать оптимальный баланс между доставкой кислорода и потребностью в нем миокарда. До развития необратимых повреждений клеток целесообразно снизить потребление кислорода миокардом, поэтому пациенты должны находиться в состоянии физического и эмоционального покоя. Для этого можно ввести пациента в неглубокое седативное состояние и обеспечить тишину в палате, что снизит ЧСС и, соответственно, потребление кислорода миокардом.
Если на раннем этапе развития инфаркта миокарда (ИМ) пациенту назначали бета-АБ, их применение необходимо продолжить. Отменяют бета-АБ в случае противопоказаний, например острой левожелудочковой недостаточности или брадиаритмии. При развитии выраженной синусовой брадикардии (ЧСС < 50 уд/мин) и часто сопровождающей ее гипотонии с целью увеличения центрального давления следует использовать постуральный прием (положение Тренделенбурга) и ввести атропин, а также начать временную элекгрокардиостимуляцию (ЭКС).
Применение изопротеренола противопоказано. С другой стороны, рутинное назначение атропина пациентам без выраженной брадиаритмии с последующим увеличением ЧСС также противопоказано. Все формы тахиаритмий требуют немедленного лечения, т.к. в этом сост оянии увеличивается потребность миокарда в кислороде.
Также необходимо немедленно начать терапию при появлении симптомов ХСН. С этой целью больным ИМ↑ST показаны ингибиторы РААС, за исключением больных с развитием артериальной гипотонии. Применения инотропных препаратов, таких как изопротеренол, следует избегать, т.к. они увеличивают потребление кислорода миокардом.
Как было отмечено ранее, у пациентов с гипоксемией, развивающейся на фоне хронической легочной патологии, пневмонии или дисфункции ЛЖ, необходимо поддерживать нормальный уровень оксигенации артериальной крови. Пациентам с гипоксемией необходимы ингаляции увлажненным кислородом и назначение по показаниям бронходилататоров и отхаркивающих средств. При тяжелой анемии, которая может усугублять ишемическое повреждение миокарда, показано переливание эритроцитарной массы с одновременным введением диуретиков при проявлениях левожелудочковой недостаточности.
Ассоциированные заболевания, в основном инфекционные, сопровождающиеся развитием тахикардии, лихорадки и увеличением потребности миокарда в кислороде, также требуют незамедлительного лечения.
Колебания САД не должны быть > 25-30 мм рт. ст. от обычного для пациента уровня, исключая случаи выраженной АГ до начала ИМ↑ST. Обычно организм пациента адаптирован к его оптимальному уровню АД; при изменении уровня перфузионного давления в КА нарушаются доставка кислорода (что связано с перфузионным давлением в КА) и потребность миокарда в кислороде (что связано с напряжением в стенке желудочка); это, в свою очередь, увеличивает размер ишемического повреждения.
- Читать "Принципы реперфузионной терапии инфаркта миокарда"
Оглавление темы "Тромболизис (фибринолитическая терапия, ФЛТ) при инфаркте миокарда.":- Ограничение размера поражения при инфаркте миокарда
- Принципы реперфузионной терапии инфаркта миокарда
- Реперфузионные повреждения миокарда и их профилактика
- Реперфузионные аритмии при инфаркте миокарда
- Позднее восстановление проходимости инфаркт-связанной коронарной артерии
- Коронарный тромболизис (фибринолизис). Классификация кровотока по TIMI
- Влияние тромболизиса на смертность при инфаркте миокарда
- Сравнение препаратов для тромболизиса при инфаркте миокарда
- Влияние реперфузии миокарда на функцию левого желудочка
- Осложнения тромболизиса (фибринолитической терапии)
