Микробиологическая диагностика возбудителя чумы (Y. pestis)
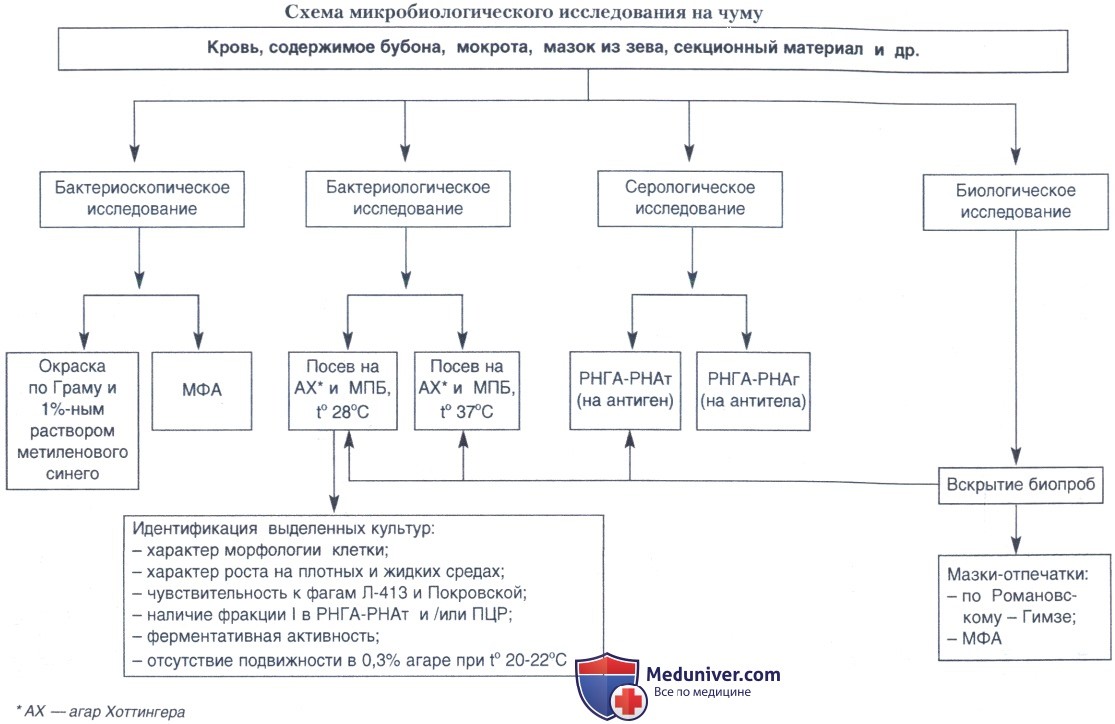
Лабораторные исследования на чуму клинического/секционного материала и объектов окружающей среды проводят специализированные лаборатории, имеющие лицензию на данный вид деятельности.
Объекты для исследования:
1. Отделяемое язвы или пунктата из карбункула (кожная форма).
2. Содержимое бубона (бубонная форма).
3. Мокрота, слизь из зева и мазок с миндалин (легочная форма).
4. Испражнения (кишечная форма).
5. Кровь (все формы).
6. В зависимости от поражений отдельных органов и систем — моча при наличии в ней крови, спинномозговая жидкость — при менингеальных явлениях.
7. Секционный материал — на вскрытии берут кусочек бубона и материал кожных поражений, лимфатические узлы, кусочки органов трупа, кровь из полости сердца, костный мозг (при наличии процессов загнивания).
8. Кровососущие членистоногие (блохи и др.) — содержимое кишечника.
9. Синантропные (крысы, мыши) и другие погибшие или болеющие грызуны — вскрывают, на исследование берут лимфатические узлы, органы и кровь.
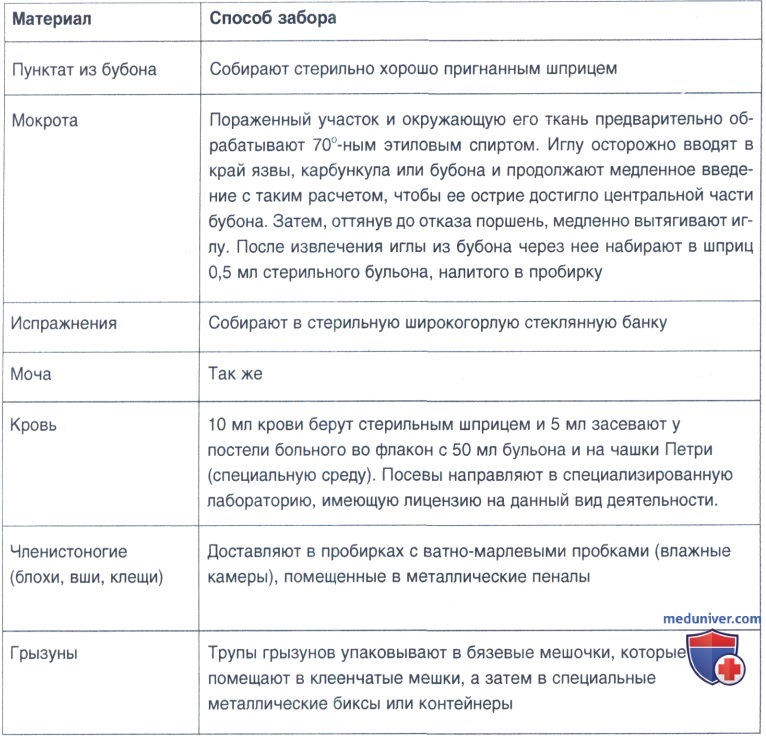
а) Методики и способы забора материала. При отсутствии условий для хранения материала на холоде, время от момента его взятия до начала исследования не должно превышать 5-6 ч. Желательно проводить посевы у постели больного или иметь походные сумки-холодильники. Для сохранения материала рекомендуют консерванты Берлина и Башевой (сохраняется в течение нескольких недель и даже месяцев). В качестве консерванта также используется жидкость Брокэ (материал сохраняется в течение нескольких дней).
б) Первый день исследования. Из доставленного материала (отделяемое язвы, пунктат из бубона, мокрота, испражнения, кровь и др.) готовят мазки, высушивают на воздухе, фиксируют в смеси Никифорова 20-30 мин. Мазок окрашивают по Граму и метиленовым синим. Наличие в мазках грамотрицательных палочек овоидной формы, а при окраске метиленовым синим — биполярности, клинических (патологоанатомических) данных дает право поставить предварительный диагноз — подозрение на чуму. Наличие специфически светящихся микробов, окрашенных чумной люминесцирующей сывороткой, подтверждает предварительный ответ.
Для обнаружения в нативном материале фракции FI возбудителя чумы ставят реакцию непрямой гемагглютинации (РНГА) с иммуноглобулиновым и реакцию нейтрализации антител (РНАт) с антигенным эритроцитарными диагностикумами или окрашивают чумной люминесцирующей сывороткой.
Посев. Незагрязненный посторонней микрофлорой материал засевают на проверенные на ростовые качества плотные и жидкие питательные среды — агар и бульон Хоттингера или Мартена с добавлением к ним стимуляторов роста (кровь, сульфит натрия и др). Стимуляция необходима, так как посевная доза может быть недостаточной. Материал, содержащий постороннюю микрофлору (мокрота, слизь из зева, вскрывшийся бубон, содержимое язвы, органы трупов человека без признаков разложения) засевают на среду Туманского, содержащую генцианвиолет в концентрации 1:200-1:800 тыс. в зависимости от результатов специального контроля его ингибирующего действия на соответствующие тест-штаммы. Посевы инкубируют в термостате при 28°С, а для обнаружения фракции FI чумного микроба — при 37°С.
б) Биологическая проба. Биопробу ставят на морских свинках и беспородных белых мышах. Метод введения исследуемого материала зависит от характера материала. Мокроту, слизь из зева, гной из открытого абсцесса вводят путем втирания в кожу брюшной стенки (предварительно кожу эпилируют, обрабатывают стерильным изотоническим раствором натрия хлорида и скарифицируют). На скарифицированный участок наносят исследуемый материал, втирая его плоской частью скальпеля под прикрытием специальной воронки или стерильной крышки от чашки Петри. Незагрязненный материал (кровь, содержимое закрытого бубона и т.п.) вводят животным подкожно или внутрибрюшинно. В зависимости от метода введения животное погибает на 3-9-й день. Ускорить постановку диагноза позволяет введение части биопробных животных (1 морской свинке и 1 белой мыши) гидрокортизона за 2 ч до заражения в дозе 5 мг (в 0,5 мл 0,85%-ного хлористого натрия) под кожу области бедра.
Для ускоренной диагностики проводят поэтапное вскрытие животных: на первые сутки — одну белую мышь, обработанную гидрокортизоном; на третьи сутки — морскую свинку, обработанную гидрокортизоном; остальных — на шестые сутки.
в) Второй день исследования (через 18-24 ч). Изучают рост на плотной и жидкой питательной среде. Из бульонной культуры при типичном росте делают мазки: окрашивают по Граму и метиленовым синим. Микроскопируют. С плотной питательной среды отбирают типичные колонии с целью выделения чистой культуры и ее идентификации. На 2-3 подозрительные в отношении возбудителя чумы колонии наносят чумной бактериофаг. После инкубации в термостате через 10-12 ч проводят учет результатов пробы с чумным бактериофагом. Лизис колоний под действием чумного бактериофага имеет диагностическое значение.
г) Третий день исследования (через 36-48 ч). Выделенная культура подлежит идентификации на основании следующих признаков:
1. Характерная морфология микроба (микропрепараты из нативного материала и чистых культур).
2. Характерная морфология роста на агаре и в бульоне Хоттингера.
3. Чувствительность к чумному бактериофагу.
4. Специфическое свечение при люминесцентной микроскопии чистой культуры.
5. Наличие специфического для возбудителя чумы антигена фракции FI, выявленного в РНГА или PHАт.
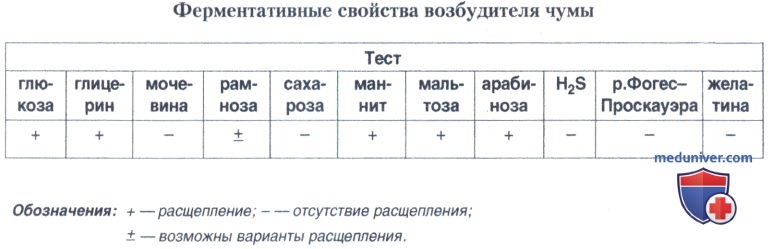
6. Ферментативная активность (глицерин, мочевина, рамноза, сахароза, глюкоза и др.).
7. Одновременно с идентификацией проводят определение чувствительности к антибиотикам методом серийных разведений или методом дисков.
д) Четвертый день исследования (через 60-72 ч). Производят учет результатов идентификации по следующим тестам:
- чувствительность к чумному бактериофагу и антибиотикам;
- наличие фракции FI, выявленной методом флюоресцирующих антител в РНГА или PHАт;
- ферментативная активность.

е) Проба с бактериофагом — лизис колоний чумного микроба. Ускоренный метод пробы с чумным бактериофагом. Исследуемый материал наносят на 3 чашки со средой Туманского: на первую чашку — одну каплю исследуемого материала и одну каплю чумного фага, растирают шпателем; на другую чашку засевают материал, а затем у края чашки наносят каплю фага и дают ей стечь в виде «дорожки»; на третью чашку (контрольную) вносят только материал и делают его рассев.
При наличии в исследуемом материале возбудителя чумы отмечают: на первой чашке — стерильные пятна, на второй — стерильную «дорожку» на месте нанесения фага, на третьей — типичные колонии возбудителя чумы.
Проводят дифференциацию бактерий чумы и бактерий псевдотуберулеза.
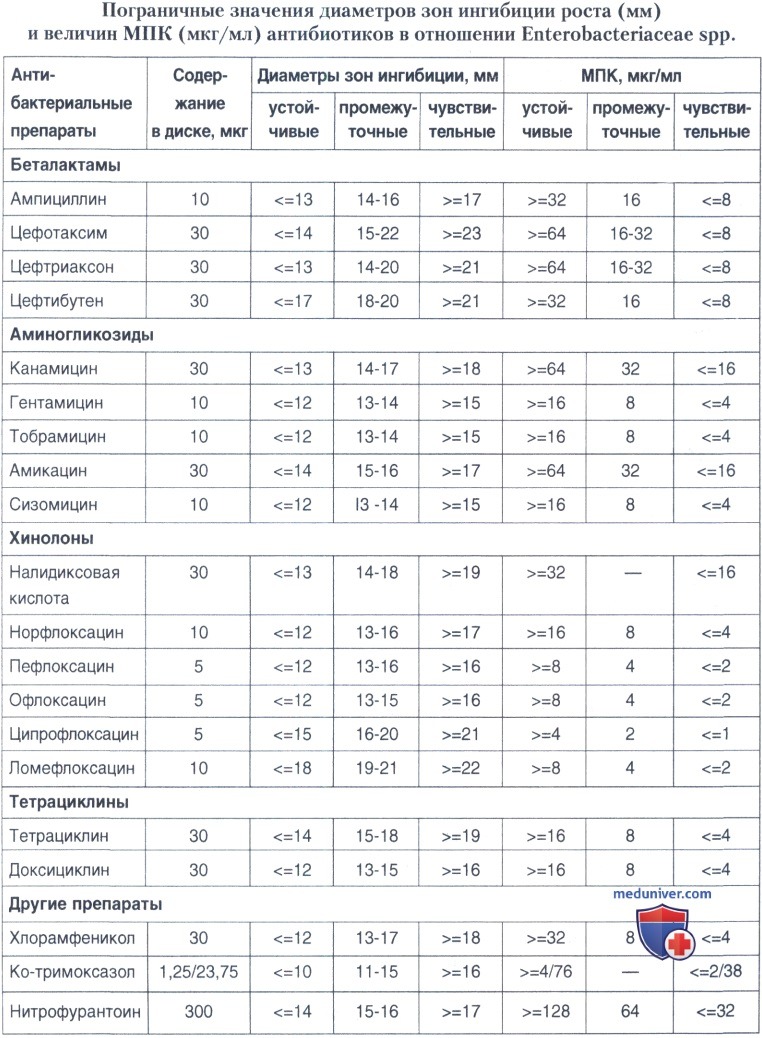
ж) Определение чувствительности выделенных культур возбудителя чумы к антибактериальным средствам (антибиотикам и химиотерапевтическим препаратам). Для оценки антибиотикочувствительности возбудителя чумы пользуются дискодиффузионным методом и методом серийных разведений в агаре или бульоне. В обоих случаях необходимо употреблять серии агара и бульона, отвечающие требованиям, предъявляемым к диагностическим питательным средам.
Стандартизованный метод, упомянутый выше, предусматривает приготовление посевного материала из колоний, выросших на чашках с первичной культурой или на чашках с чистой культурой. Этот метод называется «методом непрямого определения чувствительности». Необходимо подчеркнуть, что культура возбудителя чумы, выделяемая из исследуемого материала (мокрота, гной, содержимое бубона) развивается относительно медленно даже на средах со стимулятором роста и при оптимальной температуре инкубации 28°С (18-20 ч). Приблизительно столько же времени занимает культивирование газона на чашках с дисками антибиотиков. Таким образом, если антибиотик, назначенный сразу после взятия материала на исследование, окажется неэффективным, замена его другим препаратом согласно результатам проверки антибиотикочувствительности может быть произведена только через 36-40 ч с момента обнаружения больного. Назначение в эти сроки при тяжелом течении болезни, особенно при легочной и септической формах чумы, даже высокоэффективного препарата может не обеспечить терапевтического эффекта.
Поэтому стандартизованный метод может быть заменен прямым посевом патологического образца сплошным газоном на чашки Петри для определения антибиотикочувствительности возбудителя методом дисков. Это позволит при значительном числе клеток возбудителя чумы в мокроте или другом патологическом материале определить чувствительность к антибиотикам через 20-24 ч с момента обнаружения больного. Оценку результатов определения антибиотикочувствительности штамма методом дисков проводят по величине диаметра задержки роста, включая диаметр и самого диска. В зависимости от диаметра ингибиции роста в миллиметрах штамм относят к одной из трех категорий чувствительности к данному антибиотику — устойчивый, промежуточный, чувствительный.
Для более точного представления об активности антибиотиков используют метод серийных разведений в жидких и плотных питательных средах. Жидкие питательные среды употребляются при изучении единичных штаммов, плотные — при одновременной проверке нескольких штаммов. За МПК (минимальную подавляющую концентрацию) принимают минимальную концентрацию (мкг/мл), обеспечивающую полное подавление видимого роста.
Качество постановки методов контролируется периодически с использованием референтных штаммов Е. coli АТСС 25922, S.aureus АТСС 25923 и Р. aeruginosa АТСС 27853.
з) Полимеразная цепная реакция (ПЦР). ПЦР признается в настоящее время принципиально значимым методом для ускоренной диагностики и индикации опасных инфекционных заболеваний. В специализированных для работы с возбудителями особо опасных инфекций лабораториях разработаны и выпускаются стандартные коммерческие наборы тест-систем — праймеры на основе участков генов caf 1, pla, уорА, локализованных на плазмидных репликонах возбудителя чумы — pFra pPst, pCad, которые позволяют выявлять клетки в концентрации 102 — 101 м.к./мл в чистых культурах и в суспензиях из органов людей, больных чумой.
Главным преимуществом метода является высокая разрешающая способность, возможность обнаружить 1000 и менее микробных клеток в 1 мл пробы, поэтому реакцию используют прежде всего при исследовании нативного материала. Время, необходимое для выполнения ПЦР, — 5-6 ч. На основании выделения в пробе ДНК возбудителя чумы (одной или двух плазмид) дается предварительный положительный ответ (устно).
- Читать далее "Иммунологическая диагностика возбудителя чумы (Y. pestis)"
Редактор: Искандер Милевски. Дата публикации: 6.1.2020
- Возбудитель чумы (Yersinia pestis): таксономия
- Морфология и культуральные свойства возбудителя чумы (Y. pestis)
- Антигены и генетика возбудителя чумы (Y. pestis)
- Факторы патогенности возбудителя чумы (Y. pestis)
- Клинические формы чумы
- Эпидемиология чумы
- Микробиологическая диагностика возбудителя чумы (Y. pestis)
- Иммунологическая диагностика возбудителя чумы (Y. pestis)
- Серологическая диагностика возбудителя чумы (Y. pestis)
- Лечение и профилактика чумы
