Иммунологическая диагностика возбудителя чумы (Y. pestis)
Обеззараживание суспензий внутренних органов или костного мозга животных, материала от больных людей, секционного и другого материала, предназначенного для исследования на наличие капсульного антигена возбудителя чумы, осуществляется добавлением проверенного на бактерицидное действие формалина. При 1-2%-ной конечной концентрации формалина в пробе последующая экспозиция составляет не менее 12 ч, при 4%-ной концентрации — 1ч при комнатной температуре.
Выявление специфического капсульного антигена FI возбудителя чумы:
1. Система серологических реакций — РНГА/РНАт. Данная система серологических реакций, направленных на выявление специфического капсульного антигена возбудителя чумы, оказалась весьма эффективным методом ускоренной диагностики при эпидемических осложнениях но этой инфекции. При этом представлялось возможным в течение 3-5 ч установить лабораторно диагноз чумы и начать проведение противоэпидемических мероприятий, не ожидая роста возбудителя на питательных средах.
Установлено, что у людей, заболевших чумой, а также в случае смертельного исхода заболевания, имеет место накопление в органах и тканях в большой концентрации фракции I и клеток возбудителя. За последние 25 лет во время вспышек чумы получены материалы, свидетельствующие об эффективности во всех без исключения случаях исследований на наличие специфического антигена в органах и тканях заболевших или погибших от чумы людей.
Данный метод был высокоэффективным и при расследовании путей передачи инфекции, так как позволил получить позитивные результаты при исследовании различных объектов, в том числе даже вареного и соленого мяса животных, явившихся причиной заражения людей. Антительный диагностикум и набор других ингредиентов для постановки РНГА/РНАт выпускает Институт микробиологии МО (г. Киров). Реакции ставят в соответствии с прилагаемым наставлением.
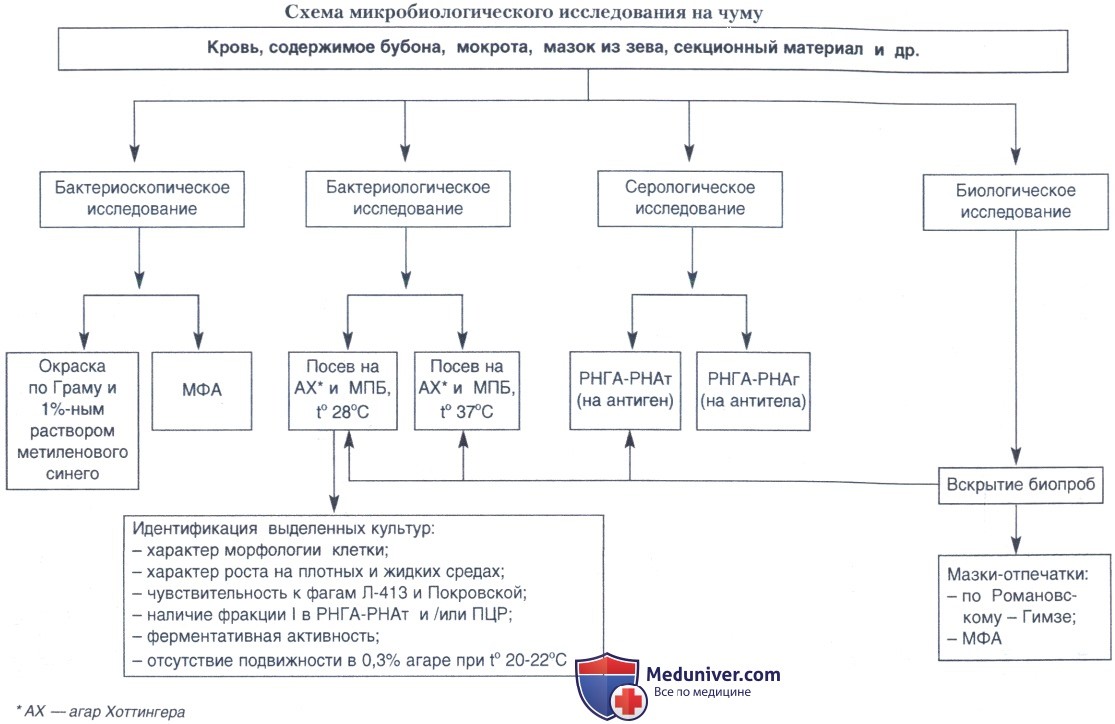
2. Метод флуоресцирующих антител (МФА), сочетающий принципы иммунологического и морфологического исследования с люминесцентным анализом, отличается высокой чувствительностью и специфичностью, и позволяет через 1-2 ч от начала исследования пробы обнаружить не только жизнеспособные особи возбудителя чумы, но и мертвые клетки и даже растворимый антиген. Однако положительный результат может быть получен лишь при наличии в исследуемом материале сравнительно высокой концентрации микробных клеток — не менее 106 м.к./мл.
При исследовании нативного клинического или секционного материала в целях повышения достоверности результатов иммунолюминесцентного анализа обязательным условием является устранение или снижение интенсивности фоновой флуоресценции препаратов. С этой целью для окраски мазков используют смесь, состоящую из равных объемов специфических иммуноглобулинов диагностических чумных люминесцирующих (ИДЧЛ) и контрастирующего альбумина нормальной сыворотки (лошадиной, кроличьей), конъюгированного с родаминовыми красителями.
Важным условием является правильное соотношение компонентов рабочей смеси. Эти соотношения определяют опытным путем (на контрольных мазках) для каждой новой серии ИДЧЛ и альбумина, поскольку указанные на этикетках ампулы рабочие разведения являются ориентировочными.
Мазки-отпечатки из органов животных, а также мазки из мокроты, содержимого бубона и крови готовят на обезжиренных предметных стеклах по общепринятой методике. Наличие на предметных стеклах кусочков тканей органов недопустимо. Фиксируют мазки в 96° этиловом спирте в течение 30-40 мин. До окончания фиксации все препараты из материала, подозрительного на зараженность возбудителем чумы, считают заразными. В процессе фиксации не допускают слипания между собой отдельных предметных стекол. Применение восковых карандашей для надписей на стеклах недопустимо, так как воск, растворяясь в фиксаторе, образует на стеклах пленку, препятствующую люминесцентной «окраске» бактерий.
По окончании фиксации препараты высушивают на воздухе и помещают во влажную камеру (чашка Петри с кусочком смоченной в воде ваты). На поверхность фиксированного и высушенного мазка пастеровской пипеткой наносят каплю «рабочего разведения» люминесцирующих иммуноглобулинов. Окраску производят в течение 20 мин. Затем мазки ополаскивают в воде и погружают на 10-15 мин в 0,85%-ный раствор хлористого натрия, содержащий 0,01М фосфатный буфер (pH 7,2-7,4). После этого препарат вновь ополаскивают дистиллированной водой и высушивают на воздухе.
- Читать далее "Серологическая диагностика возбудителя чумы (Y. pestis)"
Редактор: Искандер Милевски. Дата публикации: 6.1.2020
- Возбудитель чумы (Yersinia pestis): таксономия
- Морфология и культуральные свойства возбудителя чумы (Y. pestis)
- Антигены и генетика возбудителя чумы (Y. pestis)
- Факторы патогенности возбудителя чумы (Y. pestis)
- Клинические формы чумы
- Эпидемиология чумы
- Микробиологическая диагностика возбудителя чумы (Y. pestis)
- Иммунологическая диагностика возбудителя чумы (Y. pestis)
- Серологическая диагностика возбудителя чумы (Y. pestis)
- Лечение и профилактика чумы
