Факторы патогенности энтерококков
Первое сообщение об изучении вирулентности энтерококков было опубликовано М.Е. Thiercelin в 1899 году. Рост количества инфекций, обусловленных штаммами энтерококков, особенно внутрибольничного происхождения, связанных с появлением и быстрым распространением штаммов, полирезистентных к антибиотикам, безусловно, нуждается в тщательном анализе механизмов, которые используют энтерококки для развития и усиления вызванных ими заболеваний.
Энтерококки вызывают широкий круг инфекций у людей. Они обычно инфицируют мочевыводящие пути, кровяное русло, эндокард, брюшную полость, желчные пути, ожоговые раны и имплантированные извне устройства — например, внутрисосудистые катетеры. Реже энтерококки могут поражать нервную систему, легкие, мягкие ткани, околоносовые пазухи, уши, глаза и периодонт.
Известно, что энтерококки являются нормальными комменсалами человека в таких экологических его комплексах, как микрофлора полости рта, желудочно-кишечного тракта и влагалища, адаптированных к условиям питания и ограничению кислорода. Штаммы Е. faecalis обуславливают 80-90% энтерококковых инфекций у человека, в то время как другой вид энтерококков, Е. faecium, является причиной остальных 10-20% случаев. Такие виды энтерококков, как Е. avium, Е. casseliflavus, Е. durans, Е. gallinarum, Е. hirae, Е. malodoratus, Е. mundtii, Е. raffinosus, и Е. solitarius довольно редко обнаруживаются у людей.
В 70-е и 80-е годы прошлого века энтерококки стали одной из главных причин внутрибольничных инфекций. В настоящее время они занимают четвертое место среди ведущих видов микроорганизмов, вызывающих внутрибольничные инфекции и третье место — как причина бактериемий в США.
Показано, что Е. faecalis могут вторгаться в дентинные каналы, в то время как не все бактерии обладают этой способностью.
Наиболее изученные факторы патогенности, образуемые штаммами рода Enterococcus — поверхностные адгезины, агрегирующая субстанция, половые феромоны, липотейхоевые кислоты, внеклеточные перекиси, желатиназа, гиалуронидаза и цитолизины (гемолизины), а также факторы непрямого действия, такие как субстанция AS-48 и другие бактериоцины.
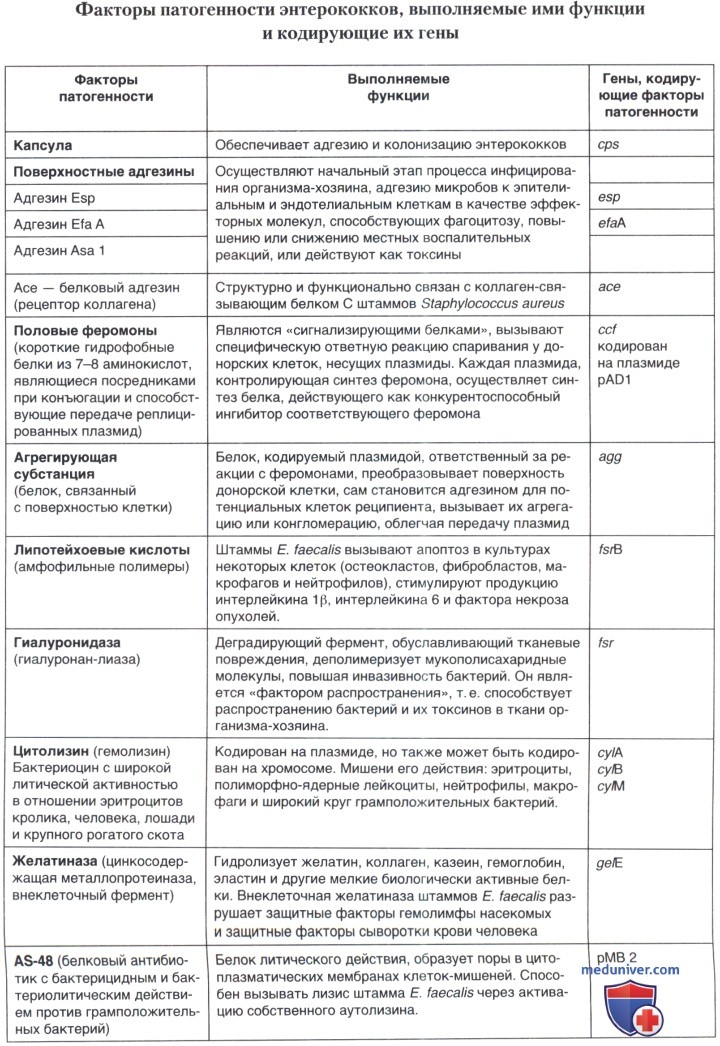
а) Поверхностные адгезины. Начальным этапом процесса инфицирования организма-хозяина является адгезия микроорганизма к эпителиальным и эндотелиальным клеткам, лейкоцитам или внеклеточному матриксу. Более того, адгезины, т. е. поверхностные белки, осуществляющие процесс адгезии, играют разнообразную роль в качестве эффекторных молекул, способствующих фагоцитозу, повышающих или снижающих местные воспалительные реакции или же действующие как токсины.
Интенсивное исследование энтерококковых адгезинов началось лишь в последнее время. Энтерококковый ген esp, кодирующий высокомолекулярный поверхностный белок Esp, определяется у значительного большинства штаммов Е. faecalis, выделенных при бактериемиях и эндокардитах, но редко — у штаммов, изолированных от здоровых лиц. Участие поверхностного белка Esp в колонизации и персистенции энтерококков в мочевом тракте было показано на животных.
Белок Esp также связан с первичным прикреплением и образованием штаммом Е. faecalis биопленок на абиотических поверхностях. Более того, образование биопленок штаммами Е. faecalis было обнаружено на стенках леченных дентинных каналов, что делало штамм энтерококка резистентным к бактерицидному эффекту перекиси кальция при лечении зубных каналов.
Исследовались факторы, обеспечивающие связывание энтерококков с белками внеклеточного матрикса (ВКМ). Различные штаммы Е. faecalis, выделенные из разных клинических источников, были способны агглютинироваться ВКМ-белками, включая коллагены типа 1 и IV, что может быть связано с поверхностной гидрофобностью клеток.
Адгезия бактерии к коллагену ослаблялась последующей предварительной обработкой энзимом, расщепляющим белки, или последующим расщеплением субстрата ферментом коллагеназой. Предполагаемый белковый адгезии был впоследствии идентифицирован как Асе.
Обнаружено также, что разрушение гена асе ослабляет связывание Е. faecalis с ВКМ-белками. Идентификация Асе-специфических антител в сыворотке, полученной от пациентов с энтерококковыми инфекциями, и особенно от больных эндокардитами, вызванными штаммами Е. faecalis, показывает, что Асе всегда образуются различными штаммами Е. faecalis, инфицирующими людей, но не образуются при 46ПС in vitro.
Изучение последовательности аминокислот белка EfaA выявило 55-60% гомологии с группой стрептококковых белков, являющихся адгезинами. Это позволило предположить, что белок EfaA может функционировать в качестве адгезина при эндокардитах. Продукция белка EfaA штаммами Е. faecalis, по-видимому, происходит с высокой вероятностью. В одном исследовании ген efaA был выявлен во всех биологических образцах (кровь, гной, моча, кал, в окружающей среде больниц) и во многих продуктах питания (молоко, сыр, мясо), содержащих Е. faecalis.
Нормальная сыворотка может вызывать экспрессию поверхностного адгезина, что доказывается адгезией Е. faecalis к эукариотическим клеткам с помощью углеводных остатков, присутствующих на поверхности бактерий. Так, штаммы Е. faecalis, выделенные от больных с инфекциями мочевого тракта, экспрессируют лиганды D-галактозы и L-фруктозы, если выращиваются в сыворотке, но не экспрессируют эти лиганды, когда их выращивают в бульоне с сердечно-мозговым настоем.
Патогенная значимость феромонов проявляется в том, что они являются посредниками процесса конъюгации и способствуют передаче реплицированных плазмид.
Половые феромоны являются короткими гидрофобными белками, состоящими из 7-8 аминокислот, которые переносятся хромосомой и являются «сигнализирующими белками» в штаммах Е. faecalis. Они были названы феромонами, потому что при конъюгации они вызывали специфическую ответную реакцию спаривания у донорских клеток, несущих плазмиды. Феромоны секретируются штаммами Е. faecalis, которые способствуют передаче плазмидной ДНК при конъюгации между штаммами. Каждая плазмида, контролирующая синтез феромона, синтезирует белок, который действует как конкурентоспособный ингибитор соответствующего феромона.
Некоторые, хотя и не все феромоны и ингибирующие их белки, еще действуют в качестве хемоаттрактантов для нейтрофилов, вызывая секрецию гранулирующих ферментов и ингибируя дыхательный взрыв. Последний процесс способствует усилению выработки супероксида нейтрофилами после фагоцитирования штаммов энтерококков, несущих конъюгативную цитолитическую плазмиду.
Система половых феромонов увеличивает в несколько раз частоту передачи конъюгативных плазмид Е. faecalis. При этом реципиентный штамм секретирует в среду половой феромон соответствующей плазмиды, которой у него нет. В ответ донорский штамм продуцирует адгезиноагрегирующую субстанцию, которая осуществляет тесный контакт между реципиентным и донорским штаммами, обеспечивая конъюгативную передачу реплицированной плазмиды. Через систему полового феромона резистентность к антибиотикам и некоторые факторы вирулентности (например, цитолизины) могут распространяться на другие штаммы E.facialis.
Феромоны с АМ373 и cPD1 действуют как хемоаттрактанты в наномолекулярных концентрациях. Однако некоторые исследователи сообщают о более низком уровне активности таких феромонов.
Штаммы энтерококков обычно выделяют феромоны, так что эффект хемотаксиса феромонов проявляется даже при их низкой концентрации. Правда, вопрос о том, могут ли эти пептиды и их ингибиторы модулировать воспалительные реакции in vitro, остается открытым.
б) Агрегирующая субстанция представляет собой белок, который связан с поверхностью бактериальной клетки и кодируется плазмидой, ответственной за реакции на феромоны у штаммов Е. faecalis. Она экспрессируется при индукции реакции на феромоны, а также преобразует поверхность бактерии-донора таким образом, что она становится адгезином для потенциальных клеток-реципиентов, вызывая их агрегацию или конгломерацию и облегчая при этом передачу плазмид.
Поскольку агрегирующая субстанция экспрессируется донорской клеткой, процесс бактериальной конъюгации нуждается в «связывающей субстанции», которая переходит на рецепторную клетку.
Показана стабильность генов, кодирующих агрегирующую субстанцию, которые получены от различных специфичных по цитолизину и не специфичных по нему плазмид, а также плазмид, отвечающих за реакцию на феромоны.
Агрегирующая субстанция фиксируется на бактериальной мембране с помощью С-конца цепи, прикрепляясь к белку, связанному с клеточной стенкой грамположительных бактерий. На электронных микрофотографиях агрегирующая субстанция выглядит как множество волосков на клеточной поверхности, включенных в клеточную стенку.
Наряду с адгезивной функцией в процессе бактериальной конъюгации, in vitro агрегирующая субстанция прикрепляет Е. faecalis к различным эукариотическим клеткам, включая почечные цилиндрические клетки и эпителиальные клетки кишечника. Показано также, что агрегирующая субстанция связывает белки, включая коллаген типа I, с внеклеточным матриксом. Этот факт открывает новые возможности для борьбы с зубными инфекциями, так как коллаген типа I является главным компонентом дентина.
Агрегирующая субстанция часто обнаруживается в клинических штаммах энтерококков, но ее редко находили в культурах, изолированных из фекалий здоровых людей, что наводит на мысль о возможной патогенетической роли агрегирующей субстанции в инфекциях, вызванных Е. faecalis у людей.
в) Липотейхоевые кислоты. Поверхностные мембранно-связанные липотейхоевые кислоты (ЛТК) являются амфофильными полимерами, состоящими из гидрофильной полиглицерофосфатной основы, имеющую эфирную связь с гидрофобным гликолипидным хвостом. Различные компоненты и особенно липотейхоевые кислоты Е. faecalis вызывают апоптоз в культуре клеточных линий (остеокласты, периодонтальный лигамент, фибробласты, макрофаги и нейтрофилы).
Изучены некоторые особенности энтерококковых ЛТК. Показано, что они, так же как и ЛТК патогенного стрептококка (S. pyogenes), обратимо связываются с эритроцитами человека. Важным для обеспечения процесса связывания являлся ацетильный остаток ЛТК. Эти данные имеют отношение к местным воспалительным процессам, т.к. ЛТК связывается с эукариотическими клетками, придавая им антигенную специфичность. В результате этого клетки подвергаются лизису опосредованно через комплемент, который находится в плазме.
ЛТК, образуемые энтерококками, являются мощными индукторами провоспалительных цитокинов. Выделенные из штаммов Е. faecalis, как и из других грамположительных бактерий, ЛТК стимулируют лейкоциты, освобождая некоторые медиаторы, играющие роль в различных фазах воспалительного ответа организма-хозяина (интерлейкины).
Очищенные ЛТК из штаммов Е. faecalis могут подавлять агрессию некоторых бактериальных клеток, индуцированную феромонами. Было также подтверждено, что ЛТК действуют как связывающая субстанция, узнаваемая как агрегирующая субстанция на донорских клетках.
Из изложенного выше можно заключить, что энтерококковые ЛТК могут выполнять роль факторов вирулентности, так как способствуют возникновению воспалительных реакций и облегчают перенос плазмид.
г) Цитолизин. Первое комплексное исследование факторов вирулентности было связано с именем Тодда (Е. W. Todd), который в 1934 году опубликовал работу, посвященную цитолизину (гемолизину). Продукция цитолизина штаммами Е. faecalis была выявлена по появлению четких зон а-гемолиза вокруг колоний, выращенных на кровяном агаре. Штаммы Е. faecalis с таким фенотипом, однако, часто пропускались в клинических лабораториях из-за использования бараньих эритроцитов в питательных средах, которые не лизировались выделяемыми цитолизинами. Эритроциты кролика, человека, лошади и крупного рогатого скота чувствительны к литическому действию цитолизинов.
Более общее название «цитолизины» было выбрано в связи с тем, что спектр клеток-мишеней для лизинов, более широк, чем эритроциты, и включает клетки эукариотов и прокариотов.
Цитолизин, продуцируемый разными штаммами Е. faecalis, чаще всего бывает кодирован плазмидой, но также может быть кодирован хромосомой.
Образование и активация цитолизина состоит из нескольких этапов, каждый из которых подвергся тщательному изучению. Образующая цитолизин бактерия защищена от лизиса с помощью cyl-генного продукта через неизвестный пока механизм. Среди известных клеток-мишеней цитолизина — эритроциты, полиморфноядерные лейкоциты, нейтрофилы, макрофаги и широкий спектр грамположительных, но не грамотрицательных бактерий.
Было также показано, что гены cylL1, и cylLs, кодирующие структурные субъединицы цитолизина, являются регуляторами ответа на изменяющиеся кислородные условия и вызывают образование повышенного количества цитолизина в анаэробных условиях. Иначе говоря, генная экспрессия цитолизина клетками Е. faecalis регулируется в ответ на условия аэробиоза. Эти данные очень важны с точки зрения инфицирования штаммами Е. faecalis зубных каналов, поскольку энтерококки могут выживать в анаэробных условиях зубных каналов и после истощения кислорода аэробами. Анаэробные условия могут также преобладать в слоях бактериальных биопленок в зубных каналах, поскольку штаммы Е. faecalis способны образовывать биопленки.
Цитолитические штаммы Е. faecalis выделяют бактериоцин с широким спектром активности против грамположительных, но не грамотрицательных бактерий. Вместе с тем, цитолитическая и бактерицидная активности утрачиваются при ультрафиолетовом облучении, хотя и восстанавливаются при реверсии штаммов. Эти явления указывают на то, что у энтерококков существует единый материал, ответственный и за цитолитическую, и за бактериолитическую активность.
Роль цитолизина как фактора патогенности доказана частично. Так, приблизительно 60 % клинических штаммов Е. faecalis, выделенных из образцов кала больных, были гемолитическими, но только 17 %, выделенных от здоровых людей, не проявляли гемолитической активности. В других исследованиях было показано, что только 16% клинических штаммов Е. faecalis образовывали цитолизин. Видимо, роль этого белка как основного фактора патогенности невелика.
У клинических штаммов Е. faecalis ген cyl не всегда экспрессируется (отсутствует гемолиз на кровяном агаре). Факторы, которые могут оказаться в инфицированном участке тела, могут активировать этот молчащий ген.
д) Желатиназа является внеклеточной цинкосодержащей металлопротеиназой II — микробной протеиназой. Молекулярная масса находится в пределах 28-32 kDa. Способна гидролизовать желатин, коллаген, казеин, гемоглобин, инсулин и другие мелкие биологически активные белки. В 2007 г. появилось сообщение о том, что внеклеточная желатиназа штаммов E.faecalis разрушает защитные факторы гемолимфы насекомых и защитные факторы сыворотки крови человека. Была выявлена также нуклеотидная последовательность протеазного гена ge/E, который кодировал презимоген с молекулярной массой 34,5 kDa. Образование протеазы было легко осуществлено при выращивании штамма-продуцента на полусинтетической среде с добавлением 3% желатины или 1,5% снятого молока.
Потенциальный вклад энтерококковой протеиназы в вирулентность образующих ее штаммов доказан в 1975 году в опытах над безмикробными крысами, у которых такие штаммы вызывали кариес, в отличие от непротеолитического штамма E.faecalis. Была также выявлена способность к образованию протеазы у энтерококков, инфицирующих человека. 63% энтерококков, выделенных от больных в хирургических и нейрохирургических отделениях интенсивной терапии в Германии, образовывали протеазу. Следовательно, желатиназа также участвует в инфекционном процессе, вызываемом энтерококками.
При анализе нуклеотидной последовательности гена ge/E было выявлено сходство с цинкометаллопрогеазой (эластазой), образуемой штаммом Pseudomonas aeruginosa. Этот фермент рассматривается как фактор вирулентности при тяжелых инфекциях, особенно у больных муковисцидозом.
е) Гиалуронидаза (гиалуронанлиаза) действует на гиалуронан — мукополисахарид, входящий в состав соединительной ткани, и является, в основном, деградирующим ферментом, который вызывает тканевые повреждения. Она деполимеризирует мукополисахаридные молекулы, соединенные с тканями и, таким образом, повышает инвазивность бактерий.
Гиалуронидаза, являясь токсичным разрушающим ферментом, способствует распространению бактерий и их токсинов через ткани организма-хозяина. Присутствие микроорганизмов, включая и E.faecalis, при перитонеальных поражениях, может быть связано с активностью фермента, такого как гиалуронидаза.
ж) AS-48 является бактериоцином — белковым антибиотиком, обладающим бактерицидным и бактериолитическим действием против грамиоложительных (в том числе энтерококков), ряда грамотрицательных бактерий и других микроорганизмов. Как было определено, бактериоцин AS-48, является основным белком, вызывающим литический эффект путем образования пор в цитоплазматических мембранах клеток-мишеней. Он также способен вызывать лизис штамма Е. faecalis через активацию собственного аутолизина. AS-48 может быть кодирован трансмиссивной плазмидой рМВ 2.
Значимость этого бактериоцина в качестве фактора патогенности сомнительна, так как частота выявления штаммов, образующих AS-48, среди энтерококков-ком-менсалов человека еще не определена. Результаты, полученные с помощью ПЦР, свидетельствуют о том, что бактериоцины, образуемые многими штаммам Е. faecalis, близки или идентичны пептиду AS-48.
- Читать далее "Заболевания вызываемые энтерококками"
Редактор: Искандер Милевски. Дата публикации: 16.3.2020
- Род Enterococcus (энтерококки): таксономия, характеристика
- Резистентность энтерококков к антибактериальным препаратам
- Образование биопленок энтерококками
- Бактериоцины энтерококков
- Факторы патогенности энтерококков
- Заболевания вызываемые энтерококками
- Эпидемиология энтерококковой инфекции
- Методы первичного выделения энтерококков
- Идентификация видов энтерококков и разделение их по группам
- Определение чувствительности энтерококков (Enterococcus spp.) к антибиотикам
- Лечение инфекций вызываемых энтерококками
