Методы первичного выделения энтерококков
а) Взятие материала. Для выделения штаммов энтерококков применяют стандартные методы получения проб крови, мочи, ликвора, отделяемого ран и другого клинического материала с помощью стерильных ватных тампонов и стерильных шприцев. Для более ранней и достоверной его доставки в клиническую лабораторию возможно использование любой транспортной среды или сухого тампона.
Для лабораторной диагностики полученного клинического материала используют посев его на различные питательные среды с последующим выделением чистых культур энтерококков.
б) Питательные среды для выделения энтерококков. В качестве неселективной среды для выделения энтерококков используется 5%-ный кровяной агар. Селективными средами являются энтерококковый агар, производимый ГНЦПМ (Оболенск) или ФГУП «Аллерген» (Ставрополь). При первичном выделении штаммов энтерококков из исследуемых образцов можно использовать также желчно-щелочной агар (ЖЩА), он также селективен за счет желчи и высокой щелочности среды.
Если в исследуемом образце клинического материала содержатся грамотрицательные бактерии, его следует засеять на коммерческий селективный энтерококковый агар Пфайзера, содержащий желчь, эскулин и азид натрия. Добавление в среды азида натрия приводит к ингибированию роста грамотрицательных бактерий. Колонии энтерококков на этой среде приобретают черную окраску вследствие гидролиза ими добавленного в среду эскулина.
Использование описанных выше селективных сред для выделения энтерококков было начато еще в 1970-е годы. Позднее были описаны и использованы несколько новых сред, в том числе содержащих хромогенные субстраты, что способствует быстрому выделению и предварительной идентификации энтерококков, содержащихся в моче.
На чашках с хромогенным агаром, изготовляемом фирмой «HiMedia» (Индия) возможно дифференцировать в первичном посеве одновременно колонии штаммов Enterococcus faecalis (они выявляются на этой среде в виде колоний голубоватозеленого цвета), Escherichia coli (имеют пурпурную окраску), Staphylococcus aureus (растут в виде бесцветных колоний), штаммы Klebsiella pneumoniae (образуют мукоидные колонии голубого цвета). Эта среда выпускается в сухом виде. Ее рекомендуется хранить в холодильнике, а не в готовом виде разлитыми в чашки Петри, где эти среды достаточно быстро высыхают. Хромогенные среды очень удобно применять для первичного выделения культур из мочи, поскольку каждый из перечисленных выше микроорганизмов можно в ней сразу обнаружить и отсеять на чашки с кровяным агаром.
С целью первичного выделения энтерококков из обильно контаминированных ими мест предложен цефалексин-азтреонам-арабинозный агар. Другая среда, используемая для ускорения выделения энтерококков из загрязненной воды, — это оксолин-эскулиновый агар, который, однако, не рекомендован для исследования клинического материала.
Увеличение числа случаев появления ванкомицин-резистентных энтерококков привело к необходимости их селективного выделения из клинического материала. Было предложено несколько вариантов селективных агаров и/или бульонных сред для выделения ВРЭ из ряда источников, содержащих нормальную микробную флору, таких как образцы фекалий и ректальные мазки. Энтерококковый бульон, использующийся в ряде исследований в качестве основной среды обогащения, содержащий 6 мг/мл ванкомицина, признан наиболее подходящим. Ряд других антимикробных препаратов (азтреонам и клиндамицин), также используются для обогащения в бульоне.
Наиболее чувствительный метод предусматривает выделение устойчивых к ванкомицину штаммов энтерококков при 35°С на энтерококковом агаре с добавлением 6 мг/мл ванкомицина, а также на колумбийском бульоне из сухого образца, в состав которого входят еще колистин и налидиксовая кислота.
Для проведения исследований с целью выделения ВРЭ с поверхностей окружающей среды производят смывы предварительно смоченными тампонами с последующим их посевом на агаризованную питательную среду, рекомендованную для выделения энтерококков.
в) Выделение и идентификация энтерококков. Первый день: проводят посев поступившего на исследование клинического материала на 5%-ный кровяной агар, а также на одну из перечисленных выше селективных питательных сред (в том числе желчно-щелочную и хромогенную агаровые среды) или бульонов, обычно рекомендованных для первичного выделения энтерококков. Кроме того, производят посев на сердечно-мозговой бульон, который можно рассматривать в качестве среды обогащения для энтерококков.
Второй день: просматривают чашки с первичными посевами исследуемых культур, выросших на кровяном агаре, селективных средах и в бульоне. С этих агаров отбирают колонии с характерной для энтерококков формой и типом гемолиза эритроцитов (а-гемолиз) при росте на кровяном агаре. Отобранные колонии, похожие на энтерококки, засевают в молоко с 1 % метиленового синего.
Третий день: в пробирках с молоком культуры энтерококка редуцируют метиленовый синий уже после 18-20 часов инкубации. Из выросших на желчно-щелочной среде, а также на других селективных средах колоний, имеющих характерную для энтерококков форму (а на хромогенной среде — также окраску), отбирают бактериологической петлей небольшое количество материала и готовят мазки для окрашивания по Граму. В исследуемых мазках энтерококки представляют собой грамположительные полиморфные кокки, располагающиеся единичными клетками, в парах или в виде коротких цепочек, или небольших скоплений клеток.
После этого колонии с признаками, характерными для энтерококков, высевают снова на кровяной агар и в бульон с целью получения чистой культуры, которая будет изучена на принадлежность к роду Enterococcus и идентифицирована до видового уровня.
Штаммы энтерококков несколько дней можно сохранять в пробирках со скошенным агаром. После заливки агаровых «косяков» с выросшими на них энтерококками стерильным вазелиновым маслом бактерии могут сохраняться в течение нескольких месяцев. Если требуется более продолжительный срок хранения изолированных и уже охарактеризованных штаммов, можно их лиофильно высушить или сохранять в замороженном состоянии при температуре -70°С. Их также можно сохранять в течение нескольких лет в виде клеточных суспензий, приготовленных на дефибринированной крови барана или кролика или же в 10%-ном снятом молоке, содержащем 10% глицерина.
г) Первичная идентификация выделенных энтерококков до видового уровня. Для идентификации выделенных культур энтерококков на видовом уровне прежде всего необходимо их проверить в тесте с антисыворотками группы D по Ленсфилд, поскольку более 80% штаммов энтерококков с этими антисыворотками реагируют положительно.
Далее следует дифференцировать энтерококки и стрептококки. Тесты, используемые для этой цели, а также некоторые их культуральные особенности представлены в таблице ниже.
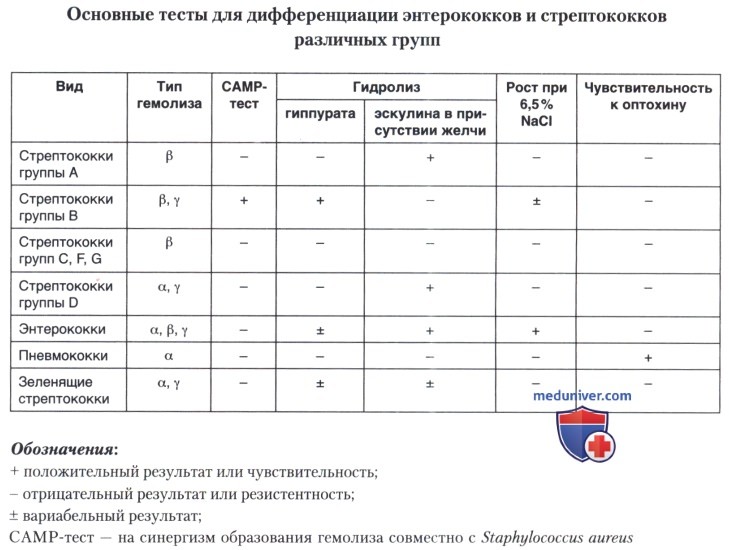
Особенно важно дифференцировать энтерококки и стрептококки группы D по способности расти в бульоне с 6,5 % NaCl и часто по гидролизу гиппурата.
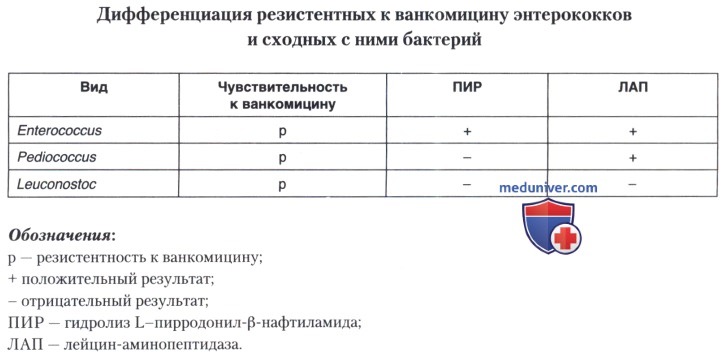
При кажущейся простоте такой идентификации, возможны ошибки в дифференциации стрептококков и энтерококков в случае обнаружения в дальнейшем устойчивости к ванкомицину у выделенного штамма. Чтобы избежать такой ошибки, R. R. Facklam был предложен простой метод идентификации каталазоотрицательных не р-гемолитических, грамположительных кокков в трех тестах — ПИР, ЛАП (в дисках), а также с использованием дисков с ванкомицином (30 мкг в диске) на резистентность к нему, что позволит отличить энтерококки от стрептококков и других стрептококкоподобных бактерий.
Поскольку штаммы энтерококков Е. faecalis и Е. faecium имеют наибольшую значимость в медицинской практике, в подавляющем большинстве случаев приходится идентифицировать штаммы энтерококков этих двух видов. Наиболее известна схема, представленная R. Facklam и J. Washington, которая пригодна также для идентификации других представителей рода Enterococcus.
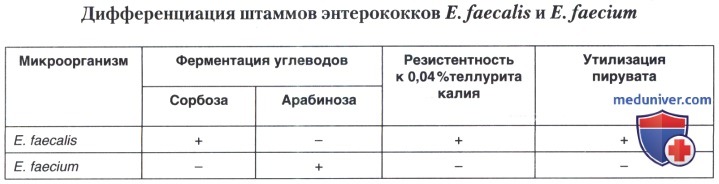
Оба вида энтерококков различаются по ферментации углеводов, по резистентности к 0,04% теллурита калия и по утилизации пирувата. На этом основании для выделения и идентификации штаммов только Е. faecium используют селективный агар с цефалоспориновым антибиотиком цефалексином, препаратом из группы монобактамов — азтреонамом, углеводом арабинозой и цветным индикатором.
Приведенные выше методы первичной видовой идентификации энтерококков сведены нами в основном к выявлению отличий их от стрептококков и некоторых стрептококкоподобных кокков, а также к описанию методов, пригодных для выявления различий между штаммами E.faecalis и E.faecium, поскольку они наиболее часто встречаются в материале, полученном от больных и из окружающей среды.

В мировой практике в настоящее время применяются методы идентификации энтерококков, предложенные для 27 видов, которые разбиты на 5 больших групп с применением для этой цели 11 фенотипических характеристик.
Такую идентификацию на уровне вида требуется проводить, поскольку нужно знать, какие из этих видов, кроме уже хорошо известных, таких как Е. faecalis и Е. faecium, встречаются в нашей стране. Это особенно важно при анализе внутрибольничных вспышек, вызванных энтерококками. Фенотипические дифференциально-диагностические признаки известных 27 видов энтерококков представлены в следующей статье на сайте.
- Читать далее "Идентификация видов энтерококков и разделение их по группам"
Редактор: Искандер Милевски. Дата публикации: 16.3.2020
- Род Enterococcus (энтерококки): таксономия, характеристика
- Резистентность энтерококков к антибактериальным препаратам
- Образование биопленок энтерококками
- Бактериоцины энтерококков
- Факторы патогенности энтерококков
- Заболевания вызываемые энтерококками
- Эпидемиология энтерококковой инфекции
- Методы первичного выделения энтерококков
- Идентификация видов энтерококков и разделение их по группам
- Определение чувствительности энтерококков (Enterococcus spp.) к антибиотикам
- Лечение инфекций вызываемых энтерококками
