Факторы риска оппортунистических инфекций у онкологических больных
а) Злокачественные опухоли. Основы патогенеза, клиники и принципы лечения. Злокачественные опухоли представляют собой достаточно разнородную группу заболеваний, способных развиваться из клеток любой органной или тканевой принадлежности.
По своему происхождению (гистогенезу) злокачественные опухоли наиболее обще могут быть подразделены на следующие категории:
• опухоли, развивающиеся из кроветворной ткани (лейкозы, лимфомы, миеломная болезнь и т. д.), — гематологические злокачественные новообразования (гемобластозы);
• опухоли из других тканей организма — солидные (от лат. solidus — твердый, прочный, массивный) злокачественные новообразования:
— опухоли, развивающиеся из клеток эпителиальной природы, — раки (плоскоклеточный рак, базально-клеточный рак, железистый рак — аденокарцинома и т.д.);
— опухоли мезенхимальной природы (мягкотканные саркомы, остеогенная саркома и т.д.);
— другие виды солидных опухолей.
Гематологические опухоли в данной главе рассматриваться не будут.
Вне зависимости от органной принадлежности для злокачественных опухолей характерен ряд общих черт, на основании которых они и выделяются в отдельную группу заболеваний. Уникальной особенностью злокачественных опухолей является то, что опухолевые клетки морфологически, функционально и генетически отличаются от нормальных клеток организма, из которых произошли. Опухолевые клетки (даже высокодифференцированные) не способны полностью воссоздавать архитектонику нормальных тканей. Злокачественная опухоль способна к инвазивному росту (разрушение подлежащих структур) и метастазированию (перемещению опухолевых клеток с их приживлением и пролиферацией в органах и тканях, отличающихся от ткани, из которой развилась первичная опухоль). Злокачественные клетки менее чувствительны к сигналам, подавляющим пролиферацию и/или вызывающим гибель при повреждении генетического аппарата (программированная клеточная гибель — апоптоз).
Причины возникновения злокачественных опухолей до настоящего времени изучены недостаточно. Одним из предполагаемых факторов является нарушение функций иммунной системы. Для ряда опухолей (например, ассоциированных со СПИДом или медикаментозной иммуносупрессией) эта связь является очевидной, для других — лишь предположительной (отсутствие реакции иммунной системы на опухолевые клетки, несущие антигены, отличающиеся от нормальных антигенов организма). Кроме того, в процессе канцерогенеза напрямую задействован ряд микроорганизмов. Например, Helicobacter pylori может приводить к развитию MALT-лимфомы желудка, а вирус папилломы человека — к раку шейки матки. Вирусы гепатита Ви С ассоциированы с развитием гепатоцеллюлярного рака печени и некоторых других опухолей (рак почки, некоторые виды лимфом). Отвечают за развитие опухолей и некоторые паразиты — Schistosoma haematobium (плоскоклеточный рак мочевого пузыря), Opisthorchis viverrini, Clonorchis sinensis и Opisthorchis felineus (рак желчных протоков).
В зависимости от распространенности солидные опухоли принято разделять на стадии. При разных локализациях первичной опухоли определения стадии могут варьировать, однако при всех опухолях основной принцип одинаков: большая стадия соответствует большей распространенности опухоли. Выделение стадий необходимо для определения лечебной тактики и прогноза.
При I—II стадиях (локализованное заболевание) опухоль обычно ограничена пределами исходного органа с возможным вовлечением регионарных лимфатических узлов. При III—IV стадиях (местнораспространенные и метастатические опухоли соответственно) наблюдается вовлечение смежных органов и наличие отдаленных метастазов. При локализованном заболевании обычно используются локальные методы лечения (хирургическое удаление, лучевая терапия), которые могут дополняться профилактическим назначением системной терапии (химиотерапия, гормонотерапия). При местнораспространенных опухолях по возможности также используются локальные методы лечения с обязательным добавлением системной противоопухолевой терапии. При наличии отдаленных метастазов ведущую роль играет системная (лекарственная) противоопухолевая терапия.
Операции при злокачественных опухолях обычно весьма травматичны и предусматривают удаление больших массивов окружающих тканей и лимфатических узлов (в связи с опасением наличия клинически неопределяемых микрометастазов). При лечении онкологических больных инвазивные вмешательства используются и со вспомогательными (катетеризация, шунтирование и т. д.) или диагностическими (биопсия) целями.
Большинство используемых противоопухолевых химиопрепаратов (цитостатиков) представляет собой «яды», преимущественно, но не избирательно, действующие на опухолевые клетки. Учитывая, что мишени для химиопрепаратов (ДНК, веретено деления, ферменты и т.д.) находятся и в здоровых органах и тканях, они также повреждаются химиотерапией. Наиболее часто повреждаются кроветворные клетки костного мозга, что проявляется недостатком зрелых форменных элементов крови — лейкоцитов, тромбоцитов и эритроцитов (лейкопения, тромбоцитопения, анемия), и слизистые, что проявляется мукозитами (стоматит, энтеропатия, эзофагит). Возможны токсические повреждения и других органов и систем — печени, почек, легких, сердца и т. д.
Современные достижения онкологии сделали возможным излечение значительного числа больных (в том числе и с местнораспространенными и метастатическими опухолями), большинству больных даже с метастатическими опухолями удается значительно продлить жизнь и улучшить ее качество.
Тем более важным представляется минимизация осложнений, связанных с опухолевым ростом и/или противоопухолевым лечением, так как зачастую именно они, а не сама опухоль приводят к преждевременной смерти больного. К одним из наиболее важных и частых осложнений злокачественных новообразований и их лечения, несомненно, можно отнести оппортунистические инфекции.
б) Факторы риска возникновения оппортунистических инфекций у онкологических больных. Инфекционный процесс всегда является результатом негативного баланса между защитными способностями организма и вирулентностью микроорганизма. Неизмененная система противоинфекционной защиты организма, включающая барьерную функцию кожи и слизистых, неспецифический, гуморальный и клеточный иммунитет, обеспечивают эффективную защиту от большинства патогенов.
Как сама опухоль, так и ее лечение (химиотерапия, лучевая терапия, хирургия) могут приводить к нарушению этой стройной защитной системы, что увеличивает предрасположенность к инфекциям, а также тяжесть их течения.
Для выбора адекватной тактики профилактики и лечения инфекционно-воспалительных процессов крайне важным является точное знание качественных и количественных характеристик иммунных дефектов, имеющихся у пациента, а также видов микроорганизмов, чаще вызывающих инфекцию при данном иммунном дефекте.
Наиболее частые виды иммунных дефектов и возбудители, обычно встречающиеся при данном дефекте, представлены в таблице ниже.
Разумеется, риск развития инфекционных осложнений зависит и от степени иммуносупрессии, наблюдаемой у пациента.
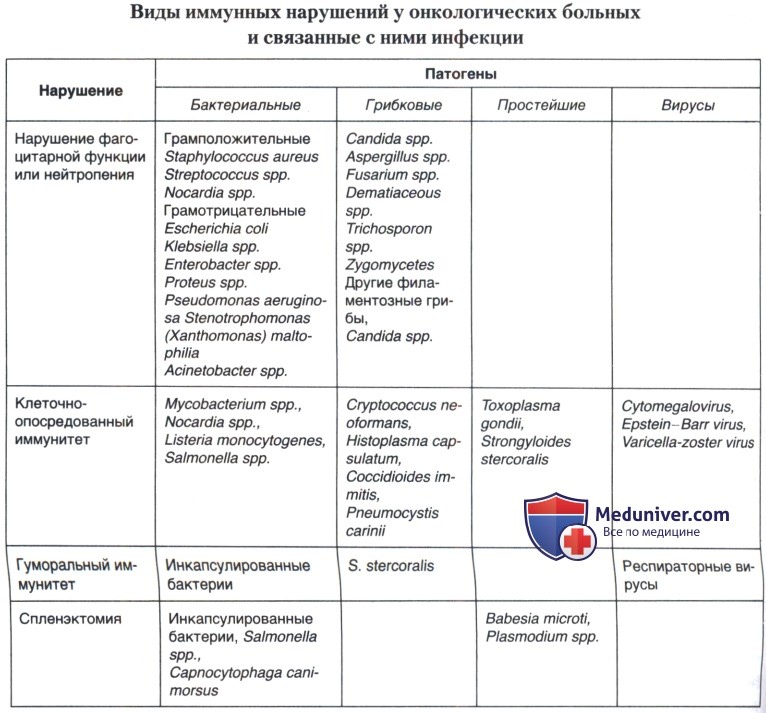
в) Инфекционные осложнения у онкологических пациентов без выраженной нейтропении, не получающих противоопухолевой и иммуносупрессивной терапии. Данная группа больных представляет собой наименее иммунокомпрометированную популяцию онкологических больных. Однако злокачественное новообразование само по себе может приводить к иммуносупрессии или нарушению барьерных функций тканей.
Опухоли надпочечников и эктопические опухоли, секретирующие адренокортикотропный гормон, могут приводить к повышению уровня кортизола в крови, что в свою очередь, способствует нарушению клеточного иммунитета. В связи с этим у данных пациентов повышается риск развития кандидоза слизистых, пневмоцистной пневмонии и инвазивного аспергиллеза.
В большинстве же случаев солидные опухоли приводят к повышенному риску инфекций за счет анатомических факторов и повреждения естественных барьеров.
Зачастую очагом инфекции, обусловленной различными патогенами (в зависимости от локализации опухоли), может быть зона некроза опухоли.
Опухоли головы и шеи сопровождаются образованием язв и эрозий, что может явиться причиной серьезных инфекций (септический тромбофлебит вен шеи, аспирационная пневмония), вызываемых микрофлорой ротовой полости.
Внутрибронхиальные опухоли часто ассоциируются с повторными обструктивными пневмониями (пневмония ателектазированной/гиповентилируемой части легкого).
Опухоли брюшной полости могут приводить к обструкции полых органов, например органов мочеполовой или желчевыводящей системы, что вызывает развитие пиелонефрита и холангита (соответственно). Прямая инвазия опухоли через слизистую толстой кишки может приводить к образованию абсцессов и/или сепсису, вызываемому кишечной микрофлорой (наиболее частым возбудителем, вызывающим бактериемию при раке прямой и ободочной кишки, является S. bovis). Возможно образование воспалительных инфильтратов, абсцессов, прилегающих к опухолям кишки (расположенных параканкрозно).
Рак молочной железы увеличивает риск развития мастита и абсцессов, наиболее часто обусловленных S. aureus.
Лечение злокачественного новообразования, вне зависимости от вызываемой им иммуносупрессии, также может повышать риск развития инфекционных процессов. Так, например, локальная радиотерапия может приводить к нарушению целостности слизистых, некрозам, уменьшению кровоснабжения тканей и, последующему плохому заживлению ран. Органные осложнения могут быть представлены пневмонитами, эзофагитом и энтеритом.
Имплантируемые устройства, такие как внутривенные катетеры, стенты в полых органах и т. д., также могут являться потенциальными очагами инфекции.
Во многом вид инфекционных процессов и микробный пейзаж зависят и от локализации опухоли или ее метастазов. Виды наиболее вероятных инфекционных осложнений в зависимости от локализации опухолевых очагов представлены в табице ниже.
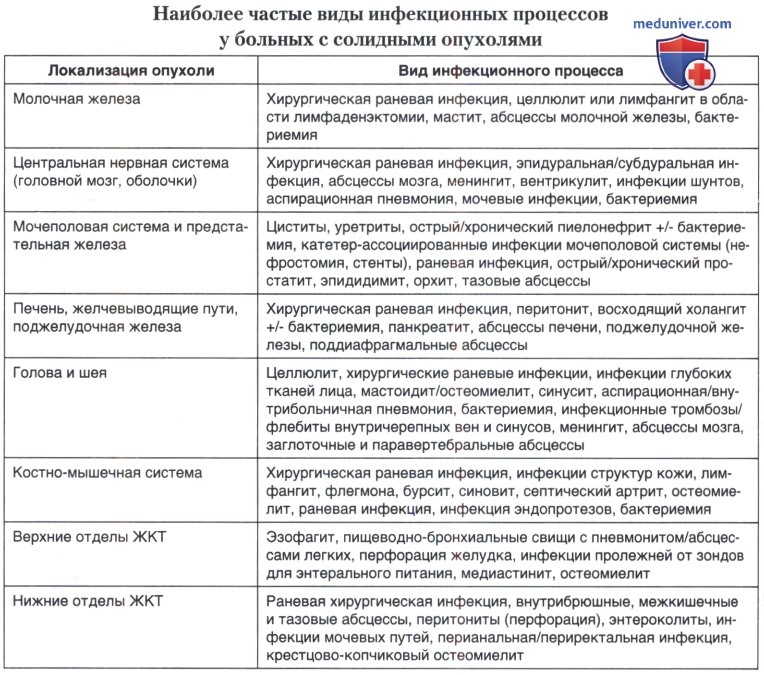
г) Инфекционные осложнения у онкологических пациентов с нейтропенией, получающих противоопухолевую и иммуносупрессивную терапию. Нейтрофилы являются критическим звеном защиты организма от бактериальных и некоторых грибковых инфекций. Нейтропения (снижение количества нейтрофилов) является наиболее частым и опасным видом иммуносупрессии у онкологических больных. Чаще всего ее развитие обусловлено токсическим воздействием химиотерапии и лучевой терапии на клетки костного мозга, отвечающие за кроветворение (клетки-предшественники гемопоэза).
Отсутствие или недостаток функционирующих нейтрофилов лишает организм первичного механизма защиты против проникающих патогенов.
Связь между выраженной нейтропенией (<0,5х109/л) и инфекцией была показана еще в 60-х годах прошлого века в классической работе Bodey и соавт. В данном исследовании 90% больных с диссеминированной грибковой инфекцией и 78% с септицемией имели уровень нейтрофилов менее 0,5x109/л. Кроме степени выраженности нейтропении, значительно повышала риск развития инфекционных процессов и ее продолжительность. При длительном сохранении нейтропении происходит и смена возбудителей. Если первая волна воспалительных процессов у больных с длительной нейтропенией в подавляющем большинстве случаев была обусловлена бактериями, то спустя 2 недели их причиной в 20% случаев являлись грибковые патогены (Candida spp., Aspergillus spp., Fusarium spp. и др.).
Диагностика инфекции у пациентов с нейтропенией может быть значительно затруднена из-за отсутствия типичных признаков инфекционного процесса. На фоне нейтропении могут отсутствовать или быть очень слабо выражены такие привычные признаки воспаления, как покраснение, отек, боль. Зачастую не выражена клиническая симптоматика (кашель и мокрота при пневмонии и т.д.) и даже рентгенологические признаки воспалительного процесса. Единственным симптомом инфекционного процесса, который наблюдается у пациентов с нейтропенией так же часто, как и при ее отсутствии, является лихорадка (повышение температуры до фебрильных цифр). К сожалению, одновременно с отсутствием клинической симптоматики инфекционного процесса отмечается ускорение диссеминации возбудителя, не сдерживаемого нейтрофилами. Бактериемия и/или фунгемия на фоне нейтропении встречаются значительно чаще.
До 85% возбудителей таких инфекции на фоне нейтропении являются эндогенными (исходно колонизирующими организм больного или приобретенные в период госпитализации). На фоне выраженной нейтропении существует возможность развития инфекций, обусловленных УПМ (в основном бактериальными), практически не вызывающими клинических проявлений без нейтропении (коагулазонегативны-ми стафилококками, лактобациллами и т.д.).
Последствия задержки диагностики и лечения инфекционных процессов на фоне нейтропении поистине катастрофичны. При синегнойной бактериемии 48-часовая отсрочка назначения антибиотиков приводила к гибели 50% больных.
В связи с этим при нейтропении наличие фебрильной лихорадки без выявленного очага инфекции или возбудителя (лихорадка неясного генеза) является достаточным основанием для назначения антибиотиков. Данное состояние получило название фебрильной нейтропении и характеризуется следующими признаками: уровень нейтрофилов менее 0,5x109/л или менее 1,0х109/л с тенденцией к быстрому снижению, на фоне которого в течение 24 ч отмечено 2 и более эпизодов повышения температуры тела более 38°С, измеренной в ротовой полости, или однократное повышение температуры более 38,3°С. Однако на фоне нейтропении меняются и подходы к лечению клинически и бактериологически документированной инфекции.
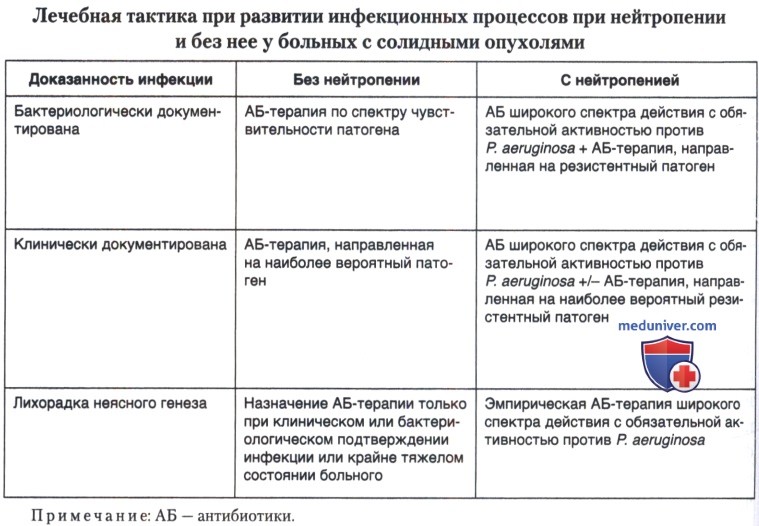
Основные отличия в подходах к лечению инфекционных процессов у больных с нейтропенией и без таковой представлены в таблице ниже.
Разумеется, такой подход не освобождает врача от необходимости поиска инфекционного очага и выявления возбудителя. Любой имеющийся патологический экссудат должен быть направлен на бактериологическое исследование (мокрота, гнойное отделяемое из носовых ходов, плевральная жидкость, аспират из области целлюлита и т.д.). Кроме того, на бактериологическое исследование в обязательном порядке должны быть направлены моча и кровь больного с подозрением на развитие нейтропенической инфекции. В случае наличия у пациента центрального сосудистого катетера, кроме пробы из периферической вены, должны быть взяты для посева образцы крови из просвета каждого катетера.
Нарушение иммунной функции слизистых желудочно-кишечного тракта, синусов, бронхов и трахеи, а также мочеполовой системы, которые являются первой линией защиты организма от многих патогенов, в результате химиотерапии и радиотерапии открывает «дорогу» колонизирующим их микроорганизмам в подлежащие ткани и кровь. В ряде случаев применение такой терапии приводит к крайне выраженному повреждению слизистых желудочно-кишечного тракта, на фоне которого происходит массивная транслокация его микрофлоры, что представляет жизнеугрожающую ситуацию. Применение кортикостероидов может приводить к повреждению ассоциированной со слизистыми лимфоидной ткани, снижению секреции иммуноглобулинов класса А и антимикробных ферментов (лизоцима, фосфолипазы А2 и т.д.). Поражение слизистых увеличивает риск развития тяжелых системных инфекций, обусловленных микрофлорой ротовой полости и желудочно-кишечного тракта.
Кортикостероиды подавляют миграцию нейтрофилов в области воспаления и угнетают их фунгицидную активность (что увеличивает риск развития грибковых инфекций), приводят к значительному снижению уровня и подавлению функциональной активности моноцитов, ингибируют активацию Т-лимфоцитов, а в больших дозах и выработку иммуноглобулинов В-лимфоцитами. Применение кортикостероидов провоцирует развитие инфекций, связанных с нарушением фагоцитарной функции (S. aureus, бактерии рода Enterobacteriaceae и т.д.) и клеточно-опосредованного иммунитета (опоясывающий герпес, P.jiroveci (carinii)).
Интерлейкин-2 — цитокин, в норме являющийся важным компонентом иммунной системы, используется для лечения меланомы и светлоклеточного рака почки. Применение высоких доз ИЛ-2 увеличивает риск развития бактериальных инфекций, в основном обусловленных S. aureus и коагулазонегативными Staphylococcus spp.
Спленэктомия — удаление селезенки входит в стандарты хирургического вмешательства при раке желудка и используется при ряде гематологических опухолей. Крайне важной функцией селезенки является удаление неопсонизированных бактерий, что обеспечивает защиту от инкапсулированных микроорганизмов, к которым у пациента еще нет иммунитета. Больные после спленэктомии относятся к группе высокого риска развития молниеносного сепсиса, вызываемого такими патогенами. Наиболее частыми возбудителями, отвечающими за фульминантные инфекции у больных с удаленной селезенкой, являются S. pneumoniae, Н. influenzae и N. meningitidis. Реже встречаются Capnocytophaga spp. и Salmonella spp.
Изменение колонизирующей микрофлоры. У ослабленных госпитализированных онкологических пациентов может происходить изменение нормальной микрофлоры верхних дыхательных путей и колонизация их аэробными грамотрицательными бактериями.
При лечении их антибиотиками широкого спектра действия, способными подавлять нормальную микрофлору кишечника, отмечается развитие дисбиоза. У онкологических пациентов достаточно часто в кале обнаруживаются избыточные количества Р. aeruginosa, а внутрибольничные инфекции, вызываемые данным патогеном, могут наблюдаться в ближайшие сроки после выявления возбудителя в стуле. До 85% инфекций, выявляемых у пациентов в период нейтропении, обусловлены эндогенными УПМ, колонизирующими слизистые и кожу до развития нейтропении (причем до 50% колонизирующих патогенов, вызывающих инфекцию на фоне нейтропении, больной приобретает за время госпитализации).
- Читать далее "Бактерии вызывающие оппортунистические инфекции у онкологических больных"
Редактор: Искандер Милевски. Дата публикации: 17.8.2020
- Оппортунистические инфекции при истинной акантолитической пузырчатке
- Кожные оппортунистические инфекции при ВИЧ-инфекции и СПИДе
- Факторы риска оппортунистических инфекций у онкологических больных
- Бактерии вызывающие оппортунистические инфекции у онкологических больных
- Грибы вызывающие оппортунистические инфекции у онкологических больных
- Токсоплазмоз у онкологических больных
- Лечение инфекции у онкологических больных при нейтропении
- Бактериемия у онкологических больных
- Особые инфекции у онкологических больных
- Факторы риска у онкогематологических больных
