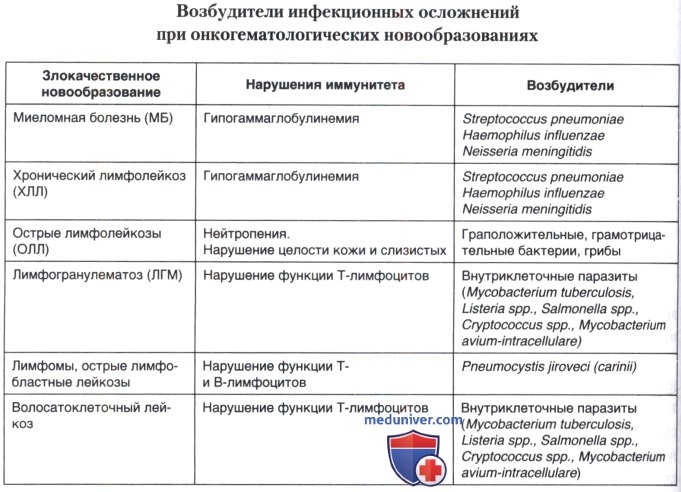
Факторы риска у онкогематологических больных
В группу онкогематологических заболевания по классификации ВОЗ 2001 г. включены: острые лейкозы, миелопролиферативные опухоли, лимфопролиферативные заболевания (опухоли лимфатической системы).
Инфекционные осложнения остаются актуальной проблемой и одной из основных причин смерти у больных онкогематологических стационаров. По данным аутопсии, от них умирает большинство страдающих острыми лейкозами и половина страдающих лимфомами и лимфогранулематозом. Инфекционные процессы могут возникать на любых этапах заболеваний системы крови. Летальность может быть снижена благодаря своевременной и точной диагностике этиологических факторов инфекционного осложнения. Однако данные о чувствительности и специфичности методов диагностики таких осложнений у иммунокомпрометированных больных с поражениями системы крови противоречивы. Меняющийся спектр возбудителей инфекций, рост их антибиотикорезистентности, увеличение числа пациентов, относящихся к группе риска развития нейтропенической лихорадки, требует не только пристального внимания клиницистов к данной проблеме, но и разработки четких рекомендаций по диагностике развившегося патологического состояния и ведению таких больных.
В генезе инфекционных осложнений у пациентов с онкогематологическими заболеваниями участвует сложный многофакторный механизм, в котором взаимодействует множество специфических и неспецифических, анатомических, местных, гуморальных и клеточных компонентов. Определяющим фактором развития у них инфекционных процессов является значительный дефект функциональной активности иммунной системы.
Специфические звенья иммунитета представлены иммуноглобулинами различных классов, секретируемых В-лимфоцитами и плазматическими клетками. К неспецифическим клеточным факторам относятся моноциты, нейтрофилы, эозинофилы, а также многочисленные белковые компоненты. Между отдельными звеньями антиинфекционной защиты существуют сложные множественные взаимодействия и имеет место определенное «дублирование» функций.
Однако дефицит основных звеньев иммунной системы не может быть компенсирован другими компонентами и развитие инфекций практически неизбежно. В зависимости от того, какие факторы иммунитета «выпадают», можно предсказать специфический спектр инфекций. В частности: при острых лейкозах инфекции связаны с гранулоцитопенией; при лимфомах и трансплантации костного мозга — с дисфункцией Т-клеток; при лимфогранулематозе, множественной миеломе или хроническом лимфолейкозе — с нарушением гуморального иммунитета, первично опосредованного В-лимфоцитами, и продукцией антител. Лечение цитостатиками усугубляет этот дефицит, а нейтропения является предрасполагающей причиной к развитию инфекционных осложнений, причем важную роль играет как глубина нейтропении, так и ее длительность. До 50% инфекций при нейтропении могут вызываться госпитальными штаммами микроорганизмов. Эти микроорганизмы являются более резистентными к большинству используемых антибиотиков.
У онкогематологических больных можно выделить следующие факторы риска развития инфекции:
• нейтропения;
• нарушение клеточного иммунитета;
• нарушение гуморального иммунитета;
• повреждение анатомических барьеров;
• различные медицинские манипуляции.
При одновременном присутствии нескольких факторов риска вероятность возникновения инфекции возрастает.
а) Нейтропения является одним из наиболее важных факторов, предрасполагающих к развитию инфекционных осложнений у больных гематологическими заболеваниями. Нейтрофилы — это необходимый компонент естественной защиты организма против бактериальных и некоторых других форм инфекций Причин для снижения числа циркулирующих нейтрофилов может быть много: вытеснение миелоидных предшественников костного мозга злокачественным клоном у больных острым лейкозом; как следствие интенсивной цитостатической химиотерапии или трансплантации костного мозга; различная степень нейтропении наблюдается при опухолевом поражении костного мозга, после лучевой терапии и при введении некоторых препаратов (ганцикловир, бисептол).
Частота и тяжесть инфекции обратно пропорциональны абсолютному количеству гранулоцитов. К дополнительным факторам риска следует отнести скорость падения числа гранулоцитов (быстрое падение нередко связано с инфекцией) и длительность апластической фазы кроветворения. Большинство инфекций и практически все тяжелые инфекции у больных с нейтропенией возникают при числе гранулоцитов < 500 кл./мм3 (в особенности < 100 кл./мм3).
Кроме количественного уменьшения имеют место и качественные изменения функций нейтрофилов. К ним относятся нарушения процессов хемотаксиса, фагоцитоза и реализации бактерицидных свойств. В некоторых случаях, при сохранении нормального фагоцитоза, наблюдается дефект миграционных свойств лейкоцитов и хемотаксиса. Это характерно для пациентов с лимфомами (в том числе и для больных, которые не получали химиотерапию). Ряд противоопухолевых препаратов ингибирует фагоцитоз, а комбинации некоторых из них (даунорубицин, метотрексат и винкристин) подавляют бактерицидную активность нейтрофилов. Фагоцитарные и миграционные функции нейтрофилов, процессы хемотаксиса также изменяют радио- и кортикостероидная терапия.
Конечным продуктом клеточной иммунной защиты является активация макрофагов или моноцитов, которые предназначены для переваривания и уничтожения внутриклеточных патогенов. Их предшественники — промоноциты — образуются в костном мозге и стимулируются к дифференцировке до моноцитов эндогенным гранулоцитарно-макрофагальным колониестимулирующим фактором (ГМ-КСФ).
Моноциты быстро покидают костный мозг и циркулируют в крови в течение 3-5 дней до миграции в ткани. Тканево-специфические факторы способствуют превращению моноцитов в макрофаги. Последние живут в различных органах (печень, легкие, селезенка, стенка кишки, соединительная ткань и т.д.) от 4 до 12 недель, что позволяет им сохранять фагоцитарную активность в отношении различных патогенов в период глубокой нейтропении. Зрелые макрофаги более устойчивы к воздействию цитостатиков и представляют важный элемент фагоцитарной системы.
Макрофаги участвуют в запуске реакций иммунного ответа, синтезируют гемоцитокины, играющие роль в гранулоцитопоэзе. Активация макрофагов и их способность разрушать факультативные внутриклеточные микробы зависит от γ-ИНФ, ФНО, ГМ-КСФ и высвобождения лимфокинов Т-лимфоцитами. Эти медиаторы ответственны за возникновение лихорадки, синтез белков острой фазы в печени, активацию Т- и В-лимфоцитов и за метаболические изменения, препятствующие бактериальной пролиферации — мобилизации аминокислот, снижению содержания сывороточного железа и цинка, повышению уровня сывороточной меди.
Активированные тканевые макрофаги представляют важный элемент защиты в отношении таких внутриклеточных микроорганизмов, как микобактерии, листерии, бруцеллы и токсоплазмы. В случае повреждения функции макрофагов, что наблюдается при использовании стероидов, первичная резистентность в отношении этих патогенов значительно снижается.
б) Изменения клеточного и гуморального иммунитета. Повышенной предрасположенности больного к инфекции способствуют дефекты мононуклеарно-фагоцитарной системы или Т-лимфоцитов. В частности, известно, что нарушение Т-клеточного ответа имеет место при различных онкогематологических заболеваниях: ХЛЛ/ОЛЛ; ЛГМ, трансплантации костного мозга. Дефекты в мононуклеарно-фагоцитарной системе могут присутствовать у больных моноцитарным лейкозом (повреждение фагоцитоза и чрезмерная продукция ИЛ-1, сопровождающиеся высокой лихорадкой) и ЛГМ; у пациентов, получающих кортикостероидную терапию, и при некоторых вирусных инфекциях (ЦМВ). Нарушения Т-клеточного иммунитета повышают предрасположенность пациентов к грибковым, вирусным (герпес, цитомегаловирус) и внутриклеточным (листерия, сальмонелла) патогенам. У пациентов с недостаточностью Т-клеточного иммунитета отмечается повышенная склонность к пневмоцистным пневмониям.
При некоторых гематологических новообразованиях (ХЛЛ, ЛГМ, МБ) нарушается способность генерировать специфические антитела, нейтрализующие патогены. Пациенты с подобными дефектами гуморального иммунитета склонны к инфекциям даже при нормальном числе нейтрофилов. Чаще всего у них встречаются инфекции, вызванные инкапсулированными патогенами (стрептококки, гемофильная палочка, нейссерия).
Химиотерапия и облучение способны дополнительно повреждать функции Т-и В-лимфоцитов, что приводит к снижению их активности. Обычно при цитостатической терапии имеет место снижение содержания хелперных Т-лимфоцитов, поэтому нередко лимфопения регистрируется в течение нескольких месяцев после окончания химиотерапии, в то время как показатели нейтрофилов, моноцитов и тромбоцитов восстанавливаются. Длительная деплеция (негативная селекция) Т-лимфоцитов обусловливает повышенный риск развития таких инфекций, как герпес, пневмоцистная пневмония и др.
в) Повреждение анатомических барьеров и различные медицинские манипуляции. Нормальные анатомические барьеры, включающие неповрежденные кожные покровы, ротоглотку, респираторный тракт, желудочно-кишечный тракт и мочеполовые пути, представляют собой важные механизмы защиты макроорганизмов от микробной инвазии. В результате их нарушений риск внутрибольничной инфекции у больных в стационаре резко возрастает.
Кожа и слизистые оболочки — это два основных барьера на пути микробного проникновения. В норме они колонизированы различными представителями бактерий и грибов, занимающих данную экологическую нишу в тесной связи с организмом и помогающих поддерживать эту линию защиты. Здоровая кожа, будучи неповрежденной, является эффективным барьером на пути инвазии микроорганизмов. Секреты потовых и сальных желез создают кислую реакцию, обусловленную наличием жирных кислот, и обеспечивают противомикробную активность, которая способствует элиминации патогенных микроорганизмов. Пот, кроме того, содержит секреторные IgA и соли, обеспечивающие поддержание высокого осмотического давления. К таким условиям лучше приспособлены представители грамположительной флоры (это различные виды эпидермального стафилококка, коринобактерий и др.), а здоровая кожа становится враждебной экзогенным грамотрицательным микроорганизмам.
У онкологических больных кожные покровы поражаются довольно часто, а сыпь служит важным диагностическим признаком системных бактериальных и грибковых инфекций. Невинные, на первый взгляд, пятна или папулы у больных с нарушенным иммунитетом могут оказаться первым симптомом бактериального или грибкового сепсиса.
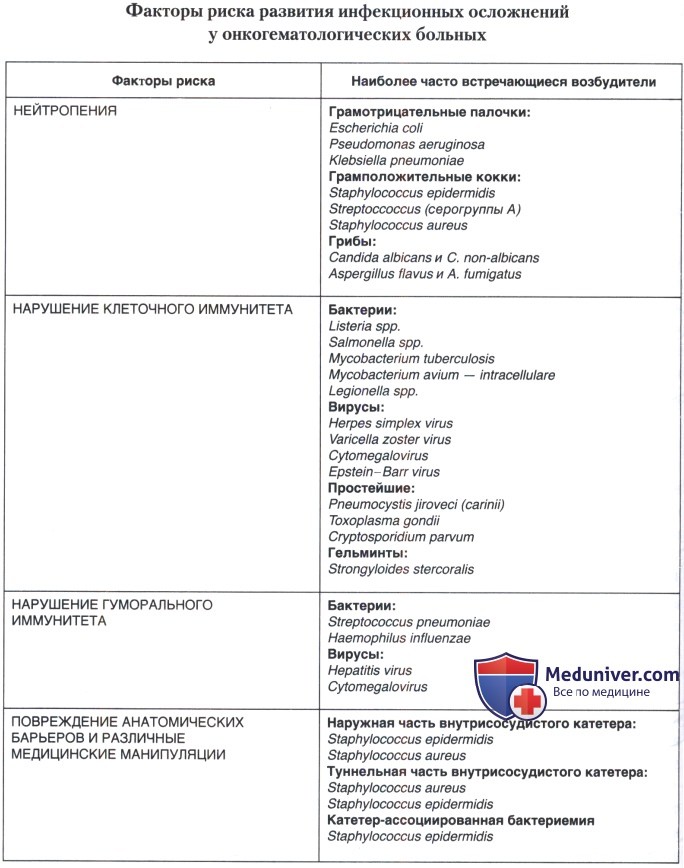
г) Воротами инфекции нередко служат венозные катетеры, необходимые для проведения химио- и сопроводительной терапии. В 80% случаев эти инфекции вызываются грамположительными бактериями, в частности представителями микрофлоры кожи (например, коагулазонегативными стафилококками). Причиной катетерной инфекции могут быть инфицированные растворы и системы для внутривенных инфузий. Иногда катетер сам становится очагом инфекции, если во время приходящей бактериемии микроорганизмы осели на его дистальном конце и начали там размножаться. Инфекция, имеющая отношение к наружной части катетера, особенно инфекция выходной части и туннеля, встречается гораздо реже, чем инфекция внутренней поверхности.
Нарушение анатомических барьеров связано и с установкой мочевых катетеров, использованием оборудования для длительных инфузий, травмами кожи больных при венепункции или повреждением слизистых при эндоскопических манипуляциях. Все вышеперечисленные факторы, а также развитие нейтропении или клеточного иммунодефицита в результате цитостатической терапии предрасполагают к развитию инфекций.
В полости рта обитает целый ряд условно-патогенных аэробных и анаэробных бактерий. При нарушениях иммунитета, вызванных цитостатиками, на слизистой рта появляются изъязвления. Поврежденная слизистая оболочка может стать входными воротами для микроорганизмов, обычно вегетирующих в полости рта, в частности для представителей группы зеленящих стрептококков, Capnocytophaga spp. и других. Применение препаратов, снижающих секрецию в желудке (блокаторы Н2-рецепторов гистамина), приводит к нарушению естественного барьера, препятствующего колонизации кишечника представителями флоры ротовой полости, большинство из которых резистентны к антибиотикам, используемым для профилактики инфекции. При мукозите обильная слизь, содержащая флору ротовой полости, попадает в желудок, где в отсутствие кислотного барьера микроорганизмы сохраняют жизнеспособность, а затем мигрируют в кишечник. Это приводит к расселению этих эактерий на протяжении всего алиментарного тракта.
Среди всех экзогенных влияний на нормальную микрофлору самые выраженные изменения вызывают антимикробные препараты. Антибиотики широкого спектра действия могут подавлять неинвазивную и потенциально благоприятную микрофлору (главным образом анаэробы), обеспечивающую защиту против колонизации и инфекций, вызываемых патогенными микроорганизмами, тем самым нарушая эндогенную микробную защиту (колонизационную резистентность). Нарушение колонизационной резистентности ведет к проникновению и размножению госпитальных штаммов, например резистентных грамотрицательных палочек, энтерококков или грибов. Микробная флора не единственный фактор, обусловливающий колонизационную резистентность. Организм хозяина может влиять на нее за счет таких факторов, как состояние слизистой оболочки, продукции слюны, перистальтики, кислотности желудочного секрета и уровня секреторного IgA. При нарушении нормального баланса микробной флоры и повреждении слизистых барьеров может возникнуть транслокация бактерий в регионарные лимфоузлы и кровоток. Этим можно объяснить некоторые случаи лихорадки неясного генеза. Следует иметь в виду, что даже при отсутствии отчетливых изменений слизистых возможно развитие бактериемии.
Кишечная проницаемость может значительно усиливаться при назначении цитостатиков или при вирусном поражении кишечника. В случаях токсической энтеропатии парентеральное питание приводит к снижению объема волокнистого кишечного содержимого, что вместе с редуцированной микробной биомассой уменьшает количество фекалий и снижает моторную функцию кишечника. Это опосредованно увеличивает концентрацию и длительность нахождения антибиотиков в кишечном пространстве. В таких условиях повреждение естественной микрофлоры могут вызывать даже те антибиотики, которые обычно редко влияют на колонизационную резистентность (азтреонам, имипенем).
- Читать далее "Тактика врача при диагностике инфекционных осложнений в гематологии"
- Вернуться в оглавление раздела "Медицинская микробиология"
Редактор: Искандер Милевски. Дата публикации: 17.8.2020
- Оппортунистические инфекции при истинной акантолитической пузырчатке
- Кожные оппортунистические инфекции при ВИЧ-инфекции и СПИДе
- Факторы риска оппортунистических инфекций у онкологических больных
- Бактерии вызывающие оппортунистические инфекции у онкологических больных
- Грибы вызывающие оппортунистические инфекции у онкологических больных
- Токсоплазмоз у онкологических больных
- Лечение инфекции у онкологических больных при нейтропении
- Бактериемия у онкологических больных
- Особые инфекции у онкологических больных
- Факторы риска у онкогематологических больных
