Необратимое повреждение и гибель кардиомиоцитов при ишемии
Вследствие того что доставка кислорода в сердце тесно связана с коронарным кровотоком, внезапное прекращение регионарной перфузии после тромботической коронарной окклюзии быстро приводит к остановке аэробного метаболизма, истощению креатинфосфатов и запуску анаэробного гликолиза. За этим следуют накопление лактата в тканях, прогрессивное снижение уровней тканевого АТФ и накопление катаболитов, включая пул адениннуклеотидов.
При продолжении ишемии развивается тканевой ацидоз и происходит выход натрия во внеклеточное пространство. В дальнейшем уровень АТФ падает ниже уровня, необходимого для поддержания функций мембран, приводя к гибели миоцитов.
а) Необратимое повреждение и гибель миоцитов. Развитие во времени и объем необратимого повреждения тканей в результате коронарной окклюзии могут значительно различаться в зависимости от трансмуральной локализации, остаточного коронарного кровотока и гемодинамических составляющих потребления кислорода. Необратимое повреждение миокарда начинается через 20 мин коронарной окклюзии при отсутствии значимых коллатералей.
Необратимое повреждение начинается с субэндокарда и развивается по типу кругов на воде от субэндокардиальных слоев до субэпикардиальных. Этот процесс отражает более высокое потребление кислорода субэндокардом и перераспределение коллатерального кровотока во внешние слои сердечной стенки из-за сокращения и пониженного коронарного давления. При экспериментальном ИМ субэндокард полностью и необратимо повреждается уже через 1 час после окклюзии, а трансмуральное развитие ИМ в основном завершается через 4-6 час.
Факторы, которые повышают потребление кислорода миокардом (например, тахикардия) или снижают его доставку (например, анемия, артериальная гипотензия), ускоряют развитие необратимого повреждения. И наоборот, повторные транзиторные ишемии или наличие стенокардии перед окклюзией могут уменьшить необратимые повреждения за счет прекондипионирования.
Величина остаточного коронарного кровотока по коллатералям или при субтотальной коронарной окклюзии является наиболее важным фактором реального времени, определяющим развитие необратимого повреждения у пациентов с хронической ИБС. Связь между размером ИМ и зоной риска ишемии при тотальной окклюзии обратно пропорциональна коллатеральному кровотоку. Когда субэндокардиальный коллатеральный кровоток составляет более 30% уровня кровотока в покое, это предотвращает развитие ИМ в результате ишемии, продолжающейся более 1 час.
Менее выраженная субэндокардиальная ишемия при субтотальной окклюзии (например, кровоток снижен на > 50%) может длиться как минимум 5 час без развития значительного необратимого повреждения. Это объясняет тот факт, что признаки и симптомы ишемии могут наблюдаться длительно без развития выраженного миокардиального некроза. Также этим можно объяснить наблюдения, когда поздняя коронарная реперфузия при продолжающейся ишемии спасает миокард по истечении 6 час, что предсказывалось результатами экспериментов на животных моделях инфаркта миокарда (ИМ).
При инфаркте миокарда (ИМ) гибель клеток является результатом двух различных механизмов. Реперфузия сразу вызывает некроз КМЦ и разрыв сарколеммы с просачиванием клеточного содержимого во внеклеточное пространство. В дальнейшем повреждение усиливается появлением лейкоцитов в этой зоне. В более поздние сроки КМЦ, которые изначально были спасены, подвергаются апоптозу (запрограммированной гибели клетки), что вносит свой вклад в дальнейшее повреждение миокарда.
Апоптоз — это скоординированная инволюция миоцитов, которая предотвращает воспаление, связанное с гибелью клетки вследствие некроза. Из-за того что апоптоз является энергозависимым процессом, клетка может быть переключена на некротический механизм при истощении запасов энергии до критических уровней. В связи с этим определение важности каждого из механизмов при ИМ проблематично и остается предметом споров.
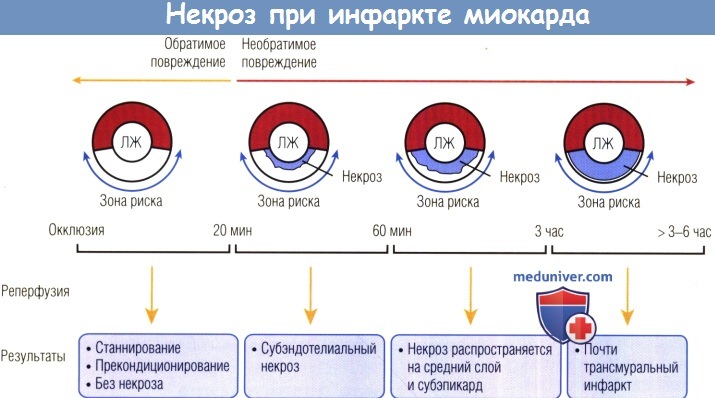
Общее время окклюзии < 20 мин не вызывает необратимого повреждения, но может привести к станнированию миокарда, а также способствовать прекондиционированию и защите сердца в случаях повторных ишемических атак.
Необратимое повреждение развивается через 20 мин и распространяется волновым фронтом от эндокарда к эпикарду.
Через 60 мин внутренняя треть стенки левого желудочка (ЛЖ) повреждается необратимо.
Через 3 час ишемии остается субэпикардиальный слой ткани, не вовлеченный в трансмуральный процесс формирования инфаркта после 3-6 час окклюзии.
Наиболее важным фактором задержки развития необратимого повреждения является уровень коллатерального кровотока, который направлен преимущественно на внешние слои миокарда.
б) Обратимая ишемия и перфузионно-сократительное соответствие. Обратимая ишемия развивается значительно чаще, чем необратимое повреждение. Ишемия, индуцированная снижением доставки крови, может произойти при тран-зиторной коронарной окклюзии в результате коронарного вазоспазма или вре'менного тромбоза критически стенозированной КА, приводя к трансмуральной ишемии, подобной той, что развивается в начале ИМ. Ишемия, индуцированная повышением потребности в кислороде, возникает вследствие невозможности усилить кровоток в ответ на увеличение потребления кислорода миокардом, при этом ишемия преимущественно воздействует на субэндокард.
Все это оказывает прямо противоположные эффекты на расслабление миокарда в фазу диастолы: ишемия, индуцированная снижением поступления кислорода, повышает эластичность ЛЖ, а ишемия, индуцированная повышением потребности в кислороде, ухудшает ее. Существует типовая последовательность физиологических изменений, которые происходят при эпизоде спонтанной трансмуральной ишемии. Коронарная окклюзия сразу приводит к падению коронарного венозного насыщения со снижением продукции АТФ. Это служит причиной ухудшения регионарного сокращения вплоть до полной дискинезии в течение нескольких ударов сердца за 1 мин.
Прекращение сокращения этой зоны влияет на снижение глобальной сократимости ЛЖ (dP/dt), прогрессивное повышение КДД в ЛЖ и снижение САД.
Выраженность системных гемодинамических изменений варьирует в зависимости от глубины ишемии, а также от ее распространенности по ЛЖ. Значительные электрографические изменения сегмента ST развиваются в течение 2 мин при достижении критического уровня выхода натрия во внеклеточное пространство. Симптомы боли в груди различны и, как правило, развиваются при ишемии в последнюю очередь. При восстановлении перфузии наблюдается обратная последовательность — сначала прекращается боль, потом исчезают гемодинамические изменения, но регионарная сократимость может оставаться угнетенной, отражая станнирование миокарда.
Подобное развитие событий по времени происходит при ишемии, индуцированной ФН, хотя интервалы времени могут быть более протяженными, т.к. ишемия сначала затрагивает субэндокард. Вследствие временной задержки развития стенокардии и других признаков многие эпизоды депрессии сегмента ST остаются симптоматически «немыми». Также вероятно, что очень короткие эпизоды ишемии, на которые более чутко реагируют такие параметры, как регионарная сократимость (снижением) или КДД (повышением), не проявляются изменениями на ЭКГ.
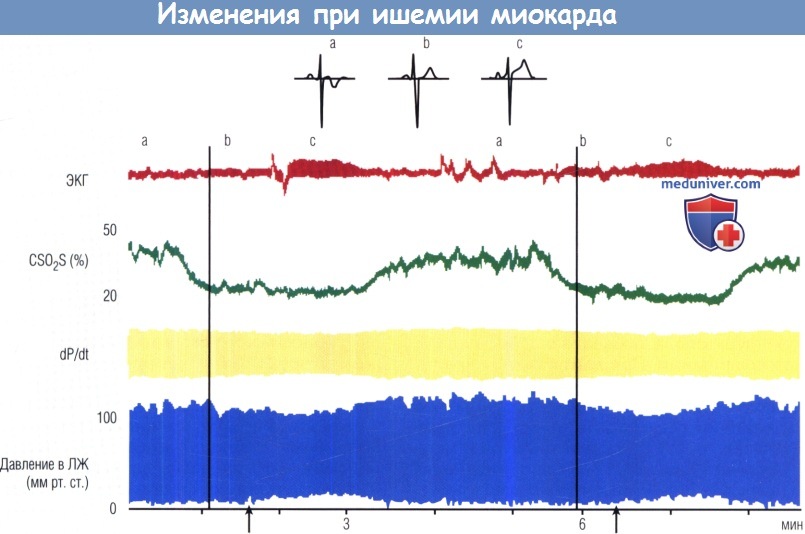
Высокоскоростная электрокардиография (ЭКГ) отражает фоновое состояние (а), псевдонормализацию зубца Т при ранней ишемии (b) и элевацию сегмента ST в поздней фазе ишемии (с).
Начальное снижение коронарного кровотока происходит за счет внезапного падения коронарной венозной сатурации (CSO2S).
Вскоре после этого происходит падение отношения dP/dt левого желудочка (ЛЖ), отражая регионарную сократительную дисфункцию (вертикальные линии).
Через 1 мин конечное диастолическое давление ЛЖ начинает расти (стрелки), что ассоциируется со снижением систолического давления.
Значимый подъем сегмента ST начинается после подъема конечного диастолического давления ЛЖ.
При спонтанном разрешении ишемии (подъем CSO2S) все процессы восстанавливаются. Каждый эпизод длился по 2 мин и ассоциировался с болями в груди.
в) Выраженное соотношение между перфузией и сократимостью при субэндокардиальной ишемии. Когда давление в КА дистальнее стеноза падает ниже предела ауторегуляции, резерв коронарного кровотока исчерпан, что приводит к развитию субэндокардиальной ишемии. В этих случаях снижение субэндокардиального кровотока очень тесно связано со снижением регионарной сократительной функции сердца, о чем можно точно судить, оценивая параметр регионарного утолщения стенки.
Существует почти линейная взаимосвязь между относительным снижением субэндокардиального кровотока и относительным ухудшением регионарного утолщения стенки в покое и при тахикардии, а также во время индуцированной ФН дисфункции дистальнее критического стеноза. Это дает основание использовать регионарную функцию миокарда в качестве показателя выраженности субэндокардиальной ишемии при визуализации в условиях стресса.
г) Кратковременная гибернация. При стабильной ишемии соответствие между перфузией и сократимостью способствует снижению регионарного потребления кислорода и затрат энергии — феномену, который называют кратковременной гибернацией. Это восстанавливает баланс между потребностью в кислороде и его доставкой, что отражается на регенерации креатинфосфата и АТФ с прекращением продукции лактата, несмотря па продолжающуюся гипоперфузию. Кратковременная гибернация — очень нестабильное состояние, и даже небольшое повышение потребности миокарда в кислороде ведет к дальнейшей ишемии и быстрому нарушению функции и метаболизма.
В связи с этим возможности кратковременной гибернации по предотвращению некроза ограничены выраженностью и длительностью ишемии, а необратимое повреждение часто развивается через > 24 час.
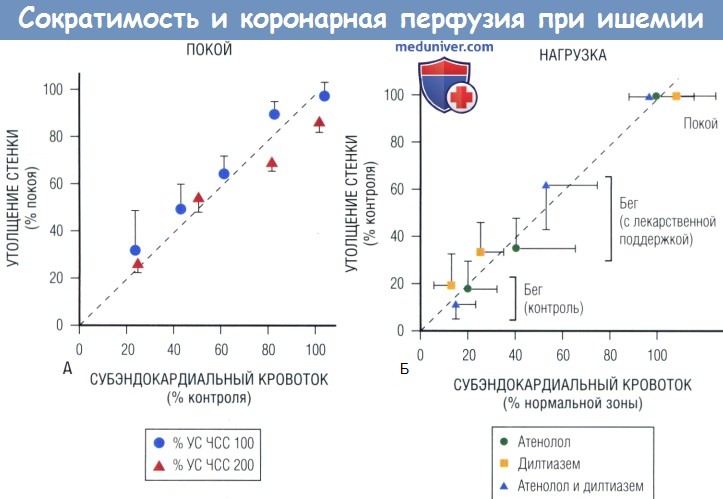
Относительное снижение функции (регионарное утолщение стенки) пропорционально относительному снижению субэндокардиального кровотока, измеренного с помощью микросфер в эксперименте на собаках.
При ауторегуляции это отношение сохраняется в широком диапазоне частоты сердечных сокращений (ЧСС) (А), в т.ч. во время нагрузки при наличии фиксированного коронарного стеноза (Б).
В последнем случае вмешательства могут помочь справиться с ишемией, положительно влияя на субэндокардиальный кровоток и утолщение стенки (УС) при нагрузке.
- Читать "Последствия обратимой ишемии миокарда. Гибернирующий миокард"
Оглавление темы "Физиология ишемии миокарда.":- Состояния влияющие на резерв коронарного кровотока
- Особенности коллатерального коронарного кровообращения
- Необратимое повреждение и гибель кардиомиоцитов при ишемии
- Последствия обратимой ишемии миокарда. Гибернирующий миокард
- Все причины острой боли в грудной клетке списком в таблице
- Первичное обследование пациентов с болью в груди
- Ферменты маркеры инфаркта миокарда в норме и при повреждении миокарда
- Сортировка больных с болью в груди и стратификация их риска
- Схема неотложного лечения при боли в груди
- Исторические и современные критерии диагноза инфаркт миокарда (ИМ)
