Последствия обратимой ишемии миокарда. Гибернирующий миокард
Отдаленные последствия ишемии после восстановления нормальной перфузии миокарда различны, что свидетельствует о наличии острых и отсроченных эффектов на регионарную функцию, а также о защите сердца от повторных эпизодов ишемии. При длительных хронических состояниях это может привести к гибернации миокарда, выражающейся в хронической сократительной дисфункции и наличии регионарных клеточных механизмов, не способных управлять сократительной и метаболической функциями сердца, а также защитить его от необратимого повреждения. Весь комплекс этих взаимодействий представлен на рисунке ниже.
Клинически сложно отделить механизмы, участвующие в появлении в результате ишемии жизнеспособного, но дисфункционирующего миокарда, т.к. все они могут существовать параллельно. Механизмы можно, однако, выделить экспериментально; наиболее важные из них, полученные при фундаментальных исследованиях, представлены далее.
а) Прекондиционирование и посткондиционирование миокарда. Короткая обратимая ишемия, предшествующая продолжительной коронарной окклюзии, уменьшает некроз кардиомиоцитов (КМЦ). Этот процесс называют острым прекондиционированием. Поскольку острому инфаркту миокарда (ИМ) часто предшествует стенокардия, прекондиционирование является эндогенным механизмом, который помогает отсрочить развитие необратимого повреждения миокарда.
Острое прекондиционирование может возникать при фармакологической стимуляции А1-рецепторов аденозином, а также любыми другими агонистами, которые активируют протеинкиназу С или открывают АТФ-чувствительные К+-каналы. Этот эффект был продемонстрирован у людей во время ангиопластики и выразился при последующей коронарной окклюзии уменьшением субъективных и объективных признаков ишемии в качестве конечных точек. Прекондиционирование также может быть длительным (до 4 сут). Оно уменьшает размер ИМ и защищает сердце от индуцируемого ишемией станнирования. Механизмы хронического прекондиционирования — синтез белков, увеличение продукции индуцируемой формы NO-синтазы, циклооксигеназы-2 и открытие митохондриальных АТФ-чувствительных К+-каналов.
Еще один защитный механизм, называемый миокардиальном посткондиционированием, основан на возможности осуществлять защиту сердца, вызывая перемежающуюся ишемию или назначая фармакологические агонисты во время реперфузии. Этот метод еще не вполне изучен, но имеет потенциальные возможности влияния на необратимое повреждение миокарда, поскольку метод можно использовать при уже установленной ишемии миокарда.
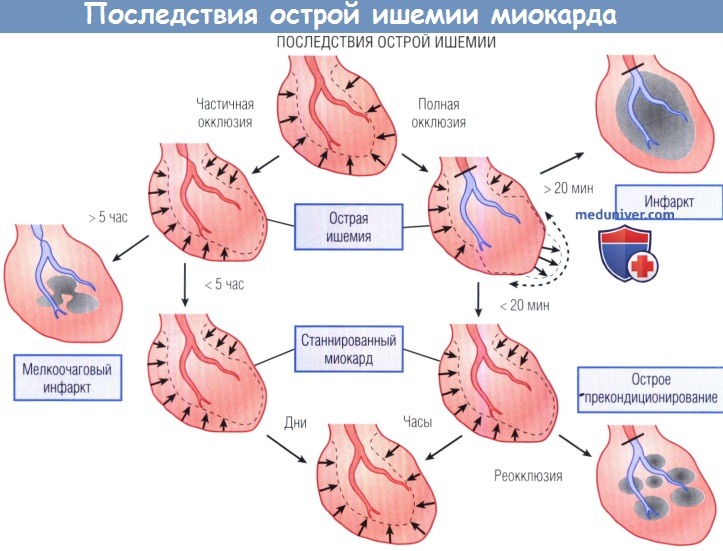
Вентрикулограммы иллюстрируют сократительную дисфункцию (пунктирные линии и стрелки). Последствия острой ишемии.
Кратковременная полная окклюзия (справа) и продолжительная частичная окклюзия, вызванная выраженным острым стенозом (слева), приводят к острой сократительной дисфункции, пропорциональной снижению кровотока.
Необратимое повреждение развивается через 20 мин после полной окклюзии, но возможна задержка в развитии необратимого повреждения до 5 час при условии частичной окклюзии или при наличии значимых коллатералей,
что объясняется кратковременной гибернацией. При проведении реперфузии до начала необратимого повреждения формируется станнированный миокард,
а время, необходимое для восстановления функции, прямо пропорционально длительности и выраженности ишемии.
При продолжительной ишемии станнирование жизнеспособного миокарда происходит одновременно с развитием субэндокардиального инфаркта, что рассматривают как обратимую дисфункцию.
Короткие эпизоды ишемии, предшествующие продолжительной ишемии, способствуют защите от инфаркта (острое прекондиционирование).
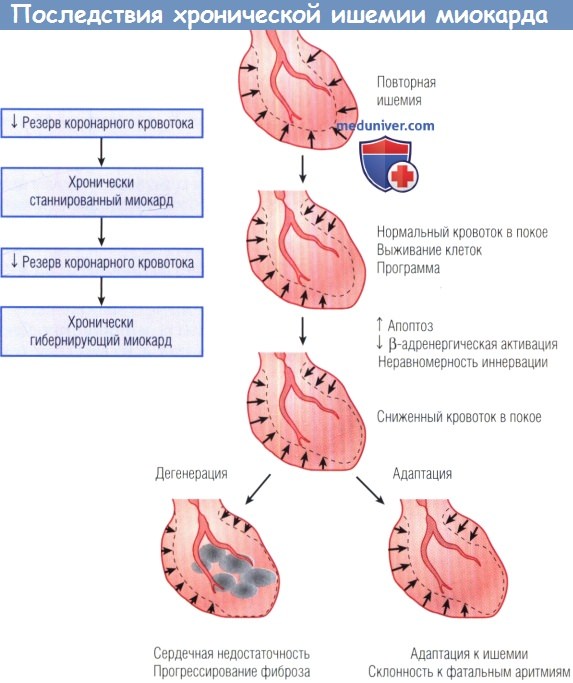
Вентрикулограммы иллюстрируют сократительную дисфункцию (пунктирные линии и стрелки). Влияние повторной хронической ишемии на функцию дистальнее уровня стеноза.
По мере усугубления стеноза резерв коронарного кровотока снижается, а частота эпизодов транзиторной ишемии растет.
Повторная обратимая ишемия сначала ведет к хроническому прекондиционированию и «работает» против инфаркта (не показано).
Идет постепенный процесс от сократительной дисфункции при нормальном кровотоке в покое (хронически станнированный миокард) к нарушению сократимости в совокупности со снижением кровотока в покое (гибернирующий миокард).
Этот переход связан с физиологической значимостью коронарного стеноза и может происходить быстро (в течение 1 нед) или длительно, если нет выраженной стенокардии.
Клеточная реакция в процессе развития гибернирующего миокарда различна: у некоторых пациентов происходит эффективная адаптация с незначительной гибелью клеток и развитием небольшого фиброза,
у других развиваются дегенеративные изменения, которые трудно отличить от субэндокардиального инфаркта.
б) Станнированный миокард. После непродолжительных эпизодов ишемии длительностью < 2 мин миокардиальная функция восстанавливается быстро. При увеличении продолжительности и/или степени выраженности ишемии возникает задержка по времени восстановления функции, несмотря на то что кровоток уже восстановлен. Heyndrickx G.R. и соавт. были первыми, кто продемонстрировал, что регионарная функция миокарда остается угнетенной до 6 час после купирования ишемии, последовавшей за 15-минутной окклюзией, при отсутствии некроза ткани. Heyndrickx G.R. назвал этот феномен «станнирование миокарда». Определяющим признаком изолированного станнирования миокарда является угнетенная функция миокарда при нормальной миокардиальной перфузии в покое.
В этом случае существует разобщение обычно тесной взаимосвязи между субэндокардиальным кровотоком и функцией. Миокард становится станнированным также при развитии ишемии, индуцированной повышенной потребностью в кислороде. Например, в результате ишемии во время физической нагрузки (ФН) может произойти снижение регионарной функции дистальнее коронарного стеноза и сохраняться в течение нескольких часов восстановления перфузии, а повторные ишемии могут привести к кумулятивному станнированию. Длительная сублетальная ишемия, как при кратковременной гибернации, после восстановления перфузии ведет к станнированию, разрешение которого при отсутствии некроза может занять более недели, и способна стать причиной развития обратимой дисфункции миокарда при резком снижении кровотока, ассоциированном с острым коронарным синдромом (ОКС).
Станнированный миокард также является причиной послеоперационного нарушения насосной функции сердца после кардиопульмонального шунтирования. И наконец, зоны станнированного миокарда могут существовать рядом с необратимо поврежденным миокардом и в дальнейшем способствовать восстановлению функции после ИМ.
Клинически важно выявлять станнированный миокард, поскольку сократительная функция нормализуется под воздействием разных инотропных агентов, в числе которых β-адренергические агонисты. В отличие от других состояний, связанных с нарушением функций (при условии, что нет рецидивов ишемии), сократительная функция самостоятельно восстанавливается через 1 нед. Если повторные эпизоды обратимой ишемии развиваются до нормализации функции, это может привести к состоянию персистирующей дисфункции или хроническому станнированию. Клеточные механизмы станнирования, вероятно, заключаются в повреждении миокарда свободными радикалами и пониженной чувствительности миофиламентов к кальцию.
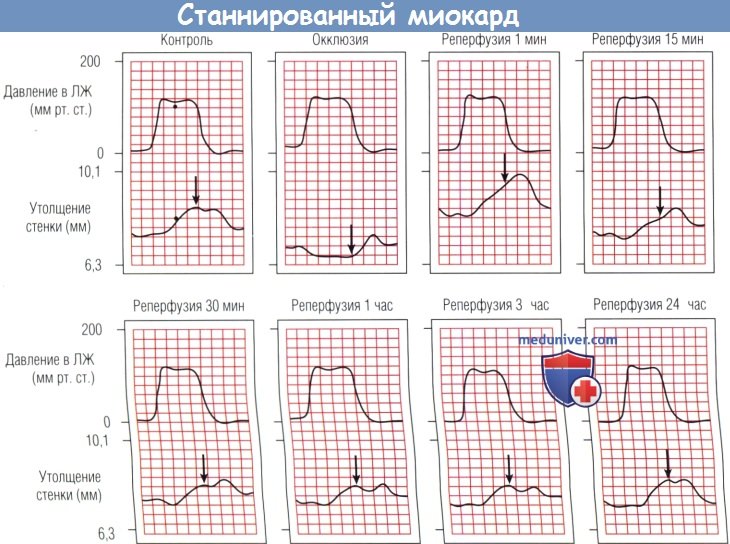
Утолщение стенки, измеренное ультразвуком, дискинетинно, к тому же наблюдается систолинеское утоньшение в момент окклюзии.
Вслед за реперфузией—практически полное восстановление функции через 24 час.
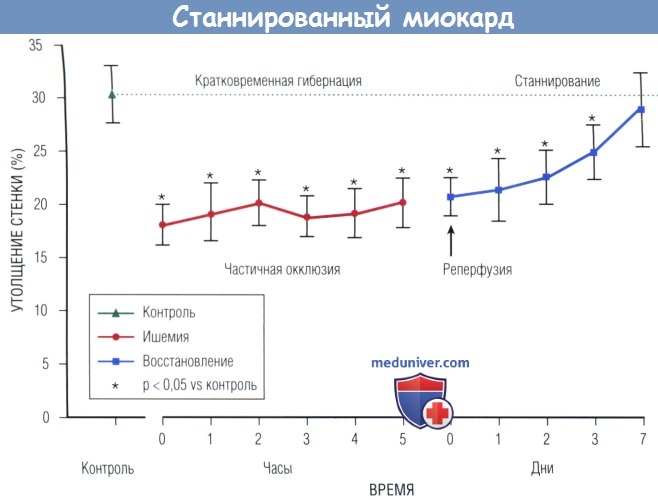
Во время острой ишемии происходит кратковременная гибернация, отражающая одновременное ослабление кровотока, снижение утолщения стенок и замедление метаболизма.
После реперфузии утолщение стенок остается малым и постепенно возвращается к норме через 1 нед. ЛЖ — левый желудочек.
в) Хронически гибернирующий миокард. Жизнеспособный миокард, но с нарушенной функцией можно в целом определить как область, которая улучшит сократительную функцию после коронарной реваскуляризации. Это широкое определение обратимой диссинергии включает три отдельные категории с довольно различными патофизиологическими механизмами. Как правило, после острой ишемии происходит полная нормализация функции, исключение — наличие миокарда с хронической дисфункцией. Кратковременные окклюзии или длительная умеренная ишемия (кратковременная гибернация) в отсутствие ИМ заканчиваются постишемическим станнированием с быстрым и полным восстановлением функции в течение нескольких часов или 1 нед после реперфузии. Скорость восстановления зависит от продолжительности и выраженности эпизода ишемии.
Обратимая диссинергия с отсроченным функциональным улучшением также возможна при структурном ремоделировании сердца, не связанном с ишемией или коронарным стенозом (например, отдаленном ремоделировании миокарда при СН или снижении размера ИМ в течение первых недель после коронарной реперфузии).
Эти состояния можно выявить на основании клинических данных, коронарной анатомии и оценки миокардиальной перфузии. Во многих клинических исследованиях оценивали наличие резерва сократимости в качестве предиктора функционального восстановления путем введения добутамина. Несмотря на то что данный способ определяет возможность функционального восстановления, он не помогает в различении отдельных патофизиологических состояний, лежащих в основе обратимой диссинергии. Понимание причин очень важно, т.к. это влияет на длительность и степень функционального восстановления после реваскуляризации у пациентов с ишемической сердечной недостаточностью (СН).
Хроническая сегментарная дисфункция в результате повторных эпизодов ишемии (часто клинически бессимптомных) является распространенным нарушением и присутствует по крайней мере в одном коронарном бассейне у > 60% пациентов с ишемической кардиомиопатией (КМП). Если в зоне миокарда с нарушенной функцией кровоток в покое дистальнее стеноза на отдаленном участке нормальный, эта область хронически станнирована. И наоборот, если при отсутствии симптомов или признаков ишемии кровоток в покое снижен, присутствует гибернирующий миокард. Ранее было много споров по вопросу, какой кровоток в покое — пониженный или нормальный, но выяснилось, что у пациентов присутствуют оба варианта, что свидетельствует о крайне широком спектре адаптивных и дизадаптивных ответов организма на хроническую обратимую ишемию.
Исследования жизнеспособности миокарда необходимы, чтобы отличить ИМ от гибернирующего миокарда, поскольку при нормальном кровотоке в покое миокард всегда жизнеспособен.
Изначально предполагалось, что миокард становится гибернирующим вследствие снижения кровотока, как это наблюдали в экспериментальных моделях пролонгированной умеренной ишемии и кратковременной гибернации (это механизм развития гибернирующего миокарда в связи с ОКС). Но впоследствии эксперименты показали, что при сохраняющемся в течение > 24 час умеренном снижении кровотока отсроченный субэндокардиальный ИМ является скорее правилом, чем исключением. Множество пациентов с гиберниру-ющим миокардом имеют дисфункцию ЛЖ, а не симптомы ишемии. В настоящее время несколько исследований на животных продемонстрировали, что снижение относительного кровотока в покое является следствием, а не причиной сократительной дисфункции.
Эта парадигма, связанная с хронической коронарной патологией, была предложена после исследований на свиньях с медленно прогрессирующим стенозом левой передней нисходящей артерии, в ходе которых выяснилось, что дисфункция при нормальном кровотоке, связанная с хроническим станнированием, является предпосылкой развития гибернирующего миокарда через 3 мес. Переход от хронически станнирован-ного (с нормальным кровотоком в покое) к гибернирую-щему миокарду (со сниженным кровотоком) связан с функциональной значимостью хронического стеноза КА, питающей эту зону, и, вероятно, с его склонностью вызывать повторные эпизоды ишемии, индуцированные изменениями в доставке кислорода или потребности в нем.
Этот переход может произойти уже через 1 нед после развития критического стеноза, который приводит к истощению резерва коронарного кровотока. По мере прогрессирования регионарной дисфункции от хронически станнированного миокарда к гибернирующему миокарду регионарные КМЦ становятся похожи на клетки эксплантированного сердца с выраженной недостаточностью. КМЦ нормально перфузируемой отдаленной зоны могут быть не изменены или иметь такие же структурные повреждения, как и в зоне дисфункции.
Некоторые из основных клеточных реакций приведены далее.

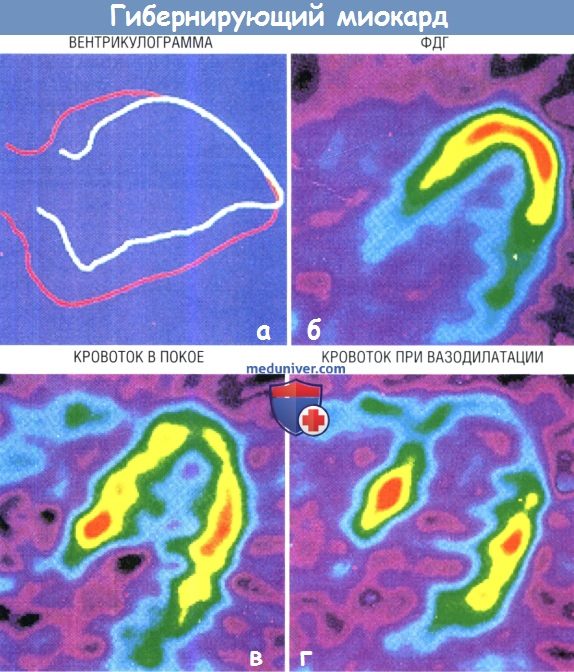
Вентрикулограмма в переднеправой косой проекции демонстрирует переднюю акинезию (А).
Трансаксиальные срезы ПЭТ иллюстрируют измерение кровотока в покое с помощью 13NH3 (В) и после фармакологической вазодилатации дипиридамолом (Г).
Количественная оценка перфузии показывает критические нарушения кровоснабжения бассейна ЛПНА.
Жизнеспособность (после пероральной нагрузки глюкозой) определяется в виде повышенного захвата флюородеоксиглюкозы (ФДГ) в проекции передней стенки (Б).
г) Апоптоз, гибель миоцитов и разрушение миофибрилл. Частота локальной гибели КМЦ в результате апоптоза в процессе формирования дисфункции у жизнеспособного миокарда различна, вероятно, от этого зависит вариабельность частоты апоптоза в результатах биопсий, взятых у пациентов, В эксперименте апоптоз особенно выражен при переходе от хронически станнированного миокарда к гибернирующему; в это время теряется 30% регионарных КМЦ. Гибель КМЦ ведет к компенсаторной регионарной гипертрофии для сохранения нормальной толщины стенки. Ранее Vanoverschelde J.L. и соавт. описали по результатам трансмуральных биопсий незначительные и ультраструктурные признаки гибернирующего миокарда: небольшое увеличение интерстициальной соединительной ткани, утрата миофибрилл (миолиз), повышенное отложение гликогена и появление минимитохондрий.
В экспериментальных моделях гибернирующего миокарда на животных уже через 2 нед развивались аналогичные структурные изменения, но они также были в отдаленных нормально перфузируемых зонах сердца. Глобальные клеточные изменения отмечались также у пациентов с отсутствием стеноза, что предполагает развитие изменений в результате постоянно повышенной преднагрузки. Считается, что механизмом адаптации является клеточная дифференцировка, а ультраструктурные изменения, вероятно, не служат причиной регионарных реакций на ишемию в гибернирующем миокарде.
д) Вывживаемость клеток и антиответ на повторные ишемии. Существуют различные пути выживаемости клеток в качестве реакций на повторные эпизоды ишемии. В некоторых исследованиях в ответ на рецидивирующую транзиторную ишемию была продемонстрирована повышенная реактивность кардиопротективных механизмов, которые могут быть эффективны в плане снижения гибели КМЦ и развития фиброза при хронизации ишемии. Интересным механизмом, потенциально связывающим нарушения метаболизма и защиту от этих нарушений, является регионарная обратная регуляция активности гликогенсинтазы киназы-3β, которая способна снизить гибель клеток. Это также объясняет повышение тканевого гликогена в гибернирующем миокарде. В некоторых исследованиях было выявлено повышение уровня антиапоптотических и стрессорных белков типа HSP-70 после повторных эпизодов ишемии, а в других исследованиях биоптаты пациентов с гиберпирующим миокардом имели повышенное содержание проапоптотических протеинов и прогрессирующий профиль гибели клеток и фиброза.
Вполне вероятно, что различия в результатах исследований отражают частоту и степень выраженности ишемии, взаимосвязь адаптивных и дизадаптивных реакций в миокарде, подвергающемся хронической или периодически повторяющейся ишемии.
е) Метаболим и энергетика гибернирующего миокарда. После адаптации метаболическая и сократительная реакции гибернирующего миокарда становятся диссоциирующими от внешних факторов, определяющих нагрузку. В результате этого может произойти повышение потребления кислорода до субмаксимального, которое не приведет к немедленной субэндокардиальной ишемии. В эксперименте зоны гибернирующего миокарда функционировали при уровнях отношения потребность-доставка ниже, чем в норме, как при неишемической СН. Несмотря на повышенное содержание гликогена, максимальная скорость захвата глюкозы при стимуляции инсулином не изменялась. Уровни креатипфосфата и АТФ в этих зонах оставались прежними в отличие от угнетения АТФ при станнирова-нии. В последних исследованиях на изолированных митохондриях свиного сердца с гибернируюгцим миокардом было показано пониженное потребление энергии и кислорода.
ж) Неоднородность симпатической иннервации, бета-адренергическая реакция и внезапная смерть. Контрактильный ответ гибернирующего миокарда невнятный и частично связан с регионарным снижением β-адренергического связывания аденилилциклазы, что происходит повсеместно при выраженной сердечной недостаточности (СН). Это может быть связано с избытком норадреналина (НА) вследствие снижения его пресинаптического захвата, выявляемого с помощью РФП, например 11С-гидроксиэфедрина. Возникающая в результате неравномерность симпатической иннервации может стать одной из причин склонности экспериментального гибернирующего миокарда к развитию летальных желудочковых аритмий и фибрилляции желудочков. В связи с этим нормализацию электрической нестабильности и улучшение сократительной функции можно считать абсолютным эффектом реваскуляризации на выживаемость при наличии гибернирующего миокарда.
з) Успешная адаптация в отличие от дегенерации в гибернирующем миокарде. Существуют значительные разночтения в результатах патофизиологических исследований диссинергичного, обратимо гибернирующего миокарда. С одной стороны, некоторые исследователи полагают, что он приводит к необратимой гибели кардиомиоцитов (КМЦ), подтверждением чему служат данные о большом объеме фиброза (> 30%), значительном нарушении метаболизма высокоэнергетических фосфатов; кроме того, ретроспективный анализ показал связь степени фиброза с длительностью гибернации миокарда. С другой стороны, существуют условия, при которых фиброз не столь выражен и энергетика миокарда в покое близка к норме, что предполагает существование гибернирующего миокарда в течение длительного периода времени без прогрессирования дегенерации. Факторы, которые определяют развитие в направлении прогрессирования дегенерации в отличие от адаптации, пока неизвестны, но могут быть обусловлены сопутствующей нейрогормональной активацией, повышением уровней цитокинов, ассоциированных с развитием клинической СН, и структурной дегенерацией вследствие даже небольшого снижения резерва коронарного кровотока ниже порога, необходимого для поддержания жизнеспособности кардиомиоцитов (КМЦ).
Несмотря на прогресс в механистическом понимании коронарной циркуляции и миокардиальной ишемии в норме и при патологии, остаются значительные пробелы в познании и в переносе этих знаний в клинику. Во-первых, хотя достигнут успех в описании физиологии коронарной МЦ, механизмы метаболического контроля и коронарной ауторегуляции до сих пор изучены недостаточно. Необходимо более интенсивно использовать данные о дисрегуляции коронарной МЦ при ведении пациентов с ИБС, т.к. в некоторых случаях эти данные могут быть очень важны (например, степень стеноза эпикардиальной КА для определения прогноза). Во-вторых, несмотря на проведение масштабных фундаментальных и клинических исследований, нацеленных на борьбу с ишемией, не было получено положительных клинических результатов.
Внедрение количественных подходов к оценке миокардиальной перфузии при фармакологической вазодилатации поможет лучше определять наиболее эффективные мероприятия по улучшению кровотока. Новые возможности визуализации, которые позволяют оценить перфузию в субэндокарде, а также точное определение уровня кровотока или его резерва в бассейне определенного сосуда расширят возможности раннего выявления функционально значимого заболевания. И наконец, необходимо лучше понимать роль острых эпизодов ишемии (т.е. прекондиционирования и гибернации миокарда) в развитии адаптации к ней, а также влияние дизадаптивной реакции гибернирующего миокарда на фатальные желудочковые аритмии. Эти состояния могут предшествовать развитию выраженной дисфункции ЛЖ и идентифицируются как неоднородность симпатической иннервации миокарда при транзиторной ишемии или как начало гибели КМЦ при апоптозе. Это может помочь разработать подход к определению регионарной неоднородности, приводящей к аритмии. Но, несмотря на значительный прогресс в этой области, многое остается неизученным.
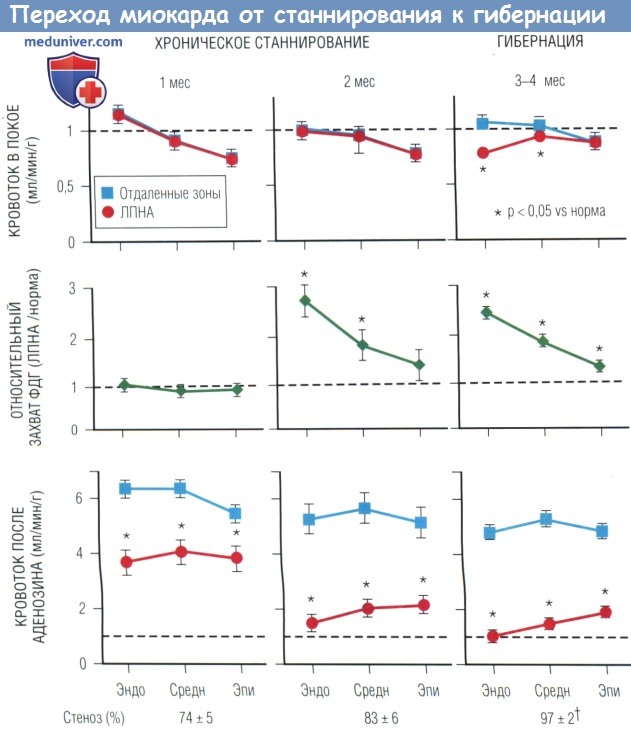
с жизнеспособным дисфункционирующим миокардом вследствие хронического стеноза левой передней нисходящей артерии (ЛПНА).
Представлены измерения трансмурального кровотока (с помощью микросфер) в покое и при вазодилатации аденозином, а также регионарный захват ФДГ (натощак).
Ниже — ангиографическая выраженность стеноза и оценка движения передней стенки в баллах (3 — норма; 2 — умеренная гипокинезия; 1 — выраженная гипокинезия).
С увеличением степени стеноза во времени происходит снижение кровотока в бассейне ЛПНА при вазодилатации аденозином.
Сначала наблюдалась гипокинезия передней стенки при нормальном кровотоке в покое, что присуще хронически станнированному миокарду.
Через 3 мес стеноз привел к окклюзии, а кровоснабжение участка миокарда стало осуществляться за счет коллатералей.
Субэндокардиальный кровоток значительно снижен, также отмечается снижение кровотока в покое во внутренних двух третях миокардиальной стенки бассейна ЛПНА.
К этому моменту присутствует гибернирующий миокард без признаков инфаркта. Развитие нарушений во времени демонстрирует, что хроническое станнирование предшествует гибернирующему миокарду.
В отличие от кратковременной гибернации в результате острой ишемии снижение кровотока в покое является следствием, а не причиной сократительной дисфункции.
Средн — средний слой миокарда; ФДГ — флюородеоксиглюкоза; Эндо — эндокард; Эпи — эпикард.
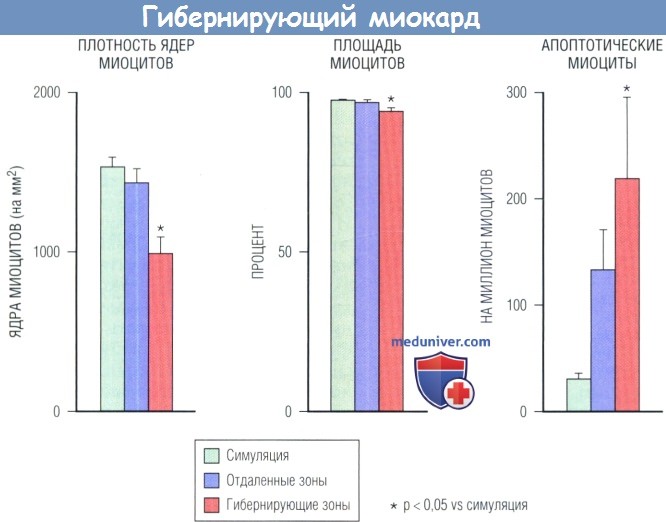
Данные по гибернирующей зоне в бассейне левой передней нисходящей артерии (ЛПНА) сравнивают с отдаленными областями, а также зонами ЛПНА у здоровых животных.
(А) Переход от хронически станнированного к гибернирующему миокарду сопровождается регионарной гибелью клеток.
Присутствует уменьшение количества ядер миоцитов на 30% без значительного фиброза, т.к. пространство, занятое миоцитами, близко к норме.
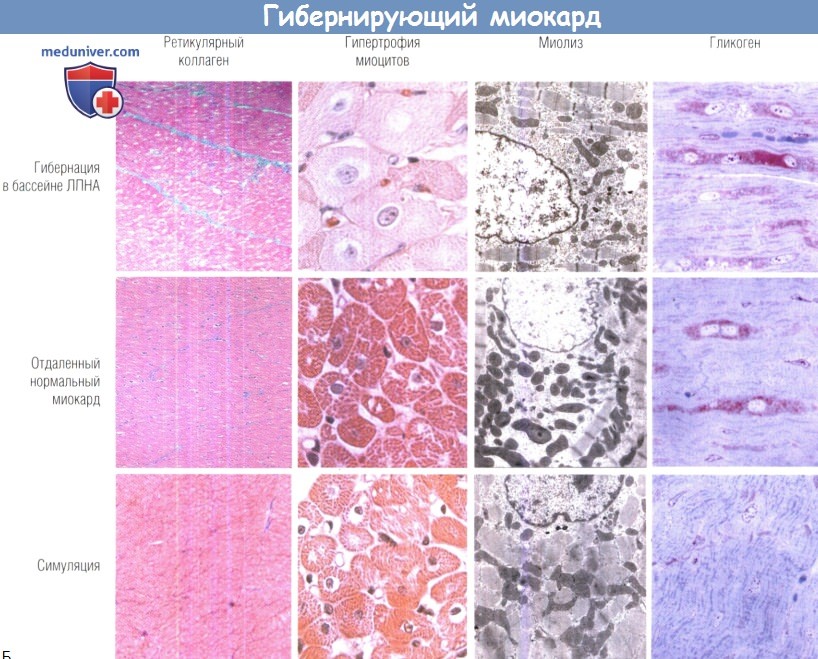
Рост гибели миоцитов приводит к компенсаторной клеточной гипертрофии в гибернирующем миокарде.
Несмотря на то что содержание ретикулярного коллагена на участке повышено (2%), признаков инфаркта не выявлено.
Электронномикроскопические признаки гибернирующего миокарда: утрата миофибрилл, увеличение числа мелких митохондрий и повышенное содержание гликогена.
Хотя все это значительно отличает гибернирующий миокард от здорового (симуляция), биоптаты, взятые из отдаленных зон без ишемии,
демонстрируют аналогичные структурные аномалии, т.е. эти изменения не связаны напрямую с ишемией и не являются причиной регионарной сократительной дисфункции.
- Читать "Все причины острой боли в грудной клетке списком в таблице"
Оглавление темы "Физиология ишемии миокарда.":- Состояния влияющие на резерв коронарного кровотока
- Особенности коллатерального коронарного кровообращения
- Необратимое повреждение и гибель кардиомиоцитов при ишемии
- Последствия обратимой ишемии миокарда. Гибернирующий миокард
- Все причины острой боли в грудной клетке списком в таблице
- Первичное обследование пациентов с болью в груди
- Ферменты маркеры инфаркта миокарда в норме и при повреждении миокарда
- Сортировка больных с болью в груди и стратификация их риска
- Схема неотложного лечения при боли в груди
- Исторические и современные критерии диагноза инфаркт миокарда (ИМ)
