Виды коронарных стентов и их возможности
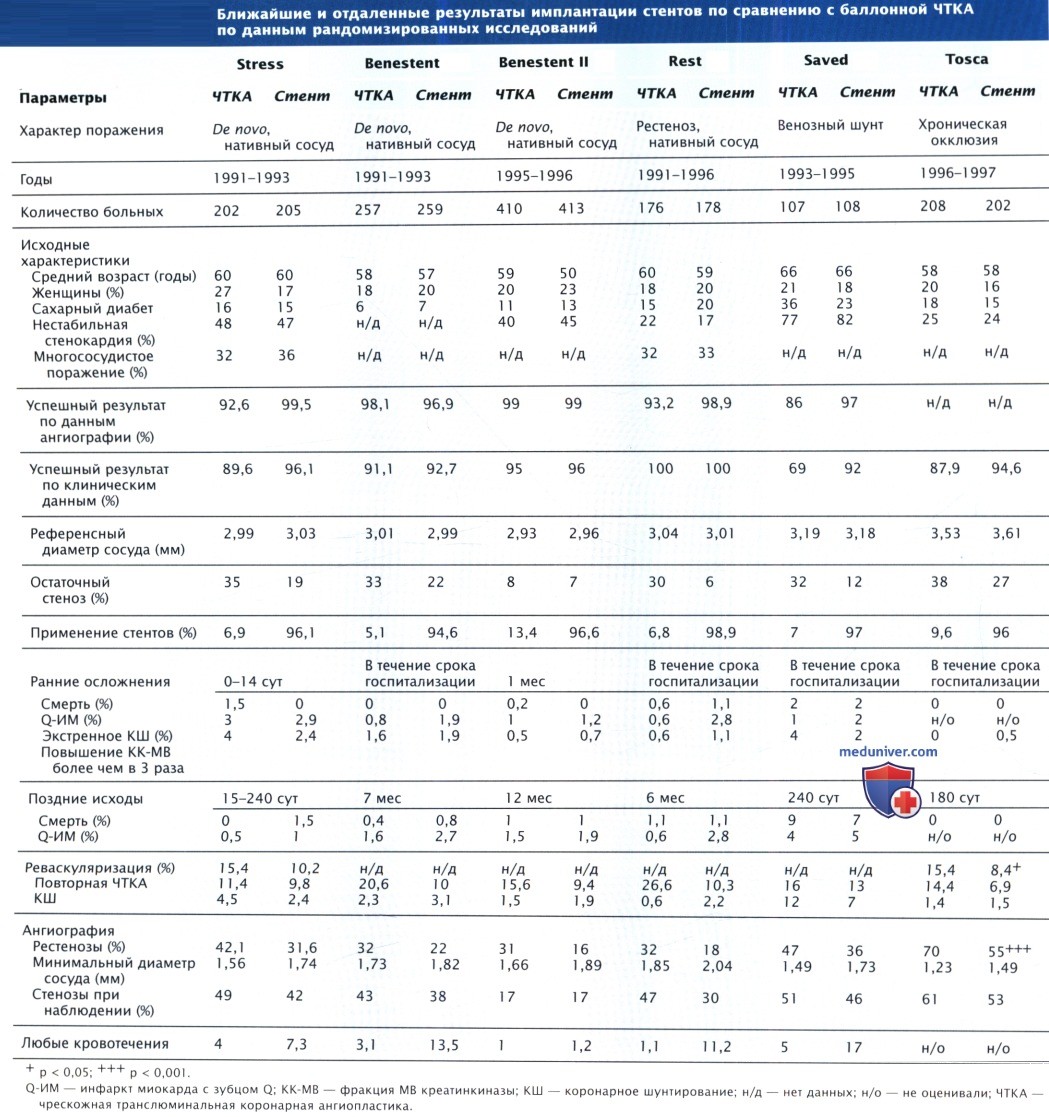
В настоящее время имплантация коронарных стентов является основным видом чрескожного коронарного вмешательства (ЧКВ), который применяют в > 90% случаев всех ЧКВ в мире. Коронарный стент создает внутри артерии каркас, что способствует уменьшению риска закрытия сосуда и потребности в экстренных операциях КШ, а также снижает частоту рестенозов, поскольку предупреждает спазм сосуда, являющийся первичным механизмом рестеноза после БАП и атерэктомии.
Несмотря на то что отдаленные результаты по сравнению с баллонной ангиопластикой (БАП) лучше, развитие рестеноза возможно и после имплантации стента из-за гиперплазии интимы внутри стента. В период 1997-2003 гг. было разработано большое количество стентов второго поколения, которые различались, в частности, составом металла (например, кобальт-хромовый стент или покрытый металлом, стент из нержавеющей стали 316L), дизайном, длиной, характеристиками доставляющих и расправляющих систем. Модификации способствовали улучшению системы доставки и повышению гибкости стентов, а также облегчали доступ в боковые ветви КА и делали каркас более совершенным.
На раннем этапе применение коронарных стентов осложнялось высоким риском развития подострых тромбозов (3-5%), несмотря на «агрессивную» антитромботическую терапию аспирином (> 325 мг/сут) и дипиридамолом (225 мг/сут), введение во время процедуры низкомолекулярного декстрана и назначение гепарина в/в, который затем немедленно заменяли варфарином. Подострые тромбозы приводили к серьезным клиническим последствиям с неблагоприятными исходами (смерть, ИМ или экстренная реваскуляризация) практически у всех пациентов.
Добиться снижения частоты подострых тромбозов стентов (до 0,5%) удалось после внедрения систем расправления стентов высоким давлением, а также с помощью лекарственной терапии, включающей аспирин и тиенопиридины (например, клопидогрел), которые назначают сразу после имплантации стента.
Хотя металлические стенты без покрытия способствуют уменьшению частоты ангиографических и клинических рестенозов по сравнению с БАП, все же ангиографически диагностируеме рестенозы (> 50%) возникают у 20-30% больных, а клинические рестенозы (рецидив стенокардии из-за рестеноза соответствующего сегмента КА) отмечаются у 10-15% пациентов в первый год после вмешательства.
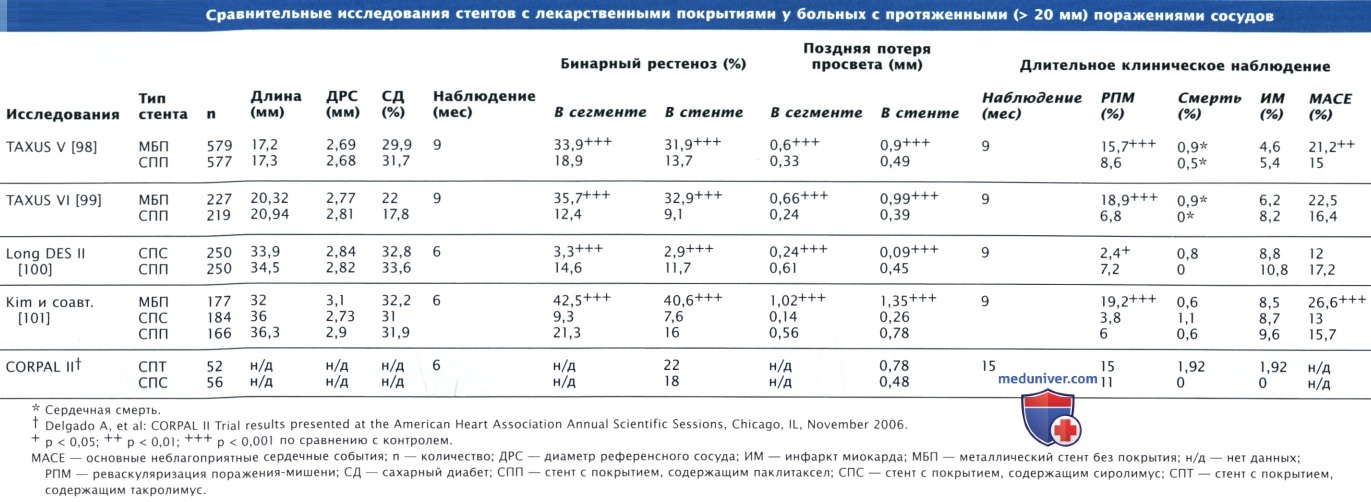
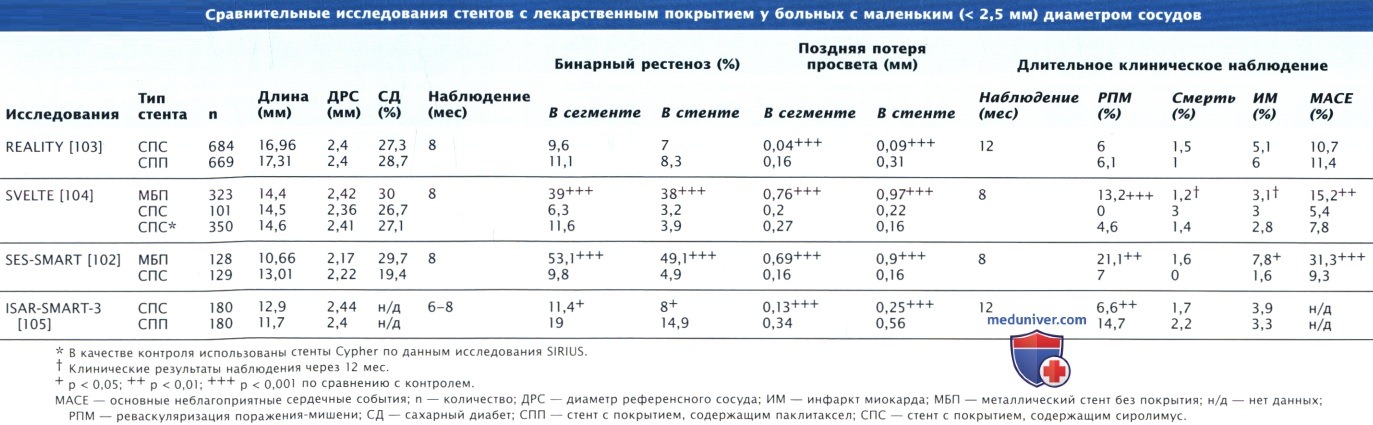
Рестенозы в области металлических стентов без покрытия возникают чаще при небольшом диаметре сосуда, протяженном участке поражения, а также у больных сахарным диабетом (СД).
Назначение дополнительной лекарственной терапии не предотвращает рестенозы после имплантации стентов, хотя цилостазол и рапамицин немного снижали риск возникновения рестенозов в области металлических стентов без покрытия.
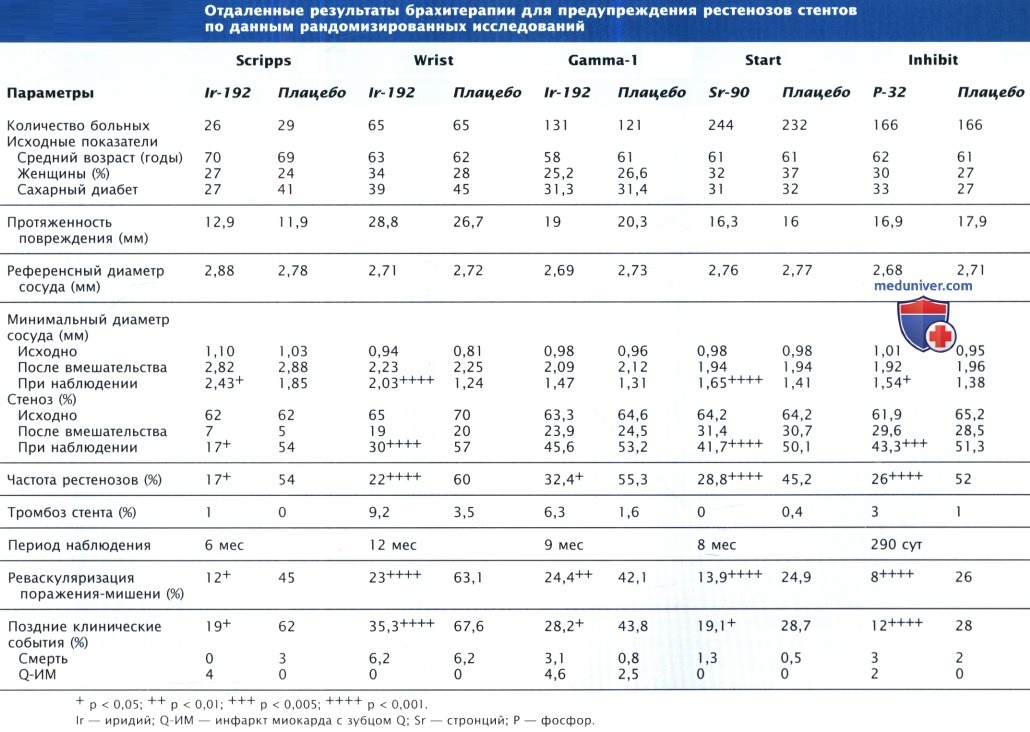
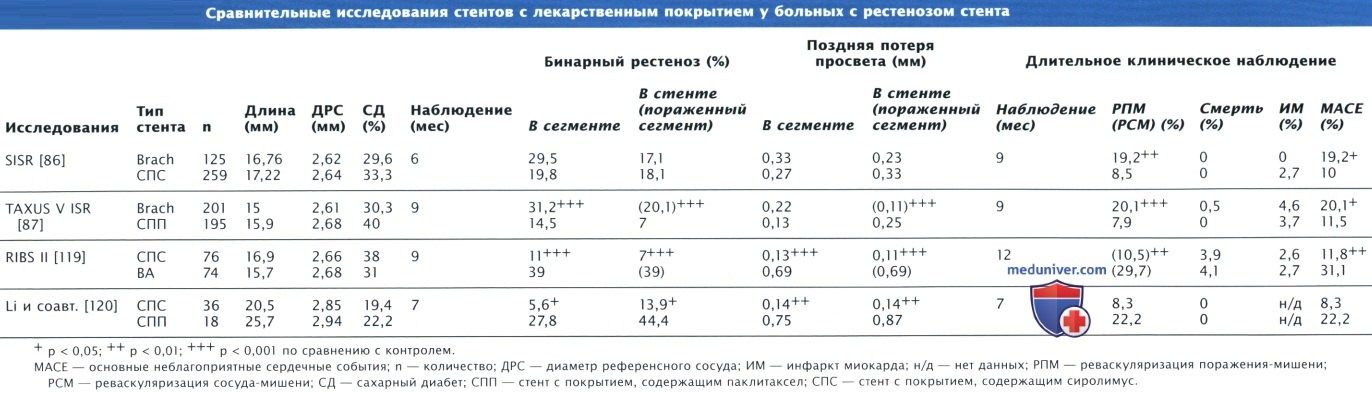
Проводили попытки механических вмешательств по поводу рестенозов в области стентов, в т.ч. повторную баллонную дилатацию, удаление гиперплазированных тканей с помощью атерэктомии и повторную имплантацию металлических стентов без покрытия. Близкофокусная лучевая терапия (брахитерания) с использованием β- или γ-лучей несколько улучшала прогноз в отношении рестенозов, однако она имеет ряд ограничений (например, необходим специалист по лучевой терапии), создает тенденцию к развитию поздних рестенозов и ингибирует эндотелизацию, что существенно повышает риск тромбозов при наличии другого стента в том же участке сосуда.
В двух рандомизированных исследованиях имплантация стентов с лекарственным покрытием имела преимущество перед брахитеранией.

Стенты с лекарственным покрытием
Стенты с лекарственным покрытием были разработаны в начале 2000-х гг. с целью обеспечения непрерывного локального поступления лекарственного препарата с антипролиферативным эффектом в область повреждения сосудистой стенки. Современный стент с лекарственным покрытием состоит из собственно стента, расправляемого с помощью баллона; прочного или рассасывающегося полимерного покрытия, которое обеспечивает непрерывное поступление препарата, и лекарственного препарата, уменьшающего степень гиперплазии интимы.
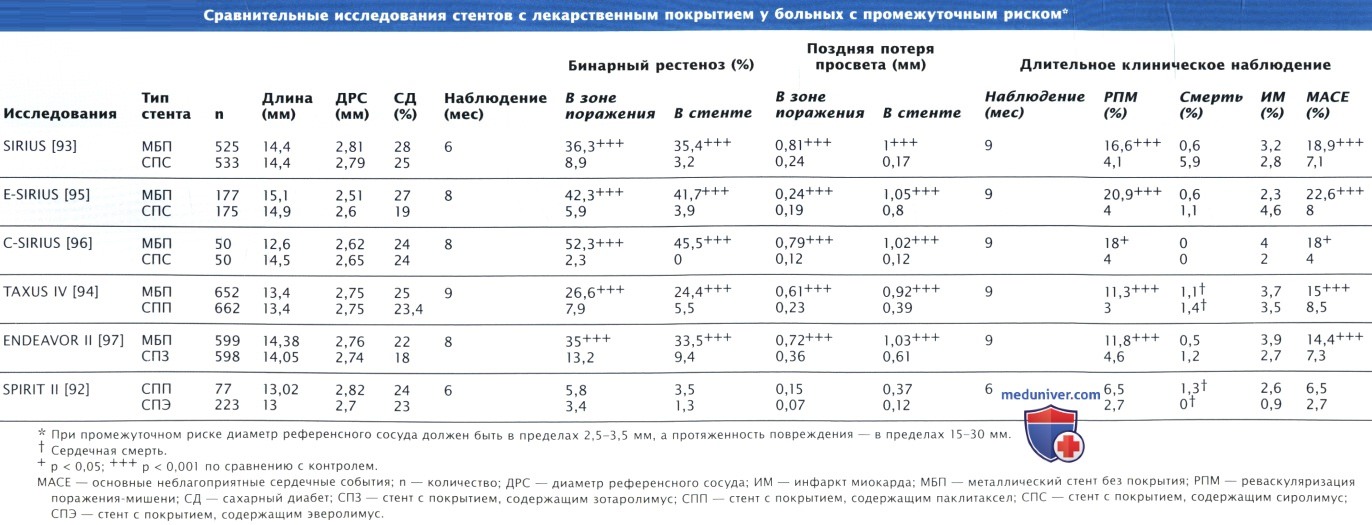
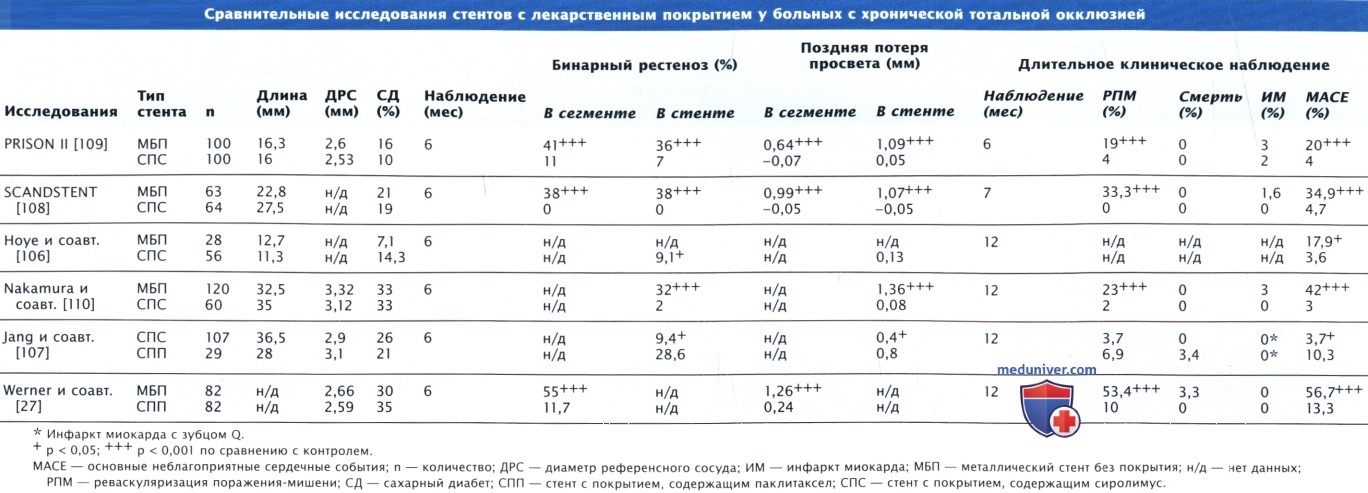
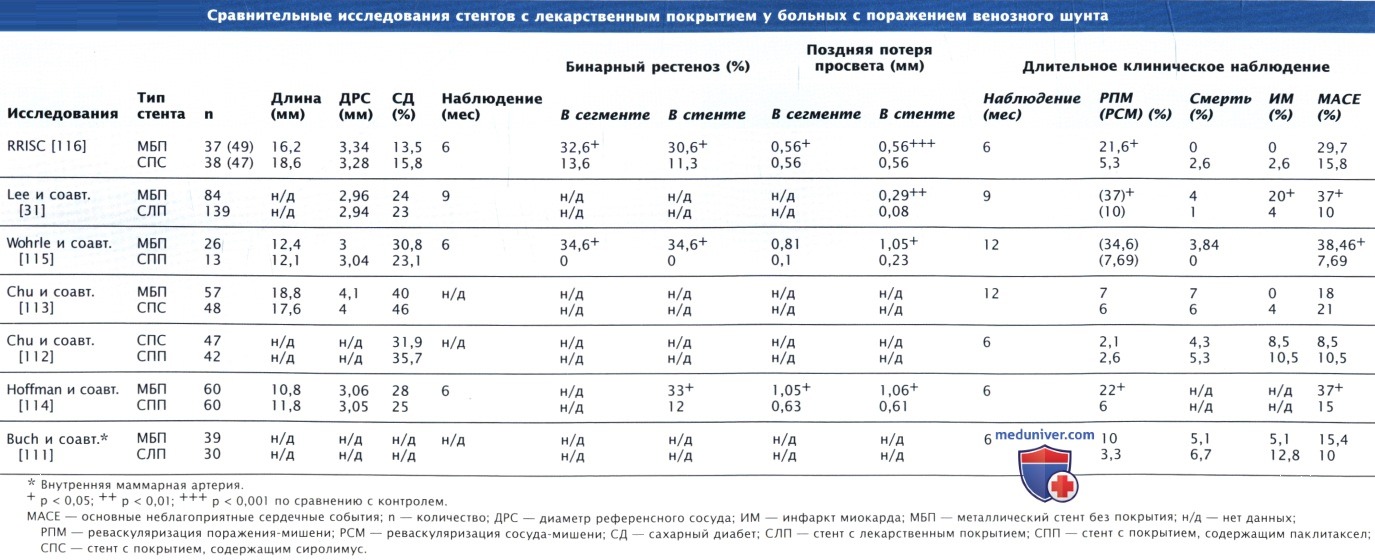
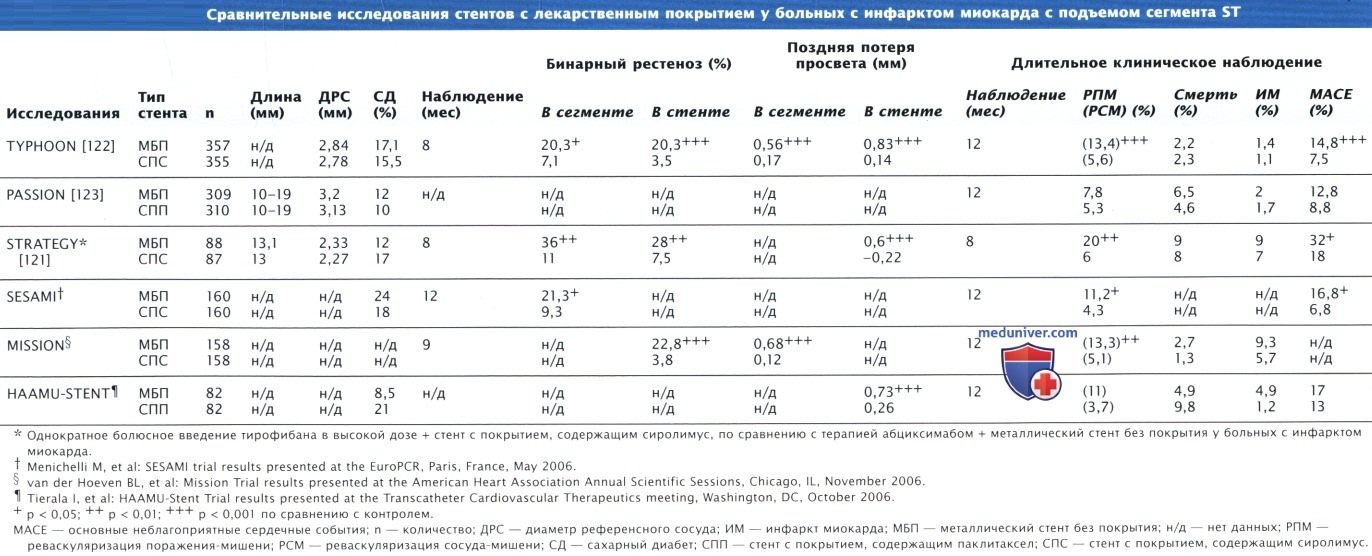
Стенты с лекарственным покрытием доказали свою эффективность у больных с локальными, недавно возникшими поражениями, при которых диаметр сосуда составляет от 2,5 до 3,5 мм, а длина сужения — 15—30 мм. В ряде рандомизированных исследований и регистров также была продемонстрирована эффективность стентов с лекарственным покрытием при наличии протяженных поражений (> 20 мм) в мелких (< 2,5 мм) сосудах, при хронической тотальной окклюзии, в случаях наличия венозных шунтов и шунтов из внутренней маммарной артерии, при рестенозах стентов, а также у пациентов с ИМ↑ST.
При осуществлении длительного наблюдения пациентов после имплантации стентов с лекарственным покрытием оказалось, что такие больные нуждаются в продолжительной (до 1 года) терапии комбинацией аспирина с клопидогрелом для предупреждения тромбоза стента. Более того, даже по прошествии 1 года сохраняется небольшой (0,2-0,6%) ежегодный риск очень поздних тромбозов стентов, поэтому нужно тщательное обсуждение рисков, пользы и вариантов альтернативного лечения у пациентов, направленных на ЧКВ.
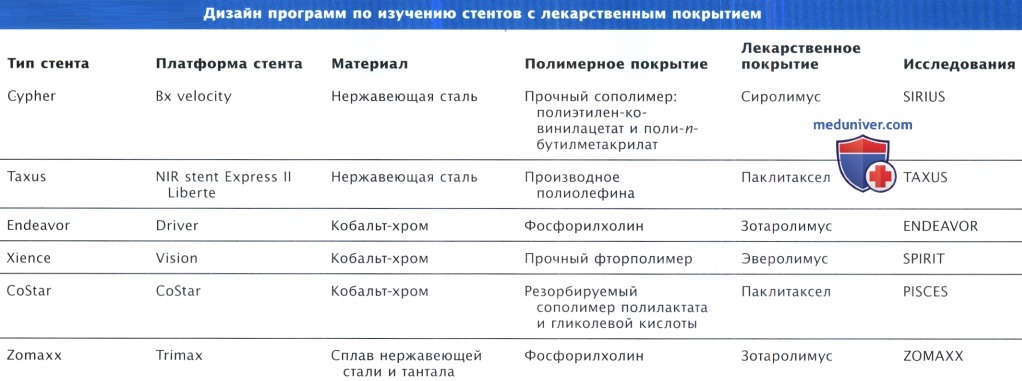
1. Стенты с покрытием содержащим сиролимус. Стенты Cypher (Cordis, Warren, NJ) содержат сиро-лимус — естественный иммуносупрессант, который оказывает цитостатическое ингибирующее воздействие на пролиферацию клеток. Сиролимус поступает из биостойкого полимера, который высвобождает сиролимус в течение 30 сут. Стенты Cypher получили Европейский знак соответствия в апреле 2002 г., а в мае 2003 г. они были одобрены FDA.
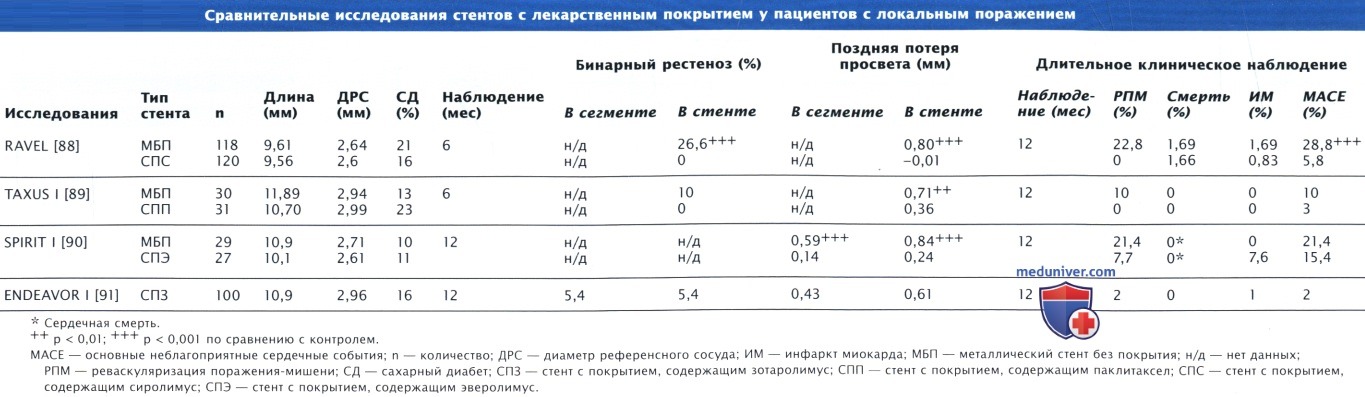
В ключевом исследовании SIRIUS приняли участие 1058 пациентов с типичными повреждениями, которых рандомизировали для имплантации стентов с лекарственным покрытием или металлических стентов без покрытия. Частота достижения первичной конечной точки (поражение сосуда-мишени в течение 8 мес), а также комбинированной конечной точки в виде реваскуляризации в зоне сосуда-мишени, ИМ или смерти снизилась с 21% при имплантации металлических стентов без покрытия до 8,6% при имплантации стентов, покрытых сиролимусом (р < 0,001).
Частота рестенозов по результатам ангиографии также была ниже у больных со стентами, содержащими сиролимус, как в области самих стентов (35,4% при имплантации металлических стентов без покрытия и 3,2% при использовании стентов с лекарственным покрытием, р < 0,001), так и в радиусе 5 мм проксимально и дистально от краев стента (36,3% при имплантации металлических стентов без покрытия и 8,9% при использовании стентов с лекарственным покрытием, р < 0,001).
Частота реваскуляризаций в зоне сосуда-мишени снизилась с 16,6% при имплантации металлических стентов без покрытия до 4,1% у пациентов со стентами, покрытыми сиролимусом (р < 0,001). Уменьшение выраженности гиперплазии интимы сосуда сохранялось по крайней мере в течение 2 лет после вмешательства.
2. Стенты с покрытием, содержащим палитаксел. Стенты Taxus (Boston Scientific, Natick, MA) состоят из каркаса из нержавеющей стали, производных полиолефинов и стабилизирующего препарата пакли-таксела, который обладает прот ивовоспалительным действием, а также ингибирует миграцию и деление клеток. Высвобождение паклитаксела прекращается по истечении 30 сут, хотя значительная его часть (> 90%) остается внутри полимера неопределенно долго. В исследовании TAXUS IV были рандомизированы 1314 пациентов с вновь выявленными одиночными поражениями КА, которым были имплантированы либо стенты Taxus, либо металлические стенты без покрытия аналогичного дизайна.
Частота реваскуляризаций сосуда-мишени в течение 9 мес снизилась с 11,3 до 3%, а у больных, которым были имплантированы стенты с покрытием, содержащим паклитаксел (р < 0,001), снизилась к концу 12 мес с 17,1 до 7,1%. Частота рестенозов по данным ангиографии снизилась как внутри самих стентов (24,4% при имплантации металлических стентов без покрытия и 5,5% при имплантации стентов с покрытием, содержащим паклитаксел, р < 0,001), так и в сегменте, подвергнутом пластике, на 5 мм проксимально и дистально от краев стента (26,6 и 7,9% соответственно, р < 0,001).
3. Стенты с покрытием, содержащим зотаролимус. Зотаролимус (ранее известный как АВТ-578) является еще одним аналогом рапамицина, который высвобождается из стентов, покрытых фосфорилхолином. Препарат исследован при использовании стентов Endeavor (Medtronic Vascular, Santa Rosa, CA) и Zomaxx (Abbott Vascular, Redwood City, CA). В исследовании ENDEAVOR II (Randomized Trial to Evaluate the Safety and Efficacy of the Medtronic AVE ABT-578 Eluting Driver Coronary Stent in De Novo Native Coronary Artery Lesion) 1197 пациентов были рандомизированы для имплантации стентов Endeavor с покрытием, содержащим зотаролимус, либо таких же металлических стентов без покрытия или не содержащих препарата в полимерном покрытии.
Частота возникновения первичных конечных точек, ассоциированных с поражением сосуда-мишени, в течение 9 мес наблюдения снизилась с 15,1% при имплантации металлического стента без покрытия до 7,9% при имплантации стента Endeavor (р = 0,0001). После имплантации стента Endeavor потеря просвета стента в отдаленные сроки уменьшилась с 1,03 до 0,61 мм (р < 0,001), а частота рестенозов снизилась с 35 до 13,2% (р < 0,0001).
В исследовании ENDEAVOR III проводили сравнение этих стентов со стентами Cypher у 436 больных, рандомизированных в соотношении 3:1, однако не удалось доказать преимущества стентов Endeavor в отношении первичной конечной точки (уменьшения просвета сосуда) в течение 8 мес (0,34 мм — после имплантации стента, содержащего зотаролимус, и 0,13 мм — после использования стента, содержащего сиролимус), при этом потеря просвета в отдаленные сроки была больше (0,60 и 0,15 мм соответственно, р < 0,001).
Не было выявлено значимых различий в отношении частоты реваскуляризаций сосуда-мишени между двумя группами (6,3 и 3,5% соответственно, р = 0,34). Программа ZOMAXX (Randomized controlled study of the zotarolimus-eluting, phosphorylcholine-coated, TriMaxx stent) была остановлена после того, как обнаружили несколько большее уменьшение просвета сосуда в отдаленные сроки после имплантации этих стентов в исследовании ZOMAXX I.
4. Стенты с покрытием, содержащим эверолимус. В исследовании стентов Xience (Abbott Vascular, Santa Rosa, CA) использовали кобальт-хромовый стент Vision — прочный фторполимер с эверолимусом, который является аналогом рапамицина, обладающим как иммуносупрессивным, так и антипролиферативным эффектами. Программа SPIRIT, основанная на ранее проведенных исследованиях абсорбируемого L-полимера лактата, продемонстрировала уменьшение степени сужения сосуда в отдаленные сроки по сравнению со стентами Cypher. В настоящее время идет крупное (> 1 тыс. пациентов) рандомизированное исследование SPIRIT III, в котором сравнивают стенты Vision, содержащие эверолимус, со стентами Taxus.
5. Программа CoStar. Стент CoStar (Conor Medsystems, Menlo Park, CA) — кобальт-хромовый стент, содержащий 492 резервуара с лекарственным препаратом, расположенных вдоль всей его длины (16 мм), и покрытый сополимером полилактата и гликолевой кислоты, что позволяет высвобождать паклитаксел в течение 10-30 сут. В исследовании COSTAR II (Cobalt Chromium Stent with Antiproliferative for Restenosis) сравнивали исходы через 8 мес после имплантации стентов CoStar или Taxus. Через 8 мес у пациентов, которым был имплантирован стент CoStar, было выявлено значительно больше серьезных нежелательных кардиальных событий (11%) по сравнению с больными, которым был имплантирован стент Taxus (6,9%, р = 0,005).
Эта разница была обусловлена главным образом большей частотой реваскуляризаций сосуда-мишени у пациентов со стентами CoStar (8,1%), чем у пациентов со стентами Taxus (4,3%, р = 0,002). Не было выявлено различий в частоте сердечно-сосудистой смерти (0,5% в группе CoStar vs 0,7% в группе Taxus, р = 0,541) или повторных ИМ (3,4% vs 2,4% соответственно, р = 0,24) (личное сообщение Mitchell W. Krucoff, EuroPCR, Barcelona).
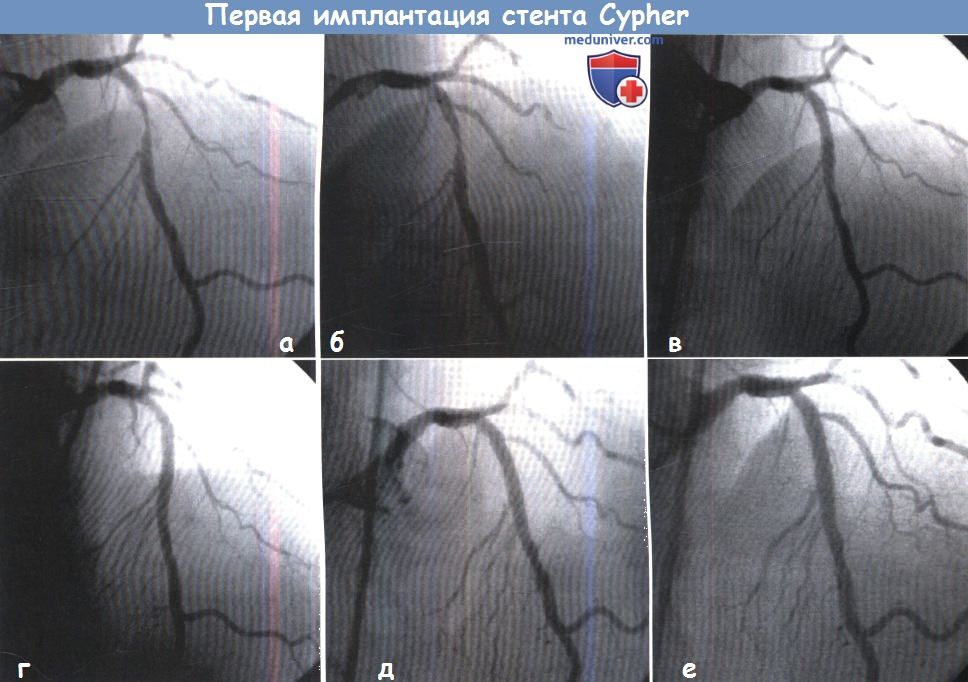
(А) Виден локальный стеноз в средней части ЛПНА.
(Б) Содержащий сиролимус стент Cypher (Cordis Corp., Warren, NJ) располагают в области стеноза.
(В) Очень хороший немедленный результат по данным ангиографии без признаков остаточного стеноза.
Последующие ангиографические исследования были выполнены через 4 мес (Г), 1 год (Д) и 2 года (Е) после вмешательства, признаки стеноза отсутствуют.
- История и варианты чрескожного коронарного вмешательства (ЧКВ)
- Показания для стентирования коронарных артерий (чрескожного коронарного вмешательства, ЧКВ)
- Факторы риска стентирования коронарных артерий (чрескожного коронарного вмешательства, ЧКВ)
- Сосудистый доступ при стентировании коронарной артерии (чрескожном коронарном вмешательстве, ЧКВ)
- Что делают при баллонной ангиопластике (БАП)? Возможности
- Что делают при коронарной атерэктомии? Возможности
- Что делают при тромбэктомии? Возможности
- Устройства для профилактики эмболии коронарных артерий после чрескожного коронарного вмешательства (ЧКВ)
- Виды коронарных стентов и их возможности
- Антитромбоцитарные средства при стентировании коронарных артерий (чрескожном коронарном вмешательстве, ЧКВ)
