Оценка сердца после инфаркта миокарда
На выживаемость как в ближайшие сроки, так и в отдаленном периоде влияют три фактора: ФВ ЛЖ в покое, остаточный объем потенциально ишемизированного миокарда и вероятность развития жизнеугрожающих желудочковых аритмий. Наиболее важный из перечисленных факторов — фракция выброса. Вторым по значимости фактором является выраженность и распространенность обструктивных поражений КА, кровоснабжающих оставшийся жизнеспособный миокард и ответственных за развитие повторного ИМ, дополнительного повреждения миокарда, а также желудочковая аритмия (ЖА).
Таким образом, можно сделать вывод, что выживаемость зависит от размера уже некротизированного миокарда, а также от размера миокарда, который может подвергнуться некрозу в дальнейшем. Прогноз лучше у больных с неповрежденными КА, у которых в результате эмболизации КА поражается небольшой участок миокарда ЛЖ (5%) и у которых миокард не подвержен риску. У больных с обширным ИМ, осложненным левожелудочковой недостаточностью, у которых жизнеспособный миокард кровоснабжается сосудами со значительно нарушенным кровотоком, прогноз хуже.
Дальнейшее развитие атеросклероза или уменьшение перфузионного давления в таких сосудах снижают функцию и уменьшают жизнеспособность оставшегося миокарда, отвечающего за функцию ЛЖ.
Реваскуляризация может уменьшить риск повреждения миокарда даже у такого больного. Третьим фактором риска служит предрасположенность к развитию жизнеугрожающих аритмий. При этом важным является наличие желудочковой эктопической активности, а также других признаков электрической нестабильности миокарда, например снижения вариабельности сердечного ритма или повышения барорефлекторной активности, а также наличие отклонений при регистрации сигнал-усредненной ЭКГ. Все пациенты, у которых выявляют перечисленные признаки, попадают в группу высокого риска смерти.
а) Оценка функции левого желудочка при инфаркте миокарда. Наиболее просто оцениваемой характеристикой функции ЛЖ является ФВ, которую наиболее часто используют при стратификации риска. Тем не менее возможны ошибки при визуализации ЛЖ в покое на фоне необратимого повреждения, станнирования или гибернации миокарда.
Для решения этой проблемы исследовали различные методы оценки объема оставшегося жизнеспособного миокарда, включая тесты с ФН и фармакологической нагрузкой, нагрузочную радионуклидную вентрикулографию, визуализацию перфузии с применением фармакологической нагрузки, ПЭТ, а также МРТ с контрастированием гадолинием. Все эти методы можно безопасно применять у больных после ИМ.
Поскольку ни в одном из проведенных исследований не было доказано диагностического преимущества какого-либо из методов, при выборе метода визуализации клиницисты должны руководствоваться техническими возможностями и опытом конкретного лечебного учреждения.
У пациентов с низкой ФВ для стратификации риска, а также определения границ безопасных нагрузок после выписки из стационара необходимо определять уровень переносимой ФН. Пациенты с хорошей переносимостью ФН, несмотря на снижение ФВ, в отдаленном периоде имеют лучший прогноз, чем лица со сниженной переносимостью нагрузок.
б) Оценка ишемии миокарда. В связи с риском развития осложнений и рецидива после ИМ↑ST крайне важно оценить риск ишемии или повторного ИМ в будущем. Принимая во внимание расширяющиеся возможности фармакотерапии, малоинвазивного и хирургического методов лечения в предотвращении рецидивов ишемии миокарда, для клинициста становится все более важным выявить пациентов с высоким риском до момента выписки. Обследование до выписки с целью диагностики постинфарктной ишемии позволяет практикующему врачу идентифицировать тех пациентов, которым выполнение катетеризации и реваскуляризации после ИМ↑ST может принести наибольшую пользу, а также оценить адекватность консервативной терапии.
Проба с физической нагрузкой. Проведение пробы с ФН позволяет врачу рекомендовать пациенту конкретную программу расширения ФА, а также помогает пациенту обрести уверенность в повседневной деятельности после выписки из стационара. Пациентам, неспособным выполнить нагрузочный тест, можно провести пробу с фармакологической нагрузкой, например добутамином или дипиридамолом, в сочетании с ЭхоКГ или визуализацией перфузии.
Проба с ФН на тредмиле после ИМ↑ST традиционно предполагает применение субмаксимальной ФН до момента появления симптомов стенокардии или признаков ишемии миокарда на ЭКГ либо достижения целевого уровня ФН (5 метаболических эквивалентов). Установлено, что у больных с неосложненным ИМ во время госпитализации возможно безопасное проведение симптом-ограниченных проб с нагрузкой. Для определения риска смерти или рецидива нефатального ИМ после ИМ↑ST исследовали различные результаты нагрузочных проб: появление и степень выраженности депрессии сегмента ST, развитие приступа стенокардии, переносимость ФН, а также изменение САД на фоне нагрузки.
в) Оценка электрической стабильности сердца после инфаркта миокарда. Наибольший риск развития внезапной сердечной смерти (ВСС) в результате злокачественной ЖА наблюдается в первые 1-2 года после ИМ↑ST. Для стратификации больных но группам риска ВСС при ИМ↑ST предложены следующие методы: оценка ва-риабильности интервала QT в нескольких отведениях, холтеровское мониторирование ЭКГ, инвазивное электрофизиологическое исследование, запись сигнал-усредненной ЭКГ (измерение задержек и фрагментации проведения в зоне ИМ), а также оценка вариабельности сердечного ритма (интервалов R-R) и барорефлекторной чувствительности (наклона линии регрессии, изменения ЧСС в ответ на изменение АД).
Однако ни один из этих методов не рекомендуется к использованию рутинно. При наличии у больных ИМ↑ST отклонений но результатам одного или нескольких неинвазивных методов обследования необходимо учитывать несколько фактов. Низкая прогностическая ценность положительного результата (< 30%) неинвазивных скрининговых тестов ограничивает их применение по отдельности. И хотя прогностическую ценность этих тестов можно увеличить путем их комбинирования, отсутствует терапевтическая значимость выявленного с их помощью повышенного риска нарушений ритма.
Несмотря на снижение смертности, достигаемое при использовании β-АБ, ИАПФ, аспирина и реваскуляризации после ИМ, и стремление наиболее безопасно и экономически целесообразно использовать антиаритмические препараты и имплантируемые дефибрилляторы, остается в значительной степени неясным клиническое значение электрической нестабильности, выявленной при неинвазивном обследовании бессимптомных больных. В случае выявления отклонений у бессимптомного больного необходимо получить дополнительную информацию до выбора тех или иных рекомендаций. Лечение больных с устойчивыми, гемодинамически значимыми нарушениями ритма обсуждено в отдельных статьях на сайте.
г) Профилактическое назначение антиаритмических препаратов. В течение нескольких десятилетий считали, что ангиаритмическая терапия помогает контролировать предсердные и желудочковые аритмии, но в сравнительно недавно проведенных исследованиях ИМ↑ST было показано, что антиаритмические препараты I класса значительно увеличивают риск смерти. Наиболее крупной работой в этой области является исследование CAST (Cardiac Arrhythmia Suppression Trial), в котором изучали эффективность энкаинида, флекаинида и морицизина в предупреждении и подавлении развития желудочковых аритмий, диагностируемых в результате амбулаторного мониторинга ЭКГ, а также возможность данной терапии снизить риск остановки сердца и смерти в отдаленном периоде.
Исследования первой фазы (энкаинид или флекаинид в сравнении с плацебо) и второй фазы (морицизин в сравнении с плацебо) были остановлены до завершения, поскольку предварительный анализ показал увеличение смертности в группах «агрессивной» терапии. Механизм, влияющий на увеличение риска при ИМ↑ST, остается предметом изучения. В соответствии с одной из гипотез, появляется нежелательное взаимодействие между рецидивирующей ишемией и антиаритмическим препаратом. Основанием для этого предположения стали результаты предыдущих исследований, продемонстрировавшие увеличение риска смерти или остановки кровообращения в группе с HeQ-ИМ по сравнению с группой Q-ИМ. Блокада натриевых каналов антиаритмическими препаратами может усугубить электрофизиологические расхождения между субэпикардиальными и субэндокардиальными областями миокарда, делая их уязвимыми к ишемическому повреждению.
После CAST проводили исследование SWORD (Survival With Oral D-sotalol) по профилактическому применению антиаритмических препаратов, в котором изучали d-соталол. Это исследование также было остановлено раньше планируемого завершения после отбора всего 3121 участника, а не предполагаемых 6400, поскольку статистически было доказано увеличение смертности в группе «агрессивного» лечения. В исследовании CAMIAT (Canadian Amiodarone Myocardial Infarction Trial) было показано, что применение амиодарона у больных ИМ снижает частоту преждевременной деполяризации желудочков, что коррелировало с летальными исходами из-за аритмии, а также реанимационными мероприятиями в результате развития ФЖ. Тем не менее прием амиодарона во время курса поддерживающей терапии по схеме исследования CAMIAT в 42% случаев прекращали из-за развития нежелательных побочных эффектов (ПЭ).
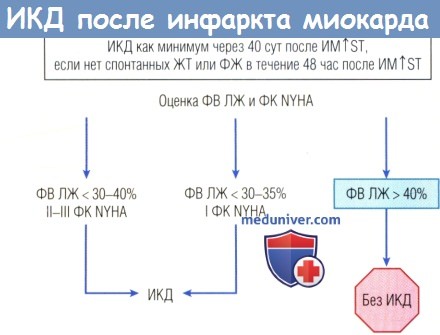
Стратегия терапии основана на измерении фракции выброса (ФВ) левого желудочка (ЛЖ). Перед установкой ИКД следует вновь определить ФВ, даже если ее определяли в первые 3 дня после ИМ↑ST.
При ФВ < 30-40%, выявленной как минимум через 40 сут после ИМ↑ST, установка ИКД показана только при II-III ФК NYHA.
При меньшей ФВ (< 30-35%) установка ИКД показана даже при I ФК NYHA, т.к. у таких больных существует высокий риск внезапной сердечной смерти (ВСС).
При сохранной функции ЛЖ (ФВ > 40%) ИКД не устанавливают, а назначают лекарственную терапию.
NYHA — New York Heart Association; ФК — функциональный класс.
В исследовании EMIAT (European Amiodarone Myocardial Infarction Trial) продемонстрировано снижение частоты случаев смерти из-за аритмии после ИМ у больных со сниженной функцией ЛЖ. Однако при этом не было доказано снижения общей смертности (ОС) и сердечно-сосудистой смертности по другим причинам.
Рекомендации. В настоящее время рутинное применение антиаритмических препаратов (в т.ч. амиодарона) не рекомендовано. Принимая во внимание данные о защитных свойствах β-АБ в отношении предупреждения внезапной смерти (ВС), а также эффекты аспирина в плане снижения риска повторного ИМ, не вполне очевидно, можно ли дополнительно снизить смертность в случае добавления амиодарона к терапии больного, выздоравливающего после ИМ↑ST, если у него отсутствует симптоматическая устойчивая желудочковая аритмия (ЖА).
В нескольких популяционных исследованиях с участием больных, переживших ИМ↑ST, было доказано значительное снижение смертности в группе имплантируемых кардиовертеров-дефибрилляторов по сравнению с группой консервативного лечения. В настоящее время кардиовертеры-дефибрилляторы пациентам с ИМ↑ST имплантируют согласно алгоритму, представленному на рисунке ниже.
- Читать "Профилактика повторного инфаркта миокарда после выписки"
Оглавление темы "Лечение инфаркта миокарда.":- Тромбоэмболия легочной артерии (ТЭЛА) после инфаркта миокарда
- Аневризма левого желудочка после инфаркта миокарда
- Тромбоз левого желудочка после инфаркта миокарда
- Когда выписывают после инфаркта миокарда?
- Стратификация риска после инфаркта миокарда (ИМ↑ST)
- Оценка сердца после инфаркта миокарда
- Профилактика повторного инфаркта миокарда после выписки
- Результаты сравнения эффективности ангиопластики и тромболизиса при инфаркте миокарда
- Преимущества первичного чрескожного коронарного вмешательства (ЧКВ) при инфаркте миокарда
- Время для проведения чрескожного коронарного вмешательства (ЧКВ) при инфаркте миокарда
