Осложнения и прогноз коронарного шунтирования при стабильной стенокардии напряжения
Популяция пациентов, направляемых на коронарное шунтирование (КШ), с течением времени изменилась главным образом из-за более широкого применения стентирования (чрескожного коронарного вмешательства, ЧКВ).
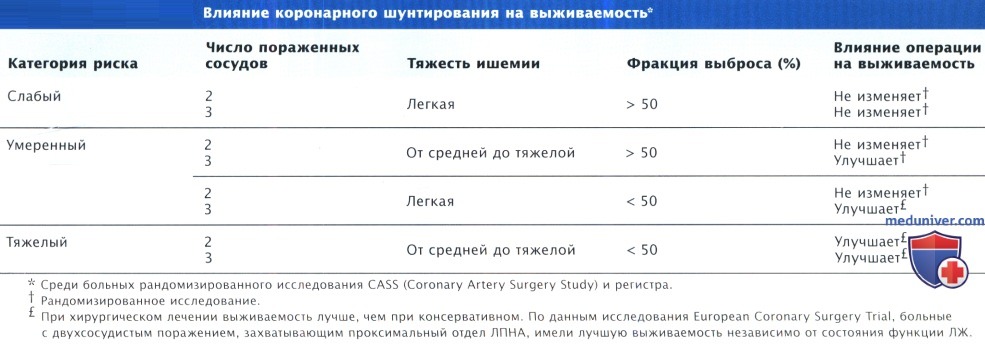
По сравнению с 1970-ми гг. пациенты, направляемые на коронарное шунтирование (КШ), старше, более высокий процент составляют женщины, пациенты имеют более тяжелую степень заболевания, в т.ч. высокую частоту НС, грехсосудистого поражения, предшествующую коронарную реваскуляризацию методом КШ или ЧКВ, дисфункцию ЛЖ и коморбидные состояния (АГ, СД и поражение периферических артерий). Несмотря на высокий риск, исходы КШ в данной популяции в целом не становятся хуже и даже улучшаются.
а) Операционная смертность. Факторы риска (ФР) смерти после хирургического вмешательства на коронарную артерию (КА) можно разделить на 5 категорий:
(1) дооперационные факторы, связанные к КБС, — недавно перенесенный ОИМ, гемодинамическая нестабильность, дисфункция ЛЖ, большая распространенность поражения КА, поражение ЛГКА, а также тяжелая форма стабильной или нестабильной стенокардии;
(2) дооперационные факторы, связанные с тяжестью атеросклеротического процесса, что проявляется сопутствующим поражением СА и периферических артерий;
(3) дооперационные биологические факторы — пожилой возраст на момент операции, СД, сопутствующие заболевания легких и почек, женский пол;
(4) интраоперационные ФР (интраоперационное ишемическое повреждение и невозможность использования ВМА);
(5) внешние факторы и возможности медицинского центра, в котором проводят операцию, в т.ч. особенности протокола хирургического вмешательства и терапии.
Среди перечисленных факторов наиболее значимыми предикторами смертности после коронарного шунтирования (КШ) служат:
(1) возраст;
(2) неотложный характер операции;
(3) предшествующие кардиохирургические вмешательства;
(4) функция ЛЖ;
(5) процент стеноза ЛГКА;
(6) количество эпикардиаль-ных сосудов со значимым стенозом.
С 1967 по 1980 г. внутригоспитальная смертность после изолированного КШ неуклонно снижалась. Несмотря на увеличение демографического риска, ранняя смертность продолжала снижаться и в 1990-х гг.. В частности, в США за период 1990-1999 гг. нескорректированная смертность в течение 30 су г после КШ снизилась на 0,9% (относительное снижение 23,1%, р < 0,0001).
Согласно базе данных STS (Society of Thoracic Surgeons), среди 503 478 больных, перенесших только КШ, смертность за период 1997-1999 гг. составила 3,05%. В 2005 г. кумулятивный показатель смертности при проведении только КШ среди больных, зарегистрированных в базе данных STS, составил 2,2%. Более того, при более тщательной оценке результатов вмешательства было установлено, что абсолютные показатели заболеваемости и смертности непригодны для сравнения, если при этом не учитывают характеристики конкретного больного.
Разработаны и усовершенствованы несколько моделей для прогнозирования периоперационной смертности. При использовании этих моделей было показано, что за последние 10 лет смертность после КШ снизилась в большей степени, чем можно было ожидать, исходя из профиля риска.
Частота периоперационных осложнений возросла из-за увеличения доли больных с высоким риском. Серьезные осложнения (например, смерть, МП, ПН, повторная операция, длительная ИВЛ, инфекционные осложнения со стороны грудины) в течение 30 сут после операции были отмечены у 13,4% из 503 478 больных, включенных в базу данных STS в период 1997-1999 гг..
а) Инфаркт миокарда при коронарном шунтировании (КШ). Периоперационный ИМ, особенно протекающий с нарушениями ритма сердца или гемодинамики, а также при наличии предшествующей дисфункции ЛЖ, оказывает самое неблагоприятное влияние на ранний и отдаленный прогнозы. Средняя частота этого осложнения составляет 3,9% (медиана 2,9%), однако показатель имеет большой разброс значений (от 0 до > 10%), связанный с неоднородностью диагностических критериев.
Чаще всего таким критерием является пятикратное превышение верхней границы нормального уровня изофермента миокардиальной КК-МВ.
Проспективные наблюдения с рутинной оценкой КК-МВ в послеоперационном периоде выявили независимую связь между этим показателем и смертностью. Предикторами периоперационного ИМ в исследовании CASS (Coronary Artery Surgery Study) были женский пол, тяжелая периоперационная стенокардия, тяжелый стеноз ЛГКА и трехсосудистое поражение. Можно надеяться, что применение акадезина (нового средства, повышающего концентрацию аденозина в ишемизированных тканях) позволит снизить смертность, связанную с периоперационным ИМ.
б) Респираторные осложнения. Большинство больных экстубируют через 6-8 час после КШ. Потребность в длительной ИВЛ (> 24 час) возникает у 5-6% больных после первого КШ и у 10-11% — при повторной операции. Причиной могут служить различные факторы, в т.ч. предшествующее заболевание легких и ряд периоперационных факторов, непосредственно связанных с анестезией, уровень сознания, применение АПК, боль в месте операционного разреза, плевральные дренажи и, иногда, повреждение диафрагмального нерва.
Наличие тяжелой ХОБЛ с показателем форсированного объема выдоха за 1 сек (ФОВ1) < 50% или значением коэффициента ФОВ1/форсированная жизненная емкость < 0,70 ассоциируется с высокой частотой послеоперационных легочных осложнений (29%) и почти двукратным увеличением смертности в отдаленном периоде даже при отсутствии серьезной сопутствующей патологии. Одним из факторов, определяющих необходимость длительной ИВЛ, является также величина ФВ.
в) Кровотечение. Нарушения гемостаза и геморрагические осложнения рассматриваются как неотъемлемый риск КШ. Необходимость повторной операции в связи с кровотечением возникает у 2-6% больных, что сопровождается почти трехкратным увеличением внутригоспигальной смертности. Применение АИК приводит к нарушению внутренних систем коагуляции и фибринолиза, а также ухудшению функции тромбоцитов. Риск кровотечения увеличивается с возрастом, при малой площади поверхности тела, продолжительном применении АПК, повторной операции, билатеральном шунтировании с использованием ВМА, назначении в дооперационном периоде гепарина, аспирина и фибринолитических препаратов. Риск кровотечения уменьшается при использовании апрогинина и аналогов лизина, таких как аминокапроновая и транексамовая кислоты.
Применение клопидогрела в течение 5 дней перед КШ ассоциируется со значительным увеличением риска кровотечения и необходимостью гемотрансфузии. В современных рекомендациях предлагается по возможности отменить клопидогрел как минимум за 5 сут до КШ.
г) Раневые инфекции. Серьезные осложнения, особенно медиастинит и/или расхождение краев операционной раны, возникают у 1-4% больных и связаны с выраженной заболеваемостью и более высокой смертностью. Риск развития этих осложнений увеличивается главным образом при повторной операции и двойном шунтировании ВМА, особенно у больных СД, а также при ожирении. К превентивным мерам относятся тщательная подготовка кожи, повышенное внимание к соблюдению периоперационных мер стерильности и применение антибактериальных препаратов в дооперационном периоде.
К другим факторам, позволяющим снизить риск периоперационных инфекций, относятся строгий контроль уровня глюкозы у больных СД и отказ от излишней гемотрансфузии с учетом ее иммуносунрессивного эффекта. Возможность эффективного лечения глубокой стернальной инфекции зависит от быстрого распознавания и энергичной санации раневой полости с закрытием ее мышечным лоскутом.
д) Послеоперационная артериальная гипертензия (АГ). В послеоперационном периоде АГ отмечается у 30% больных. Механизм ее возникновения неясен, возможно, имеет значение высокий уровень циркулирующих катехоламинов и других гуморальных факторов в сочетании с вазоконстрикцией, развивающейся в результате активации РАС. Контроль послеоперационной АГ важен для профилактики ишемии миокарда, СН и периоперационных кровотечений.
е) Цереброваскулярные осложнения. Неврологические нарушения — грозные осложнения кардиохирургического вмешательства, которые могут привести к росту смертности в отдаленном периоде. Возможной причиной возникновения являются эмболы атеросклеротической природы из Ао и других крупных артерий, эмболы из системы трубок и аппарата АИК, а также интраоперационная гипотензия, особенно у больных с предшествующей АГ. Тип 1 нарушений ассоциируется с большим неврологическим дефицитом, ступором и комой; тип 2 характеризуется ухудшением интеллектуальной функции и памяти. Показатель частоты неврологических расстройств варьирует в зависимости от метода выявления дефицита.
Согласно базе данных Northern New England Cardiovascular Disease Study Group, инсульт за период с 1992 по 2001 г. произошел в 1,6% случаев, но в проспективных исследованиях показатель был выше (1,5-5%). В исследованиях, проводимых с более тщательной оценкой неврологического дефицита, сообщается о большей частоте неврологических осложнений. В раннем периоде после КШ тип 1 дефицита наблюдался у 6% больных, частота кратковременных когнитивных нарушений составляла от 33 до 83%. При проведении длительного проспективного исследования с применением методов сложного современного нейрокогнитивного тестирования было выявлено снижение когнитивной функции у 53% больных на момент выписки из стационара, у 36% — через 6 нед и у 24% — через 6 мес.
Наиболее сильными предикторами развития неврологических осложнений после применения АИК (включающих МИ, делирий и нейрокогнитивную дисфункцию) являются пожилой возраст больных при наличии коморбидных состояний, связанных с атеросклерозом (особенно СД), и интраоперационное вмешательство на Ао. По данным многих, но не всех исследований, сильными предикторами МИ являлись также атеросклероз проксимального отдела Ао и применение внутриаортальной баллонной контрпульсации. Умеренная гипотермия в интра- и периоперационном периодах может способствовать улучшению когнитивной функции после КШ.
ж) Фибрилляция предсердий (ФП). ФП — одно из наиболее частых осложнений КШ. В первые 2-3 сут это нарушение ритма развивается у = 40% больных. В раннем послеоперационном периоде высокая частота желудочковых сокращений и отсутствие эффективной работы предсердий могут привести к ухудшению системной гемодинамики, значительному росту риска эмболизации, увеличению длительности и стоимости пребывания больного в стационаре и повышению вероятности послеоперационного МИ в 2-3 раза. Высокий риск ФП после кардиохирургического вмешательства ассоциируется с пожилым возрастом, АГ, предшествующей ФП и ХСН. Терапия статинами до вмешательства, возможно, сочетается с меньшим послеоперационным риском этого осложнения.
Профилактический прием β-АБ уменьшает частоту послеоперационной ФП; при отсутствии противопоказаний их необходимо назначать перед КШ в плановом порядке. Амиодарон также эффективен при профилактике послеоперационной ФП и может быть назначен при высоком риске развития данного осложнения. Риск послеоперационной ФП можно снизить за счет отказа от применения АИК. Частота спонтанного восстановления синусового ритма в течение 24 час без назначения каких-либо препаратов, кроме дигоксина для контроля частоты желудочковых сокращений, достигает 80%. В рандомизированных исследованиях показано, что, если восстановление ритма при послеоперационной ФП происходит до момента выписки, продолжение антиаритмической терапии более 1 нед не имеет явных преимуществ. У большинства больных синусовый ритм восстанавливается через 6 нед после операции.
з) Брадиаритмии и нарушения проводимости. В наблюдении 1614 больных, последовательно выписанных из стационара после КШ, частота послеоперационных брадиаритмий, требующих установки постоянного кардиостимулятора, составляла 0,8%. Предрасполагающими факторами были дооперационная БЛНПГ, сопутствующая левожелудочковая аневризмэктомия и пожилой возраст. У большинства больных сохранялась необходимость в кардиостимуляторе на протяжении всего периода наблюдения.
и) Нарушения функции почек. ПН после КШ развивается достаточно редко (0,5-1,0%), но сочетается со значительно более высокой заболеваемостью и смертностью. Значительно чаще (7-8%) наблюдается снижение функции почек, которое распознают по уровню сывороточного Кр > 2 мг/дл или по превышению исходного уровня Кр более чем на 0,7 мг/дл. Предикторами развития послеоперационной дисфункции почек служат пожилой возраст, СД, предшествующее нарушение функции почек и СН. У больных с дооперационной дисфункцией почек и уровнем сывороточного Кр > 2,5 мг/дл повышен риск назначения гемодиализа. Такие пациенты являются кандидатами на применение альтернативных методов реваскуляризации или диализа в профилактических целях. Рандомизированное исследование эффективности А-ацетилцистеина для профилактики дисфункции почек у 295 больных, перенесших КШ, не выявило различий с плацебо.
к) Возвращение к трудовой деятельности. Показатель полного возвращения к трудовой деятельности варьирует (от 35 до 80%), но у лиц, работавших перед проведением КШ, он достигает 80%. После КШ больные возвращаются к трудовой деятельности на 6 нед позднее, чем после ЧКВ, однако в отдаленной перспективе процент работающих больных после КШ и ЧКВ не различается (> 80%). Неблагоприятно влияют на перспективу возвращения к труду пожилой возраст, послеоперационная стенокардия, неудовлетворенность работой или ее отсутствие либо нетрудоспособность до операции.
л) Проходимость венозных шунтов. Экспериментальные исследования и наблюдения за больными показали, что патологический процесс в венозных аортокоронарных шунтах имеет несколько фаз развития. Частота окклюзий, высокая в 1-й год после операции, постепенно уменьшается в период между 1-ми 6-м годами. В период с 6-го по 10-й год после операции частота износа шунтов снова увеличивается. Ранняя окклюзия венозных шунтов (до выписки из стационара) возникает в 8-12% случаев; через 1 год частота окклюзий составляет 15-30%.
После 1-го года ежегодная частота окклюзий составляет 2%, а в период с 6-го по 10-й год ежегодно увеличивается на 4%. Через 10 лет ~ 50% венозных шунтов окклюзируются, в большой части оставшихся проходимыми шунтов присутствует выраженный атеросклеротический процесс, при этом формирование значимого стеноза наблюдается в 20-40% случаев. Показатели проходимости шунтов ВМА выше. Предикторами окклюзии шунта являются малый диаметр оперируемого сосуда и такие ФР, как высокий уровень ХС ЛНП и низкий уровень ХС ЛВП, предшествующий ИМ, мужской пол, активное курение. Недостаточность венозного шунта ассоциируется с более чем двукратным увеличением риска смерти, ИМ или необходимости дополнительной реваскуляризации.
1. Ранний период (первый месяц). Развитию тромбогической окклюзии проксимального или дистального отдела анастомоза могут способствовать некоторые технические факторы, например перегиб чрезмерно длинного шунта, растяжение из-за недостаточной длины, малый кровоток в шунте и недостаточный кровоток дистальнее шунта. Хирургические манипуляции на подкожной вене бедра в процессе ее выделения и подготовки к шунтированию могут приводить к повреждению эндотелия, депонированию тромбоцитов, фибрина и последующему тромбозу.
2. Промежуточный период (от 1 мес до 1 года). На протяжении периода от 1 мес до 1 года в венозных шунтах, имплантированных в артериальную систему, происходят процессы денудации и пролиферации эндотелия и миграции клеток медии в направлении интимы. ГМК сосудов также могут перемещаться через внутренний эластический слой в интиму. Через несколько месяцев после этой начальной фазы быстрой пролиферации происходит увеличение соединительнотканного матрикса, что приводит к утолщению интимы и медии. Этот ускоренный процесс гиперплазии и утолщения интимы, в основе которого лежат взаимодействие тромбоцитов с макрофагами и повреждение эндотелия, представляет собой раннюю фазу формирования АБ. При локализации выраженного пролиферативного процесса в месте анастомоза шунта с артерией-реципиентом полная окклюзия может сформироваться в течение 1 года.
3. Поздний период (> 1 года). Ряд исследователей полагают, что развитие атеросклероза в венозных шунтах, как и в нативных артериях, является совокупностью тесно связанных между собой процессов, к которым относятся отложение тромбоцитов с развитием пролиферации ГМК на начальном этапе и включение липидов в АБ на заключительном этапе. К 10-му году окклюзируегся приблизительно 50% шунтов, сохранявших проходимость в течение 5 лет после вмешательства. После 1-го года, особенно в период с 3-го по 5-й год, гистологические изменения в шунтах, подвергшихся окклюзии или обструкции, обусловлены атеросклерозом. Поздний атеросклероз шунта часто характеризуется распространенным тромбозом и значительной рыхлостью повреждений, в результате развивается интермиттирующая эмболия дистальных отделов, которая, в свою очередь, затрудняет проведение повторной реваскуляризации, как ЧКВ, так и КШ.
4. Определение проходимости шунта. Хотя ангиография является наиболее часто используемым методом оценки проходимости венозного шунта, у многих больных диффузный характер атеросклеротического процесса, суживающего внутренний диаметр на всем протяжении сосуда, может приводить к недооценке тяжести локальных изменений. Изучают возможности альтернативных подходов для оценки проходимости шунта, таких как КТ с контрастным усилением, фазово-контрастная магнитно-резонансная ангиография, флуоресцентные визуализирующие методы, чрескожная УЗИ и магнитно-резонансное измерение кровотока при ангиографии.
м) Проходимость артериальных шунтов. Сравнительные морфологические и ангиографические исследования показали, что при длительном сроке имплантирования ускоренное развитие атеросклероза чаще встречается в шунтах из подкожных вен ноги и чрезвычайно редко — в шунтах ВМА. Существует несколько объяснений преимущества шунтов ВМА. Срединная оболочка артерии может снабжаться питательными веществами не только из просвета сосуда, но и из vasa vasorum, а внутренний эластический слой ВМА является однородным. Установлено, что эндотелий ВМА по сравнению с эндотелием подкожной вены ноги продуцирует значительно большее количество простациклина, что обеспечивает более активную эндотелий-зависимую релаксацию и возможность ауторегуляции сосудистого тонуса в зависимости от величины кровотока. В шунтах ВМА иногда развивается фиброзная пролиферация интимы, приводящая к сужению просвета и поздней окклюзии сосуда.
По сравнению с венозными шунтами использование ВМА позволяет добиться лучших клинических и ангиографических исходов. В одной из работ показатель проходимости шунтов ВМА составлял 95, 88 и 83% через 1 год, 5 и 10 лет соответственно. Через 1 год после вмешательства показатели проходимости венозных и артериальных шунтов вполне сопоставимы, но через 5 и 10 лет наблюдается значительное преимущество артериальных шунтов. Например, в исследовании VA (Veterans Affairs) проходимость венозных и артериальных шунтов составляла через 10 лет 61 и 85% соответственно. Хорошие отдаленные результаты также были достигнуты при использовании правой ВМА в качестве свободного трансплантата или последовательных шунтов.
В соответствии с этими ангиографическими данными больные с анастомозом ВМА имеют более низкие ранний и отдаленный риски серьезных кардиальных событий, включая смерть, ИМ и повторные операции, причем преимущество сохраняется на протяжении 20 лет. Показатель проходимости шунтов из лучевой артерии через 1 год также выше, чем у венозных шунтов (91,8% vs 86,4%).
н) Прогрессирование заболевания в нешунтированных артериях. В нешунтированных нативных артериях прогрессирование патологического процесса, т.е. усугубление предшествующих повреждений или появление новых сужений сосуда на > 50%, возникает с частотой 20-40% за период от 5 до 10 лет. Прогрессирование процесса наиболее часто происходит в тех участках артерий, где уже были признаки поражений, причем в шунтированных нативных КА это происходит в 3-6 раз чаще, чем в нешунтированных сосудах. Эти данные позволяют предположить, что шунтирование артерий с незначительными патологическими изменениями, даже эффективное на начальном этапе, может в итоге нанести вред больному из-за увеличения риска закрытия анастомоза и ускорения обструкции в нативных сосудах. Протяженные (> 10 мм) участки повреждения нативных сосудов и занимающие > 70% диаметра сосуда имеют повышенный риск прогрессирования процесса или полной окклюзии.
о) Эффекты терапии на окклюзию венозного шунта и прогрессирование заболевания в нативных сосудах. Меры, способствующие улучшению отдаленных показателей проходимости, направлены на замедление атеросклеротического процесса в целом, поэтому могут оказывать дополнительный положительный эффект. Вторичная факрмакологическая профилактика, особенно гиполипидемическая терапия, имеет важное значение для снижения риска возникновения несостоятельности венозных шунтов. Отсутствуют убедительные данные о влиянии постоянного приема антикоагулянтов на результаты лечения. Новые подходы, например предварительная обработка венозных шунтов для повышения резистентности к атеротромбозу, изучены недостаточно.
1. Антитромбоцитарная терапия. В некоторых исследованиях была показана эффективность терапии аспирином, если ее начинали за 1, 7 и 24 час до операции, и отсутствие эффекта при начале приема через > 48 час после операции. Аспирин в дозе 80-325 мг/сут необходимо применять неопределенно долго. Добавление дипиридамола или варфарина в обычных дозах не давало безусловных дополнительных преимуществ. Хотя эффект клопидогрела на проходимость шунтов специально не изучали, препарат, вероятно, не менее эффективен, чем аспирин, и рекомендуется больным с повышенной чувствительностью к аспирину или недавно перенесшим ОКС.
2. Липидснижающая терапия. В 3 рандомизированных исследованиях липидснижающая терапия положительно влияла на развитие патологического процесса в шунтах. Исследование Post-Coronary Artery Bypass Graft Trial показало необходимость снижения уровня липидов в послеоперационном периоде при наличии у больного хотя бы одного проходимого венозного шунта и концентрации ХС ЛНП = 130-175 мг/дл.
«Агрессивное» лечение ловастатииом и при необходимости холестирамином, направленное на снижение уровня ХС ЛНП < 100 мг/дл, сопровождалось более низкой частотой прогрессирования атеросклероза в шунтах (27% vs 39%, р < 0,001) и меньшей частотой повторных реваскуляризаций за 4-летний период наблюдения по сравнению с умеренной терапией, в результате которой уровень ХС ЛНП в среднем составлял 134 мг/дл. Аналогичная закономерность наблюдалась при применении других липидснижаюгцих препаратов, в т.ч. холестипола, ниацика и гемфиброзила.
3. Прекращение курения. В рандомизированном исследовании CASS и других наблюдениях было убедительно доказано, что продолжение курения после операции шунтирования повышает показатели смертности, частоту рецидивов стенокардии, увеличивает потребность в повторной госпитализации и повторной реваскуляризации. Как и ожидалось, продолжение курения сопровождалось ангиографически подтвержденным прогрессированием патологического процесса в шунтах.
п) Другое лечение. Рандомизированное слепое плацебо-контролируемое исследование эффективности применения для профилактики несостоятельности шунтов эдифолигида, ингибитора факторов транскрипции семейства E2F, участвующего в регуляции процесса пролиферации ГМК сосудов, не выявило преимуществ по сравнению с плацебо. С учетом имеющихся перспектив по совершенствованию методов трансфекции и накопления данных о механизмах клеточных сигналов активный интерес к генной терапии шунтов сохраняется.
- Читать "Показания и отбор больных для коронарного шунтирования (КШ)"
Оглавление темы "Лечение стабильной стенокардии напряжения.":- Варианты коронарного шунтирования при стабильной стенокардии напряжения
- Осложнения и прогноз коронарного шунтирования при стабильной стенокардии напряжения
- Показания и отбор больных для коронарного шунтирования (КШ)
- Частота ослабления стенокардии после коронарного шунтирования
- Выживаемость и смертность после коронарного шунтирования
- Результаты коронарного шунтирования при стенозе левой главной коронарной артерии (ЛГКА)
- Результаты коронарного шунтирования при сниженной функции левого желудочка
- Результаты коронарного шунтирования при гибернации миокарда
- Особенности коронарного шунтирования у женщин
- Особенности коронарного шунтирования у молодых и пожилых пациентов
