Сердечно-сосудистые заболевания после операции на сердце
а) Гипотензия и низкий сердечный выброс. Дооперационная дисфункция желудочка — наиболее важный фактор, определяющий низкий СВ после операции. Дополнительными факторами низкого СВ являются недостаточная защита миокарда во время длительного использования АИК, что приводит к отеку миокарда, потере высокоэнергетических фосфатов и накоплению свободных радикалов кислорода, технические ошибки хирурга и периоперационный ИМ. Различия между истинной дисфункцией миокарда и перикардиальной тампонадой имеют существенное значение и могут создавать проблемы, не встречающиеся у пациентов, которым не проводили хирургическое вмешательство. У пациентов после операции давление в ПП и ДЗАА могут быть одинаково низкими (8-10 мм рт. ст.). В этой ситуации возможно формирование сгустков в перикарде, что приводит к неравномерному сдавлению полости.
Обычно такие сгустки локализуются около ПП в области венозной канюляции. Это может привести, например, к компрессии ПП с набуханием шейных вен и низким давлением наполнения сердца. Также было отмечено селективное ограничение наполнения АП, связанное с повышенным давлением наполнения в правых полостях сердца и низким давлением в ЛП. Путем в/в введения жидкости ДЗАА увеличивают так, чтобы оно в конечном счете превышало давление в ПП на 5 мм рт. ст. при отсутствии тампонады. Исключение будут составлять пациенты с компрессией одной полости (например, ПП) перикардиальным сгустком или низким ДЗАА, вызванным сгустком в области ЛП. Для оценки сократимости ЛЖ и наличия перикардиальной крови полезна ТТЭхоКГ или даже ЧПЭхоКГ у постели больного. В сложных случаях может быть полезно изотопное исследование меченными технецием эритроцитами с отсроченной визуализацией. Многие хирурги предпочитают просто выполнить реторакотомию, даже если есть только подозрение на тампонаду.
В лечении послеоперационного синдрома низкого СВ необходим мониторинг гемодинамики, однако существуют определенные проблемы, уникальные для кардиохирургического пациента. Взаимосвязь ДЗАА или диастолического давления в ЛА с КДД в ЛЖ была поставлена под сомнение в первые часы после операции в связи с изменением податливости желудочков из-за гипотермии, отека миокарда и повышенного ЛСС. Вентиляция легких с положительным давлением в конце выдоха выше давления в ЛП будет также отменять эту взаимосвязь. Системное диастолическое давление или легочное давление, измеренное непосредственно, может быть заниженным из-за слабого затухания систем мониторинга.
ДЗАА может быть низким из-за чрезмерного заклинивания баллоном. Расчетные методы термодилюции в условиях тяжелой трикуспидальной регургитации могут оказаться неточными. В связи с этим общее клиническое обследование больного и изучение гемодинамических показателей в динамике более важны, чем любое одиночное измерение.
Лечение гипотензии или синдрома низкого СВ начинается с обеспечения адекватных оксигенации и уровня гематокрита и оценки ацидоза. Затем давление наполнения должно быть оптимизировано в/в введением жидкости до ДЗАА 18-20 мм рт. ст. (либо выше при ГЛЖ или другой причине диастолической ригидности ЛЖ). Возможно замедленное повышение давления наполнения у пациентов с вазодилатацией, вызванной седацией, лихорадкой, согреванием или другими факторами. ЧСС придется корригировать последовательной стимуляцией предсердий и желудочков с максимальной частотой 90-100 уд/мин. АВ-синхронность имеет жизненно важное значение для поддержания сердечной функции в это время.
1. Вазоактивные препараты. Если низкий СВ или гипотензия сохраняются, необходимо назначение вазоактивных препаратов, которые следует выбирать на основе показаний, перечисленных в таблице ниже. Использование вазоактивных препаратов, механизм их действия и дозы обсуждены и в других главах руководства. Допамин является препаратом первого выбора, а добутамин с преимущественно β1-адренергической стимуляцией, с мягким и конкурирующим α1- и β2-адренергическим эффектом оказывает меньшее влияние на тонус сосудов и ЧСС. Добутамин улучшает сократительную способность миокарда и меньше увеличивает давление наполнения ЛЖ и общее периферическое сосудистое сопротивление (ОПСС), чем допамин, и реже вызывает тахикардию или аритмию.
Добутамин не влияет на высвобождение норадреналина из эндогенных гранул (в отличие от допамина), поэтому может быть полезным при истощении эндогенных гранул и при ХСН. Инотропный миокардиальный эффект обоих препаратов может быть ослаблен эффективной постоянной β-блокадой. Раннее послеоперационное увеличение потребления кислорода миокардом на фоне этих препаратов сопровождается ростом коронарного кровотока без изменения уровня высвобождения лактата, указывая на отсутствие ишемии, несмотря на увеличение работы сердца.
Применение адреналина для увеличения СВ и повышения АД, как правило, резервируют для случаев резистентности к допамину и добутамину. Значимое сужение сосудов почек и благоприятное увеличение работы сердца могут быть омрачены тахикардией и увеличением потребления миокардом кислорода, что приводит к ишемии миокарда при наличии неполной реваскуляризации или остаточной ишемии.
Норадреналин показан для повышения АД с незначительным влиянием на сердечный ритм или тахиаритмии. Его применение ограничивается увеличением сократимости миокарда и уменьшением перфузии внутренних органов, особенно почек. Норадреналин также можно использовать в сочетании с другими препаратами, такими как фентоламин (слабый α-блокатор и прямой релаксант гладких мышц сосудов) или допамин для ослабления интенсивного констриктивного эффекта в результате блокады α-рецепторов, что повышает АД и системное сосудистое сопротивление без изменения сердечного ритма, СВ, давления наполнения и с меньшим сужением сосудов почек.
Изопротеренол приводит к значительному увеличению сократимости, еще большему повышению сердечного ритма с тенденцией к аритмии и некоторому снижению ОПСС. Это существенно увеличивает потребность миокарда в кислороде и шунтирование системного кровотока от внутренних органов и почек. В результате блокады β2-рецепторов уменьшаются ЛСС и бронходилатация. Клинические показания к использованию изопротеренола ограничены его дромотропным эффектом относительно улучшения АВ-проводимости либо повышения автоматизма в случае тахикардии torsades de pointes или асистолии и значительным инотропным действием в ситуациях, когда тахикардия является меньшей проблемой, например при трансплантации сердца. Иногда изопротеренол используют при изолированной правожелудочковой недостаточности, т.к. препарат снижает постнагрузку ПЖ.
Фенилэфрин — это чисто вазоконстрикторный препарат, эффективный при лечении тяжелой системной вазодилатации (вазоплегии), которая изредка возникает как реакция на большие дозы протаминсульфата при нейтрализации гепарина или в результате системной воспалительной реакции при использовании АИК. Еще одно показание — лечение пациентов на фоне длительного приема ИАПФ с данной клинической гемодинамической картиной при попытках отключения от АИК. Новым подходом к предупреждению вазоплегии у таких пациентов является инфузия фенилэфрина в дозе 0,03 мкг/мин во время использования АИК. Фенилэфрин является также прессорным препаратом выбора для лечения гипотензии у пациентов с ГКМП и тяжелой обструкцией ВОЛЖ и отсутствием реакции на введение жидкости.
«Инодилататоры» амринон и милринон улучшают СВ путем снижения сосудистого сопротивления и инотропной стимуляции с небольшим увеличением ЧСС. Эти препараты обладают эффектами как у добутамина, но с меньшим увеличением ЧСС. Из-за уникального механизма действия амринон и милринон можно использовать в дополнение к таким катехоламинам, как добутамин, или отдельно при резистентности к катехоламинам. В качестве препаратов второй линии применение с катехоламинами, отдельно или с прессорами, ограничено резистентностью, длительной гипотензией или тахикардией. Амринон и милринон имеют особое значение в лечении правожелудочковой недостаточности.
Они в отличие практически от всех других вазоактивных препаратов имеют относительно продолжительное действие (> 3 час для амринона и > 2 час для милринона), в течение которого самостоятельная функция сердца восстанавливается полностью.
Заслуживают упоминания и другие препараты, в т.ч. хлорид кальция, который при в/в введении в дозе 0,5-1,0 г дает невыраженное и непродолжительное повышение АД и ОПСС. Несиритид — рекомбинантный МНУП с сосудорасширяющими и натрийуретическими свойствами — используют для улучшения СВ и натрийуреза при тяжелой ХСН с увеличенными нреднагрузкой и постнагрузкой с ограниченным ответом на диуретики. Несиритид успешно используют в раннем послеоперационном периоде у пациентов с тяжелой дисфункцией ЛЖ и устойчивым повышением ОПСС, особенно при нарушении функции почек, когда полезна дилатация артериол почек.

2. Правожелудочковая недостаточность. Острая правожелудочковая недостаточность может привести к дисфункции ЛЖ с катастрофическими последствиями. Оценка насыщения кислородом, оптимизация ЧСС и поддержание АВ-синхронизации, коррекция ацидоза, оптимизация преднагрузки, постнагрузки и самостоятельной функции желудочков — все имеет важное значение. Контроль настроек при ИВА, чтобы избежать высокого пикового давления на вдохе, поможет уменьшить ЛСС. Однако следует учитывать следующее. У хирургических пациентов, в отличие от терапевтических больных с инфарктом ПЖ, введение жидкости для улучшения функции ПЖ может быть полезно, но ограничения, связанные с повышением давления в ПП, более серьезные и могут приводить к быстрому ухудшению функции ЛЖ.
Поскольку правые полости сердца достаточно вместительные, может произойти значительное увеличение объема с незначительным увеличением давления в ПП, в результате произойдет смещение МЖП влево, что повлияет на наполнение ЛЖ. Инотропные препараты, улучшающие функцию желудочков, но снижающие давление в ЛА, являются важными лекарственными средствами, причем добутамин предпочтительнее допамина, а адреналин предпочтительнее норадреналина.
Могут быть полезны ингибиторы фосфодиэстеразы (в зависимости от системного давления). Они обычно улучшают сократимость желудочков и снижают давление в ЛА, а также имеют положительное люзитропное влияние на диастолическое расслабление. Однако они также могут снизить АД, что, как правило, является ограничивающим фактором в лечении тяжелой правожелудочковой недостаточности. Необходимо сочетание препаратов с тщательным подбором каждого. Использование ПГ-E1 в малых дозах будет иметь избирательное влияние на ЛСС с незначительными системными эффектами.
Инфузия препарата отдельно в правые полости (внутривенные вазодилататоры/инотропы) и в левые полости (инотропы/вазоконстрикторы в ЛП) — привлекательный метол, но он не был успешным у различных авторов из-за системного ответа на эти препараты, особенно при наличии СН. Исключением могут быть различные ингаляционные средства, например оксид азота, который в силу своего уникального пути введения и короткого периода полувыведения снижает ЛСС с незначительным влиянием на ОПСС и системное АД. К сожалению, это очень дорого и сложно в использовании (оксид азота следует надлежащим образом смешивать с кислородом, чтобы избежать токсичности). Эпопростенол (простациклин) — короткодействующий селективный легочный вазодилататор, который при ингаляционном введении снижает легочную постнагрузку с незначительным влиянием на системное давление. Илопрост, аналог простациклина, снижает ЛСС в течение 2 час также с незначительным влиянием на системное давление, если препарат вводят в виде аэрозоля.
3. Механическая поддержка кровообращения. Чтобы стабилизировать пациентов с высоким риском ИБС, включая больных с рецидивирующей ишемией и нестабильным коронарным кровотоком, тяжелой дисфункцией ЛЖ, такими механическими осложнениями ИМ, как разрыв МЖП или острая митральная регургитация, можно использовать до операции внутриаортальную баллонную контрпульсацию. Показанием к ней после операции является постоянный низкий СВ или гипотензия, несмотря на адекватные дозы инотропных препаратов. Как только функция сердца улучшится, перед удалением баллона лекарственную поддержку следует уменьшить и поддерживать на низком уровне.
Для краткосрочной поддержки при недостаточности максимальной лекарственной терапии и внутриаортальной баллонной контрпульсации также можно использовать экстракорпоральную мембранную оксигенацию и устройства поддержки желудочков.
в) Послеоперационная гипертензия. Послеоперационная гипертензия, определяемая как среднее АД 105 мм рт. ст., увеличение на 20 мм рт. ст. от исходного уровня или систолическое давление > 140 мм рт. ст., — обычное явление после большинства операций на сердце. Послеоперационная гипертензия тяжелой степени чаще всего наблюдается после хирургии клапанов, особенно после коррекции аортального стеноза. Пациенты с гипертензией до операции и те, кто принимал до операции β-блокаторы, более склонны к послеоперационной гипертензии. Поскольку такая гипертензия развивается рано (в течение 1-2 час после операции), существует риск повреждения артериального анастомоза и кровотечения в средостение, ишемии миокарда, вызванной чрезмерной постнагрузкой, а в тяжелых случаях — развития инсульта. Целостность анастомозов из подкожной вены или внутренней грудной артерии также может быть нарушена.
Повышение уровня катехоламинов в сыворотке — этиологический фактор наряду с высокими значениями ренина, ангиотензина, вазопрессина и симпатической активности. Уровень адреналина максимально высокий в первые несколько часов после операции, но уровень норадреналина остается высоким в течение нескольких дней. Еще одним доказательством центральной роли, которую играет норадреналин, являются наблюдения пациентов с послеоперационной гипертензией, у которых уровень норадреналина был выше верхнего значения нормы в 2-7 раз, а уровень адреналина у некоторых из них был в пределах нормы, у остальных — незначительно повышен.
Часто наблюдаются нормальный или слегка сниженный СВ и значительно повышенное ОПСС. В связи с этим широко используют сосудорасширяющие препараты, чаще всего нитропруссид. Проблемой является чрезмерное снижение диастолического давления, приводящее к уменьшению коронарного кровотока и ишемии миокарда. В этой ситуации можно использовать нитроглицерин. Послеоперационная гипертензия может также отмечаться на фоне гипердинамической сердечно-сосудистой функции с синусовой тахикардией, нормальным или повышенным СВ и нормальным или слегка повышенным ОПСС. В данной ситуации препаратами выбора являются эсмолол и лабеталол, применяемые в виде постоянной инфузии.
г) Периоперационньш инфаркт миокарда. Острое ишемическое повреждение миокарда в первую очередь обусловлено неадекватной защитой миокарда во время процедуры. Поскольку во время пережатия аорты при выполнении КШ коронарный кровоток отсутствует, успех напрямую зависит от возможности снизить потребность миокарда в кислороде до незначительного уровня. Согласно базе данных STS, распространенность в США периоперационных ИМ в 2005 г. составила < 1,1%. Частоту рассчитывали по диагностическому критерию увеличения уровня КК-МВ (или КК) в 5 раз выше верхней границы нормы в течение < 24 час после операции, а если прошло > 24 час, то по одному из следующих критериев: эволюционной элевации сегмента ST; появлению нового зубца Q в двух и более смежных отведениях либо развитию БЛНПГ; повышению уровня КК-МВ по крайней мере в 3 раза выше верхней границы нормы. Клиническими факторами являются пожилой возраст, увеличенное время использования АИК, повышенное КДД в ЛЖ, нестабильная стенокардия и поражение ствола ЛКА.
У пациентов с периоперационным ИМ после операции появляется новый зубец Q, который сохраняется. Псевдозубцы Q, маскирующие ИМ нижней стенки, могут возникать при смещении электрической оси влево. Периоперационньш ИМ имеет неблагоприятное влияние на краткосрочную выживаемость, но есть разные сообщения о его влиянии на долгосрочную выживаемость и о других последствиях, связанных с уровнем ферментов.
Механизм развития ИМ через несколько дней или недель после вмешательства часто связан с тромбозом шунта. Показатели кардиоспецифичных ферментов с максимальным значением через несколько часов после операции позволяют предположить другой механизм высвобождения ферментов, чем при неадекватной защите миокарда и других операционных причинах. В одном докладе пороговое значение уровня тропонина I, равное 13 нг/мл, было единственным независимым предиктором и идентифицировало больных с высоким риском госпитальной смертности (9,5% vs 0,7%), но не влияло на смертность в последующие 2 года наблюдения.
Повышение КК-МВ > 40 нг/мл было связано с более высокой летальностью, но в течение 1 года эта зависимость не сохранялась. Считают, что КШ без АИК связано с меньшим высвобождением кардиоспецифичных ферментов и с отсутствием влияния на выживаемость в течение 1 года.
д) Постперикардиотомный синдром. Причина постперикардиотомного синдрома по-прежнему остается неясной. Высокие титры антикардиальных антител присутствуют практически во всех случаях, связанных с аутоиммунным ответом. Пусковым механизмом считают гемоперикард, травматический перикардит или денатурированный миокард. Engle и соавт. часто обнаруживали у всех пациентов с постперикардиотомным синдромом высокие титры антикардиальных антител, а также четырехкратное увеличение антител к аденовирусу или вирусу Coxsackie от В1 до В6, у 70% пациентов, что позволило предположить наличие иммунологических реакций, вызванных острой или скрытой вирусной инфекцией. Характерное сезонное (весна, лето) повышение заболеваемости перикардитом и наличие высоких титров антител известных возбудителей перикардита подтверждают связь с вирусами. Взрослые заболевают реже, чем дети, отмечается ассоциация с возрастом.
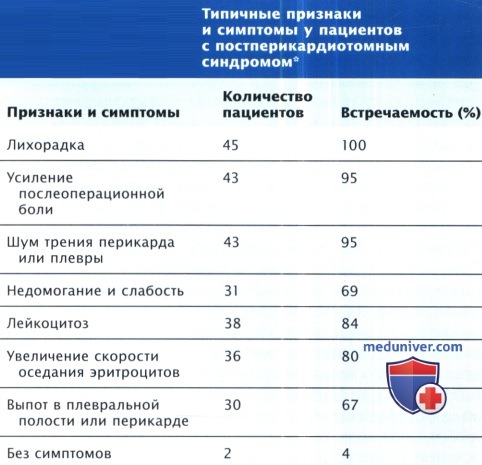
Признаки и симптомы варьируют: от невысокой лихорадки с лейкоцитозом или без него до выраженного поражения с перикардиальной и плевральной болью, миалгией и слабостью с лихорадкой до 40°С. Распространенными признаками наряду с выпотом являются шум трения перикарда, а зачастую и шум трения плевры.
Лейкоцитоз со сдвигом влево и повышенная СОЭ также обычны. В таблице ниже перечислены типичные признаки и симптомы и их относительная частота. Рентгенологические признаки кардиомегалии или плеврального выпота важны, но неспецифичны. ЭКГ может быть совершенно нормальной, возможна диффузная элевация сегмента ST, но изменения зубца Т не являются специфичными. На ЭКГ могут быть данные о небольшом перикардиальном выпоте, но они также неспецифичны.
Постперикардиотомньш синдром может появиться уже через 1 нед после операции, но в большинстве случаев — через 2-3 нед после операции (в срок до 2 мес). Наиболее серьезные последствия — перикардиальная констрикция, сужение шунтов, тампонада. Тампонада сама по себе явление редкое. Серозно-геморрагический экссудат в умеренном и даже большом количестве, обнаруженный с помощью ЭхоКГ, можно устранять консервативно, пока пациент остается стабильным без признаков тампонады.
Показана пероральная терапия преднизоном в дозе 70-80 мг/сут в течение 10-14 дней. На начальном этапе при очень умеренной симптоматике показано стационарное лечение. В частности, систолическое давление должно быть > 100 мм рт. ст.; пульсовое давление > 30 мм рт. ст., ЧСС <110 уд/мин. Пациента следует осматривать часто при наличии признаков парадоксального пульса или уменьшения выделения мочи. Дренирование перикарда показано, когда перечисленные показатели сопровождаются тампонадой, хотя, как отмечалось ранее, тампонада встречается редко. Перикардиоцентез создает дополнительные риски у больных с переднерасположенными шунтами. Жидкость может накапливаться локально, и, если нет доказательств на ЭхоКГ, что жидкость расположена спереди или вокруг верхушки сердца, устанавливать катетер не следует.
По этим причинам перикардиоцентез нужно выполнять в операционной или в условиях ОПТ под контролем ЭхоКГ и только опытным специалистам. Особое внимание необходимо уделять обработке кожи, чтобы избежать бактериального инфицирования.
В одном докладе подчеркивалось, что повторное накопление жидкости у детей встречается в 13% случаев, а среди взрослых достигает 50%. Показанием к «агрессивной» лекарственной терапии помимо облегчения симптомов является значительное количество окклюзий шунтов (с сужением и без него), вызванных постперикардиотомным синдромом.
е) Констриктивный перикардит. Констриктивный перикардит после открытой операции на сердце может развиться рано (в течение 2 нед после операции) или позднее, даже через несколько лет; в большинстве случаев заболевание диагностируют между 3 и 12 мес после операции. Признаки констриктивного перикардита подобны признакам констрикции, вызванной другими причинами: набухание шейных вен, периферические отеки, асцит и гепатоспленомегалия. В диагностике существенную роль играет ЭхоКГ, для окончательной диагностики может быть полезна КТ. Если констрикцию подозревают, но не могут подтвердить выравниванием диастолического давления, быстрая в/в инфузия жидкости может показать истинную гемодинамику. Большинству пациентов необходимо хирургическое вмешательство (ограниченная или радикальная перикардэктомия), хирургические результаты в целом благоприятные. После хирургического вмешательства пациентам в течение 2 мес нужна лекарственная терапия диуретиками и глюкокортикостероидами из-за высокой вероятности воспалительного процесса с менее выраженным фиброзным процессом.
Причинами констрикции могут быть постперикардиотомный синдром, введение в полость перикарда повидон-йода и последствия гемоперикарда.
ж) Периоперационные аритмии:
1. Наджелудочковые тахиаритмии. Частота предсердных тахиаритмий после КШ составляет 30% и увеличивается после операций на клапанах сердца.
ФП — наиболее частая аритмия (20-40%), развивающая ся между 3-м и 5-м послеоперационными днями. Нестабильность гемодинамики, системная эмболия, осложнения, связанные с антикоагуляцией, включая тампонаду перикарда, могут усложнить ведение таких пациентов. Независимыми предикторами ФП являются пожилой возраст, ФП в анамнезе, СД, длительность использования АИК и пережатия аорты, неадекватная защита предсердий во время пережатия аорты, послеоперационное повышение адреналина и норадреналина, высокие дозы НПВС в послеоперационном периоде. Метаанализ 14 исследований (16 505 пациентов) показал более низкую частоту ФП (19%) при КШ без АИК, чем при КШ с АИК (24%), в т.ч. среди пожилых. Подобные аритмии, но с меньшей частотой также наблюдаются у пациентов, переносящих некардиальные торакальные хирургические вмешательства.
Отсутствуют успешные профилактические стратегии по решению проблемы послеоперационной ФП, самые успешные подходы снижали частоту случаев на 50%. Эффективным может быть соталол, однако он обладает отрицательным инотропным эффектом и может приводить к удлинению интервала QT и развитию полиморфной ЖТ, включая тахикардию torsades de pointes. Амиодарон эффективен, если его назначают перед операцией, интраоперационно и после операции. Эффективной также была биатриальная стимуляция, если ее проводили в течение 3 сут после операции.
Лечение ФП начинают с контроля ЧСС. Быстрым эффектом с 50% вероятностью восстановления синусового ритма обладают метопролол и эсмолол, доступные для в/в введения. Дилтиазем влияет на ЧСС и кардиоверсию в меньшей степени, ассоциируется с гипотензией, которой можно избежать при в/в введении кальция хлорида в дозе 1 г. При комбинации β-блокаторов и антагонистов кальция есть вероятность развития полной АВ-блокады, поэтому электрод для стимуляции должен быть установлен заранее и подключен к ЭКС. В одном исследовании 640 пациентов, перенесших КШ, амиодарон и ранняя электрическая кардиоверсия более эффективно восстанавливали синусовый ритм, чем терапия другим препаратом (не амиодароном).
Дигоксин не является профилактическим препаратом первой линии, но его можно использовать в/в в низких дозах ежедневно, чтобы усиливать эффекты p-блокаторов. Другие препараты быстрой фармакологической кардиоверсии — прокаинамид, пропафенон, ибутилид, дофетилид. Два последних препарата полезны, когда отрицательного инотропного эффекта нужно избежать или в случае развития бронхоспазма после приема β-блокаторов. Оба препарата удлиняют интервал QT и обладают проарит-могенными свойствами, поэтому должны быть отменены сразу после восстановления синусового ритма. Пациенты с новыми пароксизмами ФП после КШ и восстановленным синусовым ритмом до выписки из стационара имеют доброкачественное течение болезни. У таких пациентов антиаритмическую терапию можно продолжать в течение 1 нед.
Низкоэнергетичная кардиоверсия с помощью биатриальных эпикардиальных электродов, имплантированных во время операции, является эффективным и безопасным методом для пациентов в сознании. Сверхчастая стимуляция с помощью вре'менных эпикардиальных электродов, имплантированных во время операции, весьма эффективна, если основной ритм — ТП или пароксизмальная наджелудочковая тахикардия. Если тип аритмии не ясен, может быть чрезвычайно полезной электрограмма предсердий. Биполярные электрограммы регистрируют путем присоединения с помощью зажимов типа «крокодил» каждого из эпикардиальных электродов к двум отведениям ЭКГ-кабеля от рук пациента. При выборе на электрокардиографе записи стандартного отведения I регистрируется биполярная электрограмма предсердий. Монополярную запись выполняют путем присоединения предсердного электрода к прекордиальному электроду монитора.
Если есть какие-либо признаки организованной регулярной деполяризации ЛП, показана сверхчастая стимуляция. Начиная с частоты ТП с максимальной амплитудой, частоту стимуляции медленно увеличивают на 10 с тимулов до входа в цикл тахикардии. Невозможность восстановления ритма может быть обусловлена рядом факторов, в т.ч. нарушением целостности электрода или потерей контакта электрода с эпикардиальной поверхностью. Если поврежден только один электрод, возможна монополярная стимуляция при использовании оставшегося функционирующего электрода в качестве отрицательного полюса и близко расположенного накожного электрода в качестве другого электрода. Порог захвата может стать выше уровня доступных стимуляционных единиц (как правило, 20 мА), в некоторых случаях повторные попытки могут быть успешными после применения антиаритмических препаратов. Иногда предсердная стимуляция трансформирует ТП в ФП. Поскольку частота сокращений желудочков ниже, чем у предсердий, и желудочки более восприимчивы к отрицательным хронотропным препаратам, этот ритм обычно предпочтительнее.
Частая предсердная стимуляция не может восстановить синусовый ритм и способна привести к АВ-блокаде высоких градаций, но в результате возможен более контролируемый ответ желудочков, несмотря на сохраняющееся ТП. Антикоагулянтную терапию гепарином следует рассматривать для пациентов, у которых синусовый ритм не удалось восстановить в течение 24 час (или раньше, если в анамнезе есть указания на предсердную тахиаритмию). Кардиоверсия показана больным с острой гемодинамической нестабильностью. При выполнении седации желательно участие анестезиолога, если это возможно. Для плановой кардиоверсии переднезаднее расположение электродов (с расположением заднего электрода по нижнему углу лопатки) является предпочтительным.
2. Желудочковые аритмии. Желудочковая эктопия, в т.ч. неустойчивая ЖТ, для устранения которой был необходим, по крайней мере, короткий курс терапии, возникала у 50% пациентов чаще всего между 3-м и 5-м послеоперационными днями. Возможные механизмы — высокие концентрации циркулирующих катехоламинов, клинический или субклинический некроз миокарда и электролитные нарушения. Сообщения о клиническом значении желудочковой эктопии прот иворечат друг другу. В одних исследованиях показано, что даже одиночные желудочковые экстрасистолы в покое прогнозируют неблагоприятный исход после шунтирования, в других, более поздних исследованиях не обнаружено разницы в показателях выживаемости при наличии или отсутствии тяжелой желудочковой эктопии, выявленной во время амбулаторного мониторирования популяции тщательно отобранных пациентов после шунтирования с нормальной дооперационной функцией желудочков. До получения более точных данных терапия должна быть индивидуальной, основанной на известных или предполагаемых ФР, в частности функции ЛЖ и данных анамнеза пациента.
Первоначальный подход заключается в использовании предсердной стимуляции, которая нередко снижает эктопию без применения лекарственных средств. Использование прокаинамида для подавления простой желудочковой эктопии является общепринятой тактикой. Для неустойчивой ЖТ обычно используют препараты магния и амиодарон. Для устойчивой ЖТ применяют сверхчастую стимуляцию, кардиоверсию или в/в введение амиодарона.
3. Нарушение проводимости. Полная АВ-блокада, как и нарушение АВ-проведения, может быть вызвана неполным вымыванием кардиоплегического раствора, действием антиаритмических препаратов или их токсическим эффектом. Если АВ-блокада — специфический результат хирургического вмешательства, то она наиболее часто наблюдается при протезировании АК и может быть транзиторной. Если блокада связана с травмой или манипуляциями в области АВ-узла либо пучка Тиса, она может быть временной (часто длится несколько дней). Хирургическое рассечение узла во время протезирования АК — хорошо известное осложнение, приводящее к постоянной АВ-блокаде.
АВ-блокада различной степени после протезирования АК является более распространенным нарушением, чем при других видах сердечно-сосудистых вмешательств, поскольку из-за близости пучка Еиса существует опасная зона в области некоронарной створки и прилегающей к ней части правой коронарной артерии выше перехода мембранозной и мышечной перегородки. Удаление кальцификатов или наложение шва в этой зоне с большей вероятностью приводит к полной блокаде сердца. Устранение полной АВ-блокады сердца возможно после успешного протезирования АК в 29% случаев в срок до 18 мес после операции. Показана элиминация препаратов, которые потенциально могут способствовать нарушению АВ-проводимости, а необходимость стимуляции зависит от адекватности сердцебиения и возможности восстановления проводимости.
Факторы, позволяющие усомниться в возможности восстановления и свидетельствующие о необходимости постоянной ЭКС, включают тяжелый кальциноз АВ-узла или кольца АК с распространением на перегородку, развитие АВ-блокады через несколько часов или дней после операции и дооперационное нарушение проводимости (в меньшей степени). При отсутствии избыточного кальциноза можно подождать восстановления до 10 дней перед имплантацией постоянного электрокардиостимулятора.
Широко используют хирургически установленные эпикардиальные электроды для кардиостимуляции. Парно размещенные электроды на ПП и ПЖ повышают диагностические возможности и позволяют проводить ЭКС при всех видах брадикардии и выполнять сверхчастую ЭКС. Электроды должны быть чистыми, сухими, электрически изолированными.
Удаляют электроды обычно за день до выписки из стационара, аккуратно вытягивая их. Сопротивление можно преодолеть, разместив на электроде нетяжелый груз. У пациентов, получавших варфарин, МНО должно быть снижено до нормальных значений (1,5). Пациенту показан постельный режим в течение 2 час после удаления электродов. В редких случаях, когда удаление электродов невозможно, их максимально вытягивают и обрезают ближе к коже. Оставлять электроды неудаленными, безусловно, нежелательно, т.к. это может привести к развитию хронического или рецидивирующего свища.
- Читать "Легочные болезни после операции на сердце"
Редактор: Искандер Милевски. Дата публикации: 12.2.2019
- Оценка риска операции на сердце (кардиохирургического вмешательства)
- Риски операции на сердце при сопутствующих заболеваниях и беременности
- Оценка риска кардиохирургических вмешательств по шкале EuroSCORE
- Этапы восстановления органов и систем после операции на сердце
- Лечение боли в груди после операции на сердце
- Лекарства после операции на сердце
- Сердечно-сосудистые заболевания после операции на сердце
- Легочные болезни после операции на сердце
- Кровотечение после операции на сердце
- Нарушение функции почек после операции на сердце
