Выявление и определение количества анаэробных микроорганизмов в пищевых продуктах
ГОСТ 29185-91 Продукты пищевые. Методы выявления и определения количества сульфитредуцирующих клостридий.
ГОСТ 7702.2.6-93 Мясо птицы, субпродукты и полуфабрикаты птичьи. Методы выявления и определения количества сульфитредуцирующих клостридий;
ГОСТ 9958-81 Колбасные изделия и продукты из мяса. Методы бактериологического анализа.
ГОСТ 10444.9-88 Продукты пищевые. Метод определения Clostridium perfingens;
ГОСТ 30425-97 Консервы. Метод определения промышленной стерильности.
а) Способы культивирования посевов в анаэробных условиях при использовании жидких сред. При выявлении анаэробных микроорганизмов в обычных атмосферных условиях заданное значение окислительно-восстановительного потенциала жидкой среды можно поддерживать разными способами:
• внесение в среду редуцирующих веществ (кусочки печени или мяса, не содержащие ингибиторов развития микроорганизмов, тиогликолевая кислота, цистин, глюкоза, аскорбиновая кислота);
• повышение вязкости среды за счет добавления в нее 0,05-0,10 % агара;
• наслаивание на поверхность среды веществ, защищающих среду от проникновения в нее кислорода (парафиновазелиновая смесь, вазелиновое масло, голодный агар и др.); причем слой таких веществ должен составлять около 2 см.
Посевной материал вносят в пробирки с жидкой (или вязкой) средой сразу же после регенерации среды (удаления из нее кислорода). Для этого пробирки прогревают на кипящей водяной бане в течение 10-15 мин и затем быстро охлаждают под струей холодной водопроводной воды до температуры 40(± 1) °С (при выявлении мезофильных микроорганизмов) или до 55-62 °С (при выявлении термофильных микроорганизмов).
б) Способы культивирования посевов в чашках Петри в анаэробных условиях. Широко распространен метод посева анаэробов под стекло. Для этого микроорганизмы засевают в чашку Петри глубинным способом (высота слоя среды в чашке должна быть не менее 0,8 см). На застывшую и подсушенную поверхность среды пинцетом помещают предметное стерильное стекло так, чтобы под стеклом не было пузырьков воздуха. Чашку в перевернутом виде помещают в термостат. При таком способе посева анаэробные микроорганизмы наиболее обильно растут под центральной частью предметного стекла (на расстоянии 1-3 мм от края) сплошной массой или в виде отдельных колоний, часто образуя пузырьки газа и (или) разрывы агара.
Посевы в чашках Петри можно культивировать в анаэростатах с разрежением 0,6-0,8 атм |(0,4-0,6)×105 Па]. Анаэростаты часто снабжены специальными препаратами, поглощающими кислород за счет реагирования его с водородом, выделяющимся при увлажнении препарата водой в присутствии платины, палладия и других катализаторов. Этот способ особенно подходит для культивирования строгих анаэробов.
Для создания анаэробных условий за счет химического поглощения кислорода воздуха в герметичных сосудах применяют щелочной раствор пирогаллола. Для этого после помещения посевов в сосуд готовят смесь [для поглощения кислорода из 100см3 воздуха достаточно 1 г пирогаллола и 10 см3 раствора NaOH (2,5 моль/дм3)] и непосредственно перед герметизацией вносят ее в сосуд.
Посевы можно также культивировать в герметичных специальных емкостях, заполняемых инертным газом (азотом, водородом или гелием) либо смесью (80% азота, 10% углекислого газа и 10% водорода). Отсутствие кислорода в емкости устанавливают при помощи индикатора окислительно-восстановительного потенциала среды (метиленовый синий, резазурин и др.).
Для создания анаэробных условий непосредственно в чашках с посевами на внутреннюю поверхность крышки при помощи липкой бумаги прикрепляют бумажный пакет 4x7 см, содержащий 2 г сухой смеси, состоящей из пирогаллола, карбоната калия и талька в соотношении 3:3:15. Затем чашку Петри герметизируют, смазывая края крышки пластилином или другими герметизирующими материалами.
Можно использовать способ Фортнера: одну половину чашки Петри с агаризованной средой засевают исследуемым материалом, а другую — бактериями, очень активно поглощающими кислород (например, Serratia marcescens). Затем чашку Петри герметизируют пластилином.
в) Подготовка проб для определения количества спор сульфитредуцирующих клостридий. Если необходимо определить количество спор сульфитредуцирующих клостридий, то навеску продукта (или его исходное разведение) перед посевом (или приготовлением десятикратных разведений) подвергают пастеризации. Для этого 50 см3 жидкого продукта (или исходного разведения) аккуратно, не размазывая по стенкам, помещают в стерильную колбу емкостью 100 см3. Затем эту колбу переносят в нагретую до 80(±1)°С водяную баню. При этом следует следить, чтобы уровень жидкости в колбе был на 2-3 см ниже уровня воды в бане. Одновременно в водяную баню помещают точно такую же контрольную колбу, также содержащую 50 см3 продукта (или исходного разведения) и термометр. Как только содержимое колбы достигнет температуры 80(±1)°С начинают отсчитывать время прогревания (20 мин). По окончании прогревания колбу немедленно охлаждают под струей водопроводной воды. Для выявления и определения количества спор в дальнейшем в зависимости от целей исследования выбирают один из описанных ниже методов.
г) Выявление сульфитредуцирующих клостридий в определенном количестве продукта. Для выявления присутствия (отсутствия) сульфитредуцирующих клостридий в определенном количестве продукта навеску продукта или его эквивалентное разведение вносят в одну из вязких питательных сред (железосульфитная среда, дифференциальная улучшенная клостридиальная среда, вязкая среда Вильсон-Блера). При этом соотношение между количеством посевного материала и питательной средой должно составлять 1:9. Посевы культивируют при 37(±1)°С не более 72 ч.
Просмотр посевов осуществляют ежедневно. Отбирают пробирки с признаками роста (наличие отдельных черных колоний или полностью почерневшая питательная среда на глубине более 1 см). Из положительных посевов культуры пересевают истощающим штрихом на поверхность плотной селективно-диагностической среды в чашках Петри (триптозо-сульфит-циклосериновый агар или плотная дифференциальная улучшенная клостридиальная среда либо агаризованная среда Вильсон — Блера). Посевы инкубируют в анаэробных условиях при 37(±1)°С в течение 24-48 ч.
Отмечают наличие характерных колоний — овальных черных или окруженных черным либо серым ореолом колоний диаметром 4-5 мм. Для дальнейшего изучения отбирают не менее 5 таких колоний, которые пересевают в свеже-регенерированную среду Китт-Тароцци. Посевы культивируют при 37(±1)°С не более 48 ч.
Выросшие культуры используют для подтверждения принадлежности выделенных сульфитредуцирующих микроорганизмов к роду Clostridium. Для этого микроорганизмы окрашивают по Граму, выявляют эндоспоры, определяют наличие каталазы и проводят подтверждение анаэробного роста (или отсутствия роста в аэробных условиях).
Из каждой выделенной культуры готовят два мазка: один окрашивают по Граму, второй—для выявления эндоспор. Сульфитредуцирующие клостридии представляют собой короткие толстые грамположительные палочки с закругленными концами. В мазках расположены одиночно, попарно, в виде цепочек или штакетообразных (параллельно друг к другу) скоплений. Образуют овальные или круглые эндоспоры, расположенные терминально и субтерминально.
Для выявления наличия каталазы используют культуры не старше 24 ч. Из посевов отбирают 2-3 см3 культуральной жидкости, переносят ее в пробирку и нейтрализуют растворами гидроокиси натрия или соляной кислоты. Затем 1-2 капли нейтрализованной культуральной жидкости помещают обезжиренной пипеткой на профламбированное и охлажденное до комнатной температуры предметное стекло, после 30 мин выдержки на воздухе наносят на нее пипеткой каплю 3% раствора перекиси водорода. Если через 30-60 с на стекле появляются пузырьки газа, то считают, что микроорганизмы образуют каталазу. Сульфитредуцирующие клостридии каталазу не образуют.
Для подтверждения анаэробного роста анализируемые культуры пересевают на одну из вышеперечисленных агаризованных сред в чашки Петри под стекло или в трубки Вейона. Посевы инкубируют в анаэробных условиях при 37(±1)°С в течение 18-72 ч. Для сульфитредуцирующих клостридий характерен анаэробный рост.
Вместо подтверждения анаэробного роста можно проводить определение отсутствия роста в аэробных условиях. Для этого изучаемые культуры высевают на поверхность одной из вышеперечисленных агаризованных сред в чашках Петри. Посевы инкубируют в аэробных условиях при 37(±1)°С в течение 18-72 ч. Сульфитредуцирующие клостридии в аэробных условиях не растут.
Таким образом, к сульфитредуцирующим клостридиям относят сульфитредуцирующие грамположительные каталазоотрицательные, способные расти в анаэробных условиях (не способные расти в аэробных условиях) микроорганизмы.
Посевы считают положительными (т. е. сульфитредуцирующие клостридии выявлены в анализируемой навеске продукта), если при подтверждении характерных колоний хотя бы одна из них была отнесена к сульфитредуцирующим клостридиям.
д) Определение количества сульфитредуцирующих клостридий методом посева в агаризованную среду. Метод используют для пищевых продуктов, содержащих в 1 г более 150 или в 1 см3 более 15 сульфитредуцирующих клостридий.
По 1 см3 продукта или его разведения вносят в две чашки Петри. Не позднее чем через 15 мин посевы заливают 15-20 см3 расплавленной и охлажденной до 45(±1)°С агаризованной среды (триптозо-сульфит-циклосериновый агар или плотная дифференциальная улучшенная клостридиальная среда либо агаризованная среда Вильсон-Блера). Содержимое чашек немедленно осторожно перемешивают круговыми движениями. После застывания среды в чашки вливают еще по 10 см3 голодного агара. Засеянные чашки с застывшей средой переворачивают и инкубируют в анаэробных условиях при 37(±1)°С не более 72 ч.
В дальнейшем выявляют характерные колонии (для подсчета выбирают чашки, на которых выросло от 15 до 150 характерных колоний), отбирают не менее пяти таких колоний и подтверждают их принадлежность к сульфитредуцирующим клостридиям, как описано в отдельной статье. Если при подтверждении характерных колоний не менее четырех из выбранных пяти колоний (т. е. не менее 80%) можно отнести к сульфитредуцирующим клостридиям, то считают, что все характерные колонии на чашке Петри принадлежат сульфитредуцирующим клостридиям. В остальных случаях количество сульфитредуцирующих клостридий определяют исходя из процентного отношения подтвержденных колоний к общему количеству характерных колоний, взятых для подтверждения.
Пересчет количества сульфитредуцирующих клостридий на 1 г (см3) продукта осуществляют по формуле:
M = NC/m,
где М — количество микроорганизмов в 1 г (см3) продукта;
N — степень разведения навески;
m — количество инокулята, внесенное для посева в чашку Петри;
С — округленное среднеарифметическое значение числа колоний.
Конечный результат вычисления выражают числом от 1,0 до 9,9x10n.
е) Определение количества сульфитредуцирующих клостридий методом НВЧ. Метод используют для пищевых продуктов, содержащих в 1 г менее 150, но в 10 г более 3 или в 1 см3 менее 15, но в 100 см3 более 3 сульфитредуцирующих клостридий.
Высевают три последовательные навески продукта и (или) его разведения, отличающиеся по количеству продукта в 10 раз. Каждую навеску и (или) раз-ведение в трехкратной повторности высевают в пробирки с одной из вязких питательных сред (железосульфитная среда, дифференциальная улучшенная клостридиальная среда, вязкая среда Вильсон-Блера). В ряде случаев используют жидкую среду Китт-Тароцци (при анализе мяса птицы, субпродуктов и полуфабрикатов птичьих). При этом соотношение между инокулятом и питательной средой должно составлять 1:9. Посевы культивируют при 37(±1)°С не более 72 ч.
Затем осуществляют пересев на агаризованные селективно-диагностические среды и подтверждение характерных колоний. Посев считают положительным, если при подтверждении характерных колоний хотя бы одна из них была отнесена к сульфитредуцирующим клостридиям. НВЧ сульфитредуцирующих клостридий в 1 г (1 см3) продукта рассчитывают пользуясь таблицей ниже.
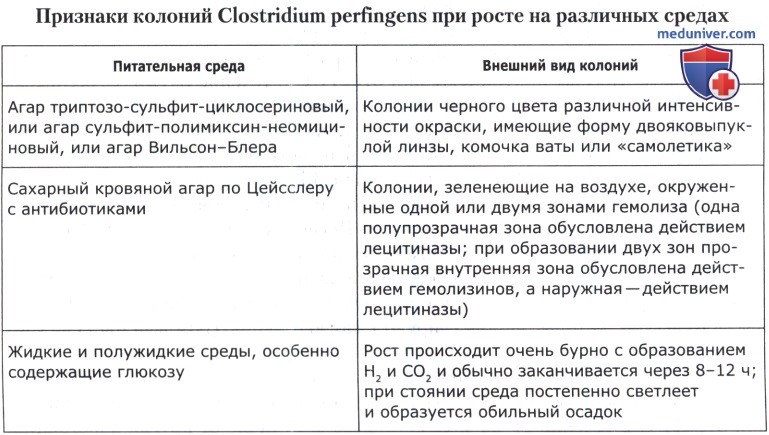
ж) Определение Clostridium perfingers. По 1 см3 продукта (или его разведения) или разведения культуральной жидкости вносят в две параллельные стерильные чашки Петри. Не позднее, чем через 15 мин посевы заливают 15-20 см3 расплавленной и охлажденной до 45(±1)°С агаризованной среды (триптозо-сульфит-циклосериновый агар, или сахарный кровяной агар по Цейсслеру, или агаризованная среда Вильсон-Блера). Содержимое чашек немедленно осторожно перемешивают круговыми движениями. После застывания среды чашки подсушивают и заливают той же средой так, чтобы высота второго слоя питательной среды была не менее 4 мм. Засеянные чашки с застывшей средой переворачивают и инкубируют в анаэробных условиях при 37(±1)°С в течение 18-24 ч.
Выявляют характерные колонии и отбирают для подсчета те чашки, на которых выросло от 15 до 150 таких колоний. Для подтверждения принадлежности выделенных колоний к С. perfingens отбирают не менее 5 характерных колоний и пересевают их в жидкую или вязкую среду (среда Китт-Тароцци, железосульфитная среда, дифференциальная улучшенная клостридиальная среда, вязкая среда Вильсон-Блера). Посевы инкубируют при 37(±1)°С в течение 18-24 ч. Культуральную жидкость используют для изучения морфологических и биохимических свойств микроорганизмов.
Из посевов готовят мазки и окрашивают их по Граму. С. perfingens представляет собой короткие толстые грамположительные палочки с закругленными концами (0,9—1,3 х 3,0—9,0 мкм). В посевах не образуют либо плохо образуют споры (овальные или круглые эндоспоры, обычно расположенные субтерминально). В мазках расположены одиночно, попарно, в виде цепочек или штакетообразных (параллельно друг к другу) скоплений.
Наличие каталазы определяют как описано в отдельной статье на сайте. С. perfingens не образует каталазу.
Затем у выделенных культур исследуют характер роста на лакмусовом молоке (энтеритный тест), выявляют подвижность, способность к восстановлению нитратов, ферментации лактозы и разжижению желатины.
Для проведения энтеритного теста культуры высевают в пробирки с лакмусовым молоком. Посевы инкубируют при 37(±1)°С в течение 8-12 ч. С. perfingens вызывает бурную ферментацию лактозы с образованием газа, редукцию лакмуса, коагуляцию молока с последующим его свертыванием и образованием губчатого сгустка красновато-сиреневого цвета в верхней части пробирки и просветлением сыворотки (за 8-12 ч при 37 °С или за 3-5 ч при 45 °С).
Для изучения подвижности и восстановления нитратов культуры высевают уколом в полужидкую питательную среду. Посевы культивируют при 37(±1)°С в течение 24 ч. С. perfingens неподвижен (растет только по линии посева и не вызывает помутнения всей среды). После учета подвижности в пробирку вносят реактив на нитриты. С. perfingens дает сильную и немедленную реакцию (красный цвет). Культуры, которые демонстрируют слабую реакцию (розовый цвет) не учитывают.
Для определения способности к ферментации лактозы и к разжижению желатина культуры высевают уколом в желатин-лактозную среду. Посевы инкубируют при 37(±1)°С в течение 18-24 ч. С. Perfingens, в отличие от других клостридий, сбраживает лактозу (среда окрашивается в желтый цвет, в толще среды появляются пузырьки газа). После учета ферментации лактозы посевы выдерживают 1 ч при температуре 4(±2)°С. Если среда вновь не застыла, то это свидетельствует о гидролизе желатина. Если среда сохраняет вязкость, то посевы вновь инкубируют 24 ч при 37(±1) °С, затем охлаждают при 4(±2) °С и делают окончательный вывод о способности анализируемой культуры к гидролизу желатина. С. Perfingens, как правило, разжижает желатин.
Для изучения подвижности, редукции нитратов и разжижения желатина можно воспользоваться другим способом. 6-8-часовые культуры, выращенные на жидкой (вязкой) среде, высевают в среду Роберта. Непосредственно перед посевом среду прогревают 20 мин на кипящей водяной бане и затем охлаждают до застывания в холодильнике. Посевы инкубируют при 37(±1)°С в течение 24 ч, затем помещают в холодильник (2-4 °С) на 20 мин. С. perfingens при росте на среде Роберта образует прямую (вследствие неподвижности клеток) красную (вследствие наличия нитратов и появления нитритов) линию, как правило, превращая среду в желеобразное состояние, — среда не затвердевает в холодильнике (вследствие разжижения желатина).
Если при исследовании характерных колоний, выделенных на селективно-диагностических средах, обнаружены неподвижные грамположительные каталазоотрицательные палочки, дающие характерный рост на лакмусовом молоке, редуцирующие нитраты, ферментирующие лактозу и разжижающие желатин, то делают вывод, что обнаруженные микроорганизмы относятся к С. perfingens.
Если на чашках Петри обнаружено более 150 характерных подтвержденных колоний, то результат можно выразить так: количество С. perfingens в 1 г (см3) более 1,5×10n+2, где n — использованное для посева разведение продукта.
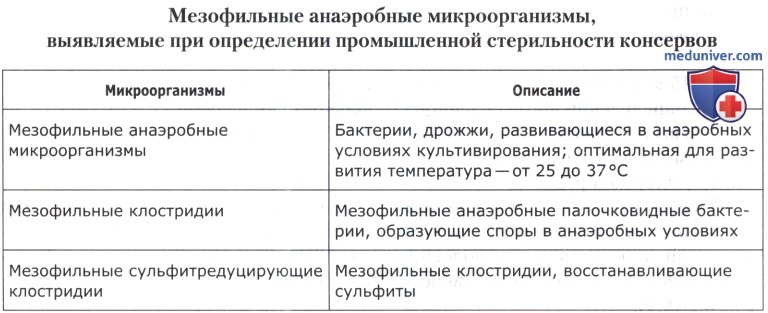
е) Выявление мезофильных анаэробных микроорганизмов при определении промышленной стерильности консервов. Для выявления жизнеспособных мезофильных анаэробных микроорганизмов на дно каждой из двух пробирок со свежерегенерированной средой (среда Китт-Тароцци или, при анализе кислотных консервов, среда Китт-Тароцци со щепоткой углекислого кальция) вносят по 1,0(±0,1) г или 1,0(±0,1) см3 консервированного продукта. Если исследуют консервы для диетического или детского питания, то их засевают в высокие пробирки, содержащие около 30 см3 питательной среды, по 5,0(±0,1) г или 5,0(±0,1) см3 продукта. Высота слоя среды с внесенным продуктом в обычных пробирках должна быть 10-11 см, а в высоких— 14-15 см. Сразу же после посева на поверхность жидкой питательной среды наслаивают голодный агар, парафиновую смесь или вазелиновое масло (если среда приготовлена без вазелинового масла) так, чтобы образовался слой высотой около 2 см. Можно использовать для посева свежеприготовленные питательные среды без наслаивания вазелинового масла или парафиновой смеси (вазелиновое масло тормозит развитие анаэробных микроорганизмов при пересеве их с жидкой среды на агаризованную).
Посевы термостатируют при температуре 30(+1)°С до появления видимых признаков роста, но не менее 5 сут. При этом ежедневно наблюдают за проявлением признаков развития микроорганизмов (помутнение среды, образование газа, осадка). По мере необходимости из посевов отбирают культуральную жидкость для определения морфологии клеток, наличия спор, выявления отношения к окраске по Граму и каталазной активности.
Присутствие анаэробных микроорганизмов определяют путем пересева культуральной жидкости.
Для выявления сульфитредуцирующей способности и подтверждения анаэробного роста выделенных микроорганизмов 1-2 капли культуральной жидкости (или ее разведений) вносят в чашку Петри и заливают средой Вильсон-Блера. Содержимое чашки тщательно перемешивают. Посевы культивируют в анаэробных условиях (либо производят посев под стекло), как описано в отдельной статье на сайте, при 37(±1) °С не более 72 ч. Сульфитредуцирующие микроорганизмы образуют черные, коричневые колонии или вызывают потемнение среды. Можно также использовать посев в пробирки в высокий столбик среды (10-11 см). Такие посевы культивируют в обычных неанаэробных условиях. Анаэробные микроорганизмы растут в высоких столбиках среды на некотором расстоянии от поверхности среды.
Для выявления способности к спорообразованию в анаэробных условиях производят посев культуральной жидкости на жидкую (вязкую) среду (среда КиттТароцци, железосульфитная среда, дифференциальная улучшенная клостридиальная среда, вязкая среда Вильсон-Блера). При выборе сред учитывают, что некоторые сахаролитические клостридии не образуют спор при отсутствии ферментируемых сахаров, но для спорообразования большинства других видов среда не должна содержать ферментируемые сахара. Лучшими средами для спорообразования являются среды, приготовленные на основе мясного бульона с кусочками мяса или сердца. При сомнении в наличии спор их образование стимулируют прогревом вторичных посевов (10 мин при 80(±1)°С для термоустойчивых клостридий или 10 мин при 60(±1)°С для нетермоустойчивых клостридий. Посевы для наблюдения за спорообразованием культивируют не более 48 ч при температуре 30(±1)°С и затем выдерживают не более трех суток при 20-25°С. Для обнаружения спор готовят мазки, окрашивают их соответствующим способом и микроскопируют.
Принадлежность микроорганизмов к мезофильным клостридиям устанавливают по культуральным признакам, газообразованию, сульфитредуцирующей способности, способности к спорообразованию в анаэробных условиях, положительной окраске по Граму, отсутствию каталазы. Если требуется, количество мезофильных анаэробных микроорганизмов определяют методом НВЧ. При необходимости устанавливают отсутствие Clostridium perfingens и С. botulinum соответствующими методами.
При необходимости подтверждения присутствия в консервах мезофильных клостридий в споровой форме посевы прогревают на водяной бане в течение 20 мин при температуре 80(±1)°С. Затем посевы немедленно охлаждают в струе водопроводной воды и культивируют, как описано выше.
ж) Выявление термофильных анаэробных микроорганизмов при определении промышленной стерильности консервов. Посевы производят в среду Китт-Тароцци. Термофильные анаэробные микроорганизмы в консервах детского и диетического питания выявляют в 2,0(±0,1)г или 2,0(±0,1) см3 продукта.
Посевы термостатируют при температуре 55-62 °С до появления видимых признаков роста, но не менее 3 сут. Из посевов отбирают культуральную жидкость для определения морфологии клеток, наличия спор, окраски по Граму и определения каталазной активности (метод выявления каталазы описан в отдельной статье на сайте).
Принадлежность к термофильным анаэробным микроорганизмам устанавливают по культуральным особенностям развития, газообразованию, сульфатредуцирующей активности, способности к спорообразованию в анаэробных условиях, морфологии клеток, отношению к окраске по Граму, каталазной активности.
При подозрении на присутствие в посевах термофильных сульфатредуцирующих бактерий (Desulfotomaculum nigrifleans) для пересевов используют молочно-сульфатную среду или среды, содержащие сульфиты. Посевы культивируют при 55-62 °С в течение 48 ч. D. Nigrificans вызывает почернение сред, содержащих сульфиты или сульфаты.
Спорообразующие клостридии образуют большое количество газа на среде с глюкозой.
Если требуется подтверждение присутствия в консервах термофильных клостридий в споровой форме, посевы прогревают на водяной бане в течение 20 мин при температуре 95(±1)°С. Затем посевы немедленно охлаждают в струе водопроводной воды и культивируют, как описано выше.

- Читать далее "Выявление и определение количества энтерококков (Enterococcus faecalis, Е. faecium, Е. avium, Е. gallinarum) в пищевых продуктах"
Редактор: Искандер Милевски. Дата публикации: 14.10.2019
- Выявление бактерий рода Salmonella в пищевых продуктах
- Выявление и определение количества Staphylococcus aureus в пищевых продуктах
- Выявление и определение количества анаэробных микроорганизмов в пищевых продуктах
- Выявление и определение количества энтерококков (Enterococcus faecalis, Е. faecium, Е. avium, Е. gallinarum) в пищевых продуктах
- Выявление бактерий рода Proteus в пищевых продуктах
- Определение Bacillus cereus в пищевых продуктах
- Определение молочно-кислых микроорганизмов в пищевых продуктах
- Выявление Listeria monocytogenes в пищевых продуктах
- Выявление парагемолитических вибрионов в пищевых продуктах
- Определение промышленной стерильности консервов
