Выявление Listeria monocytogenes в пищевых продуктах
а) Предварительное обогащение. Подготовленную для исследования навеску исследуемого продукта (гомогената, смыва с поверхности) вносят в среду для первичного обогащения (бульон Фрейзера для первичного обогащения или подобная среда). Обычно для посева берут 25 г (см3) продукта или 50-100 г (см3) продуктов детского, лечебного и специализированного питания. Соотношение между инокулятом и питательной средой при посеве должно составлять 1:9 по объему. Посевы термостатируют при 37(±1)°С в течение 24(±2) ч. При росте листерий на средах, содержащих эскулин и цитрат железа аммонийного, наблюдается почернение среды. Развитие листерий приводит к гидролизу гликозида эскулина до глюкозы и эскулетина. Эскулетин затем реагирует с ионами железа, образуя комплекс черного или оливкового цвета. На других средах почернения не наблюдается.
Для проведения вторичного обогащения 0,1 см3 культуры, полученной в результате первичного обогащения, пересевают в 10 см3 жидкой среды (бульон Фрейзера для вторичного обогащения или подобная среда). Посевы инкубируют при 37(±1) °С в течение 48 ч. Если для посева были использованы среды с эскулином, то отмечают почернение как признак возможного присутствия листерий.
При анализе продуктов с низким исходным уровнем микробной обсемененности и при отсутствии признаков роста в жидкой среде при первичном обогащении (помутнение, почернение и пр.) можно не проводить вторичного обогащения.
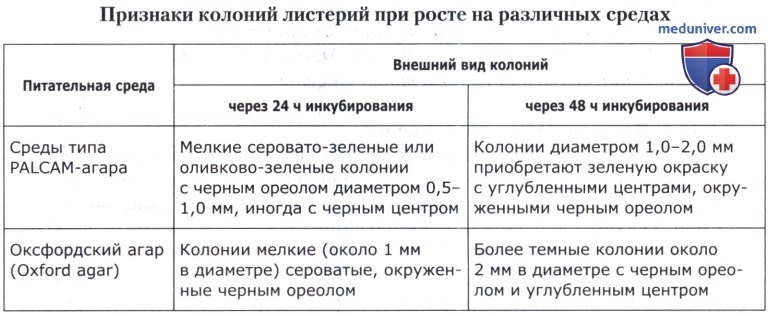
б) Выделение предполагаемых листерий из сред обогащения и подтверждение их принадлежности к роду Listeria. Из сред обогащения (первичного или вторичного), независимо от наличия признаков роста, производят пересев по 0,1 см3 культуральной жидкости на поверхность предварительно подсушенной агаризованной дифференциально-диагностической среды (PALCAM-агар или Оксфордский агар) в двух чашках Петри. Посевной материал немедленно равномерно распределяют по всей поверхности питательной среды стерильным стеклянным шпателем. Можно также производить пересев бактериологической петлей методом истощающего штриха. Чашки с посевами переворачивают и термостатируют при 37(±1)°С в течение 24-48 ч.
При отсутствии роста на чашках с дифференциально-диагностическими средами анализ прекращают и дают заключение об отсутствии Listeria monocytogenes в исследованной навеске продукта. Если обнаружены характерные колонии, то для дальнейшего изучения отбирают 3-5 таких колоний. Если имеет место сплошной рост листерий, то из зон наибольшего почернения среды производят пересев петлей на 2-3 чашки с одной из вышеуказанных селективных дифференциально-диагностических сред, с тем чтобы получить изолированные колонии.
Отобранные характерные колонии пересевают на чашки с МПА с 1 % глюкозы и со средой TSYEA (триптон-соевый агар с дрожжевым экстрактом) так, чтобы получить изолированные колонии. Посевы термостатируют при 30(±1)°С в течение 24 ч. Выращенные культуры используют для дальнейшей идентификации.
Готовят мазки и окрашивают их по Граму. Бактерии рода Listeria представляют собой короткие тонкие грамположительные палочки, спор не образуют.
Для выявления каталазной активности изолированную колонию охлажденной до комнатной температуры суточной культуры снимают с поверхности питательной среды и растирают на стерильном предметном стекле. Наносят каплю 3 % раствора перекиси водорода. Если через 30-60 с на стекле появляются пузырьки газа, то реакцию считают положительной. Бактерии рода Listeria образуют каталазу.
Подвижность выделенных культур выявляют при двух температурах культивирования. Для этого культуры высевают уколом в среду для определения подвижности листерий. Посевы инкубируют параллельно при 22-25°С и 37 °С в течение 48-72 ч. Бактерии рода Listeria подвижны при 20-25 °С (образуют характерный рост вокруг линии укола, похожий на зонтик) и неподвижны (или слабоподвижны) при 35-37 °С.
Для определения способности сбраживать различные углеводы культуры высевают на среды Гисса с маннитом, рамнозой и ксилозой. Посевы термостатируют при 37(±1)°С в течение 7 дней. Наличие ферментативной активности по отношению к углеводам определяют по изменению окраски среды за счет образования кислоты. Большинство бактерий рода Listeria не утилизируют маннит.
Выявление способности к нитрат-редукции проводят как описано в отдельной статье на сайте. За редким исключением бактерии рода Listeria не восстанавливают нитраты до нитритов.
Таким образом, обнаружение коротких тонких грамположительных палочек, каталазоположительных, подвижных при 25 °С и не подвижных при 37 °С, не сбраживающих маннит и не восстанавливающих нитраты до нитритов, указывает на принадлежность выделенных культур к роду Listeria.
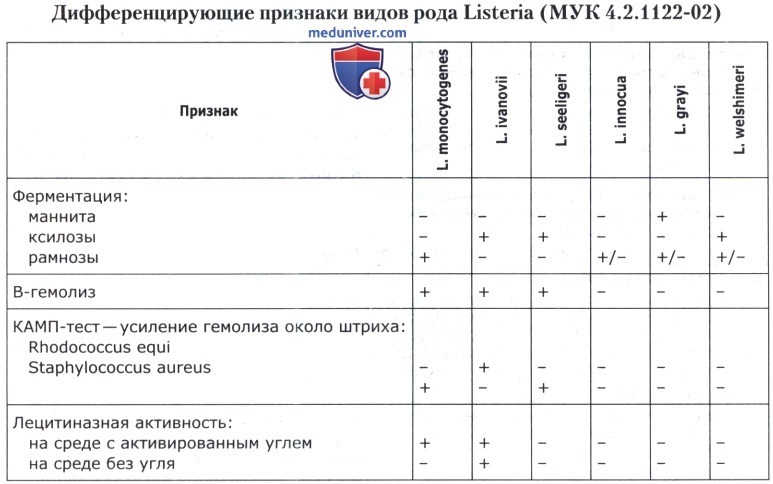
в) Видовая дифференциация выделенных бактерий рода Listeria. Для идентификации выделенных бактерий рода Listeria и подтверждения принадлежности к виду L. monocytogenes определяют способность к ферментации рамнозы, ксилозы, наличие лецитиназной и бета-гемолитической активности и проводят постановку КАМП-теста (CAMP-test).
Выявление способности к ферментации рамнозы и ксилозы проводят, как описано в отдельной статье на сайте. L. monocytogenes утилизирует рамнозу с образованием кислоты и не использует ксилозу.
Для определения бета-гемолитической активности производят посев выделенных культур на поверхность кровяного агара, приготовленного с добавлением стерильной дефибринированной крови барана или кролика. Посевы инкубируют при 37(±1)°С в течение 24 ч. L. monocytogenes обладают р-гемолитической активностью, что выражается в образовании узких четких зон просветления среды вокруг колоний за счет растворения эритроцитов.
Для дифференциации L. monocytogenes с другими гемолитическими видами листерий проводят КАМП-тест. Для этого 2-3 суточные культуры гемолитических штаммов Staphylococcus aureus и Rhodococcus equi высевают на кровяной агар с эритроцитами барана параллельными вертикальными прямыми штрихами на расстоянии 5,0-5,5 см друг от друга. Между штрихами S. aureus и R. equi засевают горизонтальными параллельными прямыми штрихами исследуемые культуры (расстояние между горизонтальными штрихами должно быть не менее 1 см, а расстояние от вертикальных до горизонтальных штрихов—не менее 0,5 см). В качестве контроля таким же образом высевают музейные тест-штаммы L. monocytogenes и L. ivanovii. Посевы культивируют при 37(±1)°С в течение 24 ч. L. monocytogenes дает расширение зоны гемолиза около штриха S. aureus (положительный КАМП-тест) и не изменяет размер зоны гемолиза рядом со штрихом R. Equi (отрицательный КАМП-тест).
Учет лецитиназной активности проводят на среде ГРМ №1 с добавлением желтка куриного яйца и на такой же среде, но с активированным углем. Дно чашек с указанными средами делят на несколько секторов или квадратов. Исследуемые культуры высевают параллельно на соответствующие сектора (квадраты) обеих сред короткими прямыми штрихами. В качестве контроля таким же образом высевают музейные тест-штаммы L. monocytogenes и L. ivanovii. Посевы инкубируют при 37(±1)°С в течение 48 ч. Посевы просматривают в проходящем свете. L. ivanovii дает плотную зону помутнения шириной 3-6 мм независимо от присутствия активированного угля. L. monocytogenes образует такую же зону на среде с активированным углем и не образует зон помутнения на среде без угля. Остальные листерии лецитиназной активностью не обладают.
Таким образом, можно констатировать наличие L. monocytogenes в исследованном образце продукта, если в ходе анализа на селективных средах были выделены короткие грамположительные палочки, не образующие спор, каталазоположительные подвижные при 25 °С и неподвижные при 37 °С, утилизирующие эскулин, сбраживающие с образованием кислоты рамнозу и не сбраживающие маннит и ксилозу, не восстанавливающие нитраты до нитритов, обладающие Р-гемолитической активностью, дающие положительную реакцию в КАМП-тесте с S. aureus и отрицательную — с R. Equi, проявляющие лецитиназную активность на среде с добавлением активированного угля.
При проведении противоэпидемических мероприятий или при эпидрасследованиях в качестве дополнительного метода для обнаружения L. monocytogenes в пищевых продуктах используют реакцию нарастания титра фага (РНФ) с листериозными бактериофагами L2A и L4A и штаммы L. monocytogenes I (9-127) и II (9-72) серогрупп.
- Читать далее "Выявление парагемолитических вибрионов в пищевых продуктах"
Редактор: Искандер Милевски. Дата публикации: 14.10.2019
- Выявление бактерий рода Salmonella в пищевых продуктах
- Выявление и определение количества Staphylococcus aureus в пищевых продуктах
- Выявление и определение количества анаэробных микроорганизмов в пищевых продуктах
- Выявление и определение количества энтерококков (Enterococcus faecalis, Е. faecium, Е. avium, Е. gallinarum) в пищевых продуктах
- Выявление бактерий рода Proteus в пищевых продуктах
- Определение Bacillus cereus в пищевых продуктах
- Определение молочно-кислых микроорганизмов в пищевых продуктах
- Выявление Listeria monocytogenes в пищевых продуктах
- Выявление парагемолитических вибрионов в пищевых продуктах
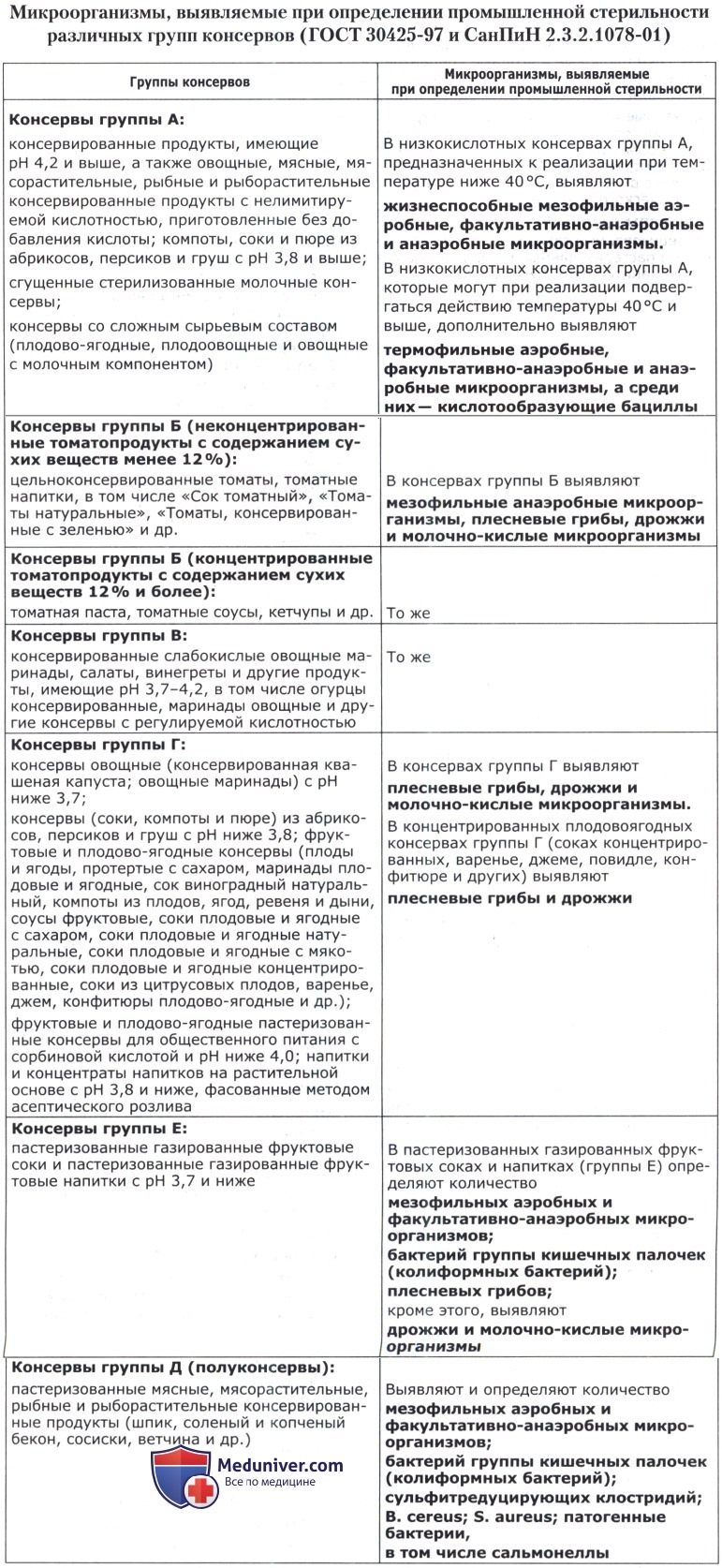
- Определение промышленной стерильности консервов
