Выявление бактерий рода Salmonella в пищевых продуктах
Метод предназначен для выявления в определенной навеске продукта бактерий рода Salmonella. Для этого определенное количество продукта высевают в жидкую неселективную среду, после инкубирования которой производят посев в жидкие селективные среды. Затем полученные культуры пересевают на плотные дифференциально-диагностические среды. Выросшие на этих средах характерные колонии исследуют, выявляя характерные для сальмонелл биохимические и серологические признаки.
а) Неселективное предварительное обогащение. Необходимую навеску продукта высевают в забуференную пептонную воду. Соотношение массы (объема) продукта и забуференной пептонной воды при этом должно составлять 1:9. Посевы инкубируют при 36(±1)°С в течение 18-20 ч.
Доводят pH до 7,0(±0,2) жидких высококислотных продуктов — перед посевом, а твердых высококислотных продуктов — в посевах. Для этого используют стерильные растворы гидроокиси натрия и соляной кислоты.
В ряде случаев предварительное неселективное обогащение можно не производить (при анализе колбасных изделий и продуктов из мяса, яичных продуктов, мяса).
б) Селективное обогащение. По 10 см3 полученных в результате предварительного обогащения культуры пересевают в две среды для селективного обогащения. Для этого используют по 100 см3 магниевой и тетратионатной сред или по 100 см3 селенитовой и тетратионатной среды. В ряде случаев помимо перечисленных сред допускается использование среды Мюллера (при анализе яичных продуктов). Посевы культивируют в течение 24-48 ч при 36(±1)°С (магниевая и селенитовая среда) и 43(+1)°С (тетратионатная среда).
в) Выделение культур на плотных дифференциально-диагностических средах. Через 24 и 48 ч инкубирования микроорганизмы из селективных сред пересевают методом истощающего штриха на три агаризованные дифференциально-диагностические среды—висмут-сульфит агар, среду Плоскирева и среду Эндо (или Левина). В ряде случаев помимо перечисленных сред допускается использование агара с бриллиантовым зеленым и феноловым красным (при анализе мяса птицы, субпродуктов и полуфабрикатов птичьих). Посевы культивируют при 36(±1)°С в течение 24-48 ч. Предварительный учет производят через 24 ч, окончательный—через 48 ч.
На дифференциально-диагностических средах отмечают наличие колоний, характерных для сальмонелл. При отсутствии в посевах характерных колоний дают заключение об отсутствии бактерий рода Salmonella в анализируемой навеске продукта.
Если хотя бы на одной дифференциально-диагностической среде обнаружены колонии, характерные для Salmonella, проводят их дальнейшее изучение.
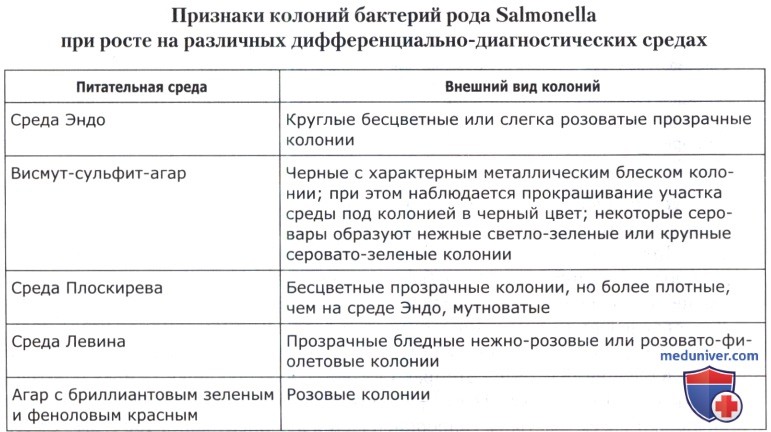
г) Биохимическое подтверждение принадлежности к Salmonella. Не менее трех характерных колоний с каждой дифференциально-диагностической среды пересевают на поверхность скошенного МГ1А и параллельно на трехсахарный агар (штрихом по поверхности и уколом в столбик). Посевы культивируют при 36(±1) °С в течение 24 ч.
После того как произведен посев, из материала отобранных колоний готовят мазки и окрашивают их по Граму. Бактерии рода Salmonella являются не образующими спор грамотрицательными палочками с закругленными концами.
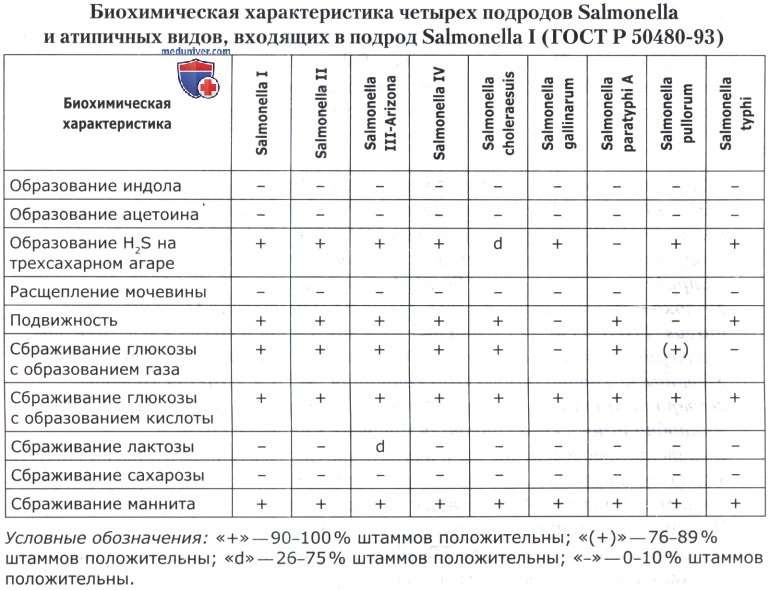
Учет результатов культивирования на трехсахарном агаре позволяет установить способность бактерий к ферментации лактозы, сахарозы и глюкозы, а также способность к образованию сероводорода. В ряде случаев допускается использование сред Ресселя, Клиглера (при анализе яичных продуктов, мяса птицы, субпродуктов и полуфабрикатов птичьих), Крумвиде-Олькеницкого (при анализе яичных продуктов, мяса, колбасных изделий и продуктов из мяса). Типичные культуры Salmonella ферментируют глюкозу (с образованием или без образования газа), не ферментируют лактозу и сахарозу, образуют сероводород.
Дальнейшим исследованиям подвергают бактерии, удовлетворяющие этим требованиям, а также лактозоположительные бактерии или бактерии, не образующие сероводород, но обязательно ферментирующие глюкозу (с образованием или без образования газа). Эти культуры пересевают на поверхность скошенного МПА и инкубируют при 36(±1)°С в течение 24 ч. Выросшие бактерии используют для определения способности к расщеплению мочевины, образованию индола и ацетоина, ферментации сахарозы и маннита, подвижности.

Для установления способности расщеплять мочевину культуру высевают штрихом на среду Кристенсена с мочевиной и культивируют при 36(± 1) °С в течение 24 ч. При росте уреазоположительных бактерий среда достаточно быстро (часто даже после 2 ч инкубации) приобретает цвет от розового до темно-вишневого. Сальмонеллы мочевину не расщепляют.
Для определения образования ацетоина (реакция Фогес-Проскауера) культуры пересевают в мясопептонный бульон с глюкозой. Посевы инкубируют при 36(±1) °С в течение 48 ч. Затем отбирают в стерильную пробирку 1 см3 культуральной жидкости, прибавляют 0,6 см3 раствора α-нафтола. Пробирку встряхивают и прибавляют 0,2 см3 раствора гидроокиси калия в концентрации 400 г/дм3. Смесь хорошо встряхивают. Появление розового окрашивания через 15 мин указывает на положительную реакцию. Учет результатов реакции можно проводить не ранее чем через 15 мин и не позднее чем через 2 ч. Сальмонеллы не образуют ацетоина (реакция отрицательная).
Для определения образования индола культуры пересевают в мясопептонный бульон с триптофаном. Посевы инкубируют при 36(±1)°С в течение 24 ч. Затем к посевам прибавляют по 1 см3 реактива Эрлиха или Ковача. При наличии индола (положительная реакция) в пограничном слое в течение 5 мин появляется красное окрашивание. Сальмонеллы индол не образуют.
Для установления способности к ферментации маннита и сахарозы культуры пересевают в среды Гисса с маннитом или сахарозой. Посевы культивируют при 36(±1)°С в течение 24 ч. При сбраживании указанных субстратов изменяется цвет среды, образуется или не образуется газ. Сальмонеллы не сбраживают маннит и сахарозу.
Для определения подвижности культуры пересевают уколом в полужидкий МПА. Посевы инкубируют при 36(±1)°С в течение 24 ч. При росте подвижных бактерий наблюдается диффузный рост по всему столбику агара, при росте неподвижных бактерий—только вдоль места укола. Большинство сальмонелл подвижно.
Полученные результаты оценивают пользуясь таблицей.
В ряде случаев (например, при анализе мяса птицы, субпродуктов и полуфабрикатов птичьих) дополнительно выявляют способность выделенных культур к дезаминированию фенилаланина. Сальмонеллы дают отрицательную реакцию.
д) Серологическое подтверждение принадлежности к Salmonella. Культуры, проявившие типичные биохимические свойства, пересевают на поверхность скошенного МПА и инкубируют при 36(±1) °С в течение 24 ч.
Определение самоагглютинирующих штаммов. Каплю физраствора помещают на предметное стекло и диспергируют в ней часть исследуемой культуры так, чтобы получилась густая гомогенная суспензия. Стекло осторожно покачивают 30-60 с. Затем отмечают результаты на темном фоне (лучше при помощи увеличительного стекла). Если наблюдается в разной степени склеивание бактерий, т. е. образование осадка, то считают, что тестируемые штаммы обладают самоагглютинацией. Эти штаммы не подвергают дальнейшей серологической идентификации.
Определение О-антигенов проводят в реакциях с поливалентными сальмонеллезными сыворотками основных групп А, Б, С, Д, Е, а затем, если не выявлено О-антигенов с сыворотками основных групп, ставят реакцию с сыворотками редких групп. Ход определения указан в прилагаемых к сывороткам инструкциях.
е) Оценка результатов. К Salmonella относят культуры, показавшие типичные биохимические и серологические реакции. Предположительно к Salmonella относят культуры с типичными биохимическими реакциями, но не имеющих самоагглютинации и О-антигенов, а также культуры с типичными биохимическими реакциями и самоагглютинацией.
- Читать далее "Выявление и определение количества Staphylococcus aureus в пищевых продуктах"
Редактор: Искандер Милевски. Дата публикации: 14.10.2019
- Выявление бактерий рода Salmonella в пищевых продуктах
- Выявление и определение количества Staphylococcus aureus в пищевых продуктах
- Выявление и определение количества анаэробных микроорганизмов в пищевых продуктах
- Выявление и определение количества энтерококков (Enterococcus faecalis, Е. faecium, Е. avium, Е. gallinarum) в пищевых продуктах
- Выявление бактерий рода Proteus в пищевых продуктах
- Определение Bacillus cereus в пищевых продуктах
- Определение молочно-кислых микроорганизмов в пищевых продуктах
- Выявление Listeria monocytogenes в пищевых продуктах
- Выявление парагемолитических вибрионов в пищевых продуктах
- Определение промышленной стерильности консервов
