Схема бактериологического исследования на стрептококки
В основу лабораторной диагностики стрептококковых инфекций положен бактериологический метод исследования — посев проб патологического материала на питательные среды с последующим выделением чистой культуры стрептококков и определением их серологической группы по Ленсфильд, идентификацией по ряду биохимических и ускоренных серологических тестов, а также определением их антибиотикочувствительности.
а) Питательные среды для выделения стрептококков. Для выделения стрептококков используют неселективные бульонные, агаровые и селективные питательные среды.
Среди неселективных стандартных питательных сред ведущее место занимает бульон Тодда—Хьюитта. Он может служить основой обогащенных жидких питательных сред: сывороточного бульона с добавлением 20% нормальной телячьей или лошадиной сыворотки и кровяного бульона с добавлением 3-5% дефибринированной овечьей, лошадиной или кроличьей крови.
На основе бульона Тодда—Хьюитта готовят агаровую среду с кровью для выращивания стрептококков, которая рассматривается также и как дифференцирующая на основании проявляемого ими гемолиза — ос, р, у.
Среды для выделения стрептококков должны содержать пептонную основу для поддержания их роста. Добавление углеводов усложняет оценку гемолитических особенностей, поскольку кислота, образующаяся в результате утилизации углеводов, инактивирует стрептолизин S стрептококков группы А.
На морфологические и гемолитические свойства стрептококков в значительной степени влияет не только состав агаровых сред, но и толщина агара в чашках Петри (4 мм), концентрация крови и источник ее получения.
К агаровой среде предпочтительнее добавлять кровь барана в оптимальной концентрации 5%. В этом случае стрептококки серологических групп А, В, С, F и G дают р-гемолиз, тогда как стрептококки группы D и большинство энтерококков оказываются а-гемолитическими или негемолитическими. Кроме того, только на агаре с овечьей кровью колонии р-гемолитического стрептококка можно отличить от комменсалов зева гемофилов H.haemolyticus и H.parahaemolyticus; т.к. на средах с кровью других видов животных и человека морфология их колоний не отличается от морфологии колоний Р-гемолитических стрептококков.
В тех случаях, когда в исследуемом материале могут содержаться, кроме стрептококков, другие бактерии — представители нормальной микрофлоры, предпочтительно использовать селективные среды.
Выращивание проб на селективных средах может увеличить высеваемость СГА из глотки. Одной из таких сред является колумбийский 5% кровяной агар с колистином (10 мкг/мл) и налидиксовой кислотой (15 мкг/мл). Колистин и налидиксовая кислота ингибируют рост грамотрицательных микроорганизмов, но не влияют на стафилококки и коринебактерии. Использование вместо налидиксовой кислоты оксолиновой (5 мкг/мл) приводит к подавлению роста грамотрицательных микроорганизмов, стафилококков и коринебактерий.
В мировой практике наиболее часто используют триптиказо-соевый агар, содержащий 5% крови барана, 23,75 мкг/мл сульфаметоксазола и 1,25 мкг/мл триметоприма. На этой питательной среде не растет большинство представителей нормальной ротоглоточной флоры (зеленящие стрептококки, микрококки, стафилококки и нейссерии), и благодаря отсутствию роста других микроорганизмов облегчается оценка наличия β-гемолиза, что увеличивает выявление стрептококков групп А и В.
Кровяной агар с кристаллвиолетом целесообразно использовать при посевах проб с кожи, из ран и носовой полости, в которых нередко содержится большое количество гемолизирующих стафилококков, что затрудняет выявление гемолитических стрептококков.
Сложность культивирования стрептококков определяет необходимость постоянного контроля каждой новой серии питательного агара на способность обеспечивать хороший рост стрептококков с типичной морфологией колоний и гемолитическими свойствами. Для этой цели каждая лаборатория должна обладать набором эталонных или известных штаммов тех видов стрептококков, которые наиболее часто встречаются в работе и являются наиболее значимыми в инфекционной патологии.
б) Бактериологическое исследование крови. Первый день исследования. Для посева крови разработано несколько питательных сред. Из отечественных сред рекомендуют использовать специальную (для гемокультур стрептококка) среду ЦНИИВС им. И.И. Мечникова, «среду со стаканчиком» А.И. Сирокко, среды Тодда—Хьюитта, сердечно-мозговой бульон и колумбийский бульон.
Для нейтрализации антибактериальных факторов крови, включая комплемент, целесообразно добавление антикоагулянта полианитолсульфоната натрия (0,025% вес/объем), который также уменьшает количество аминогликозидов в крови в 10 раз. Среду, засеянную кровью, инкубируют 6 недель при 36(±1)°С и просматривают ежедневно в течение первых 8 дней. При появлении видимого роста готовят мазки, окрашивают их по Граму. В соответствии с данными бактериоскопии делают посевы на 5% кровяной агар для идентификации выделенных микроорганизмов и дальнейшего изучения чувствительности к антибактериальным препаратам.
При отсутствии видимого роста на 3, 5, 8-й день делают высев на чашки Петри с 5 % кровяным агаром и мазки на стеклах, которые окрашивают по Граму. Посевы на чашках инкубируют при 36(±1)°С. В случае выделения стрептококков их идентифицируют и при необходимости определяют чувствительность к антибиотикам.
При отсутствии роста на 9-10-й день дают отрицательный ответ, но флаконы с посевами не выбрасывают. Их выдерживают в термостате при 36(±1)°С 4-6 недель, проверяя на наличие роста 2-3 раза в неделю. За это время могут быть выявлены медленно растущие стрептококки. Флаконы, закрытые ватно-марлевыми пробками, обрабатывают смесью воска (1/3) и парафина (2/3) для предотвращения высыхания среды.
Рекомендуется проводить повторные посевы крови, которые позволяют не только подтвердить этиологический диагноз, но и контролировать эффективность лечения. Результаты посева сопоставляют с результатами предыдущих и последующих бактериологических исследований.
в) Посев проб с тампона на кровяной агар. Первый день исследования. Пробу с тампона тщательно переносят на 1/6 поверхности чашки Петри с кровяным агаром (приблизительно 2x3 см около бортика). Затем материал стерильной петлей штрихом разносят через первый участок примерно на 1/4 поверхности чашки Петри, чашку поворачивают на 90° и стерильной петлей производят посев штрихом через участок вторичной инокуляции на третий квадрант. Чашку вновь поворачивают на 90° и стерильной петлей рассеивают материал с третьего квадранта на четвертый, причем последними несколькими штрихами, уже не возвращаясь к третьему квадранту. Для получения отдельных колоний используют 3-4 серии штрихов.
Рассев на каждом новом участке чашки заканчивают посевом в глубину агара несколькими уколами. Это создает приближение к анаэробным условиям и способствует формированию более четких зон β-гемолиза у штаммов, являющихся слабогемолитическими при аэробном культивировании. Для успешного выращивания стрептококков чашки с кровяным агаром должны быть не очень сухими. Посевы выдерживают в термостате 18-20 ч при 36(±1)°С. При отсутствии колоний с β-гемолизом их оставляют еще на одни сутки при комнатной температуре.
Посев проб с полосок фильтровальной бумаги. Первый день исследования. Фольгу раскрывают, приподнимают верхний край кальки и прокаленным глазным пинцетом перекладывают полоску фильтровальной бумаги на агар с кровью стороной, на которую нанесен материал с тампона (карандашным штрихом кверху). Чашку Петри с кровяным агаром и полоской фильтровальной бумаги оставляют на 4-5 ч в термостате при 36(±1)°С (первая позиция). Затем стерильным пинцетом полоску осторожно снимают с первого участка инкубации, делают отпечаток на соседнем участке кровяного агара (вторая позиция) и сразу же переносят на третий участок, где оставляют на 16-18 ч при 36(±1)°С (третья позиция).
При инкубации на поверхности агара с кровью полоска фильтровальной бумаги полностью пропитывается жидкостью из питательного агара. Микроорганизмы растут между полоской и поверхностью агара в капиллярном слое бульона. В таких условиях даже слабогемолитические штаммы S.pyogenes обычно формируют четкие зоны гемолиза. Если после ночной инкубации гемолиз отсутствует, посевы оставляют при комнатной температуре еще на 24 ч.
Метод полоски фильтровальной бумаги предпочтительнее использовать при ожидаемой незначительной величине микробного очага в случаях первично диагностируемой острой ревматической лихорадки или острого гломерулонефрита как дополнительный этап при посеве пробы с тампона. Помимо отмеченных ранее преимуществ этот метод обеспечивает более полный перенос пробы с тампона через полоску фильтровальной бумаги на агар. Последнее также может быть достигнуто, если инокулировать материал на чашку со скошенной агаровой средой. С этой целью после застывания кровяного агара на горизонтальной плоскости в чашку добавляют ту же среду и устанавливают под углом таким образом, чтобы добавленная среда доходила до края бортика, образуя «косяк» длиной, соответствующей длине конца тампона, покрытого ватой. Этот «косяк» используют как участок первичной инокуляции с пробы тампона, подлежащей исследованию.
г) Второй день исследования (посевов крови, материала из ротоглотки, кожных поражений и др. с тампонов). Проводят учет результатов посева на кровяном агаре и выделение чистой культуры β-гемолитических стрептококков.
Просмотр первичных посевов с тампонов на чашках Петри. На кровяном агаре стрептококки вызывают α-, β-гемолиз, или эти виды гемолиза отсутствуют (γ-гемолиз). Изучение и правильная интерпретация гемолитических свойств очень важны, поскольку определяют подбор последующих тестов для идентификации.
Основные типы колоний стрептококка серологической группы А описаны в разделе «Морфологические, культуральные и биохимические свойства».
Размер колоний варьирует от 0,5 до 2 мм и более в диаметре. Размер зоны гемолиза вокруг колонии S. pyogenes обычно в 2-4 раза превышает ее диаметр. У одних штаммов зона гемолиза может быть значительно шире, а у других имеет вид узкого кольца.
S. pyogenes, как правило, лизирует эритроциты полностью. Отдельные штаммы вызывают позеленение кровяного агара, напоминающее а-гемолиз, который переходит в полный лизис только после инкубации в течение 48 ч. Некоторые штаммы в аэробных условиях гемолиз не вызывают.
Учет результатов посева с полосок фильтровальной бумаги. При посеве с полоски фильтровальной бумаги результаты учитывают после ее удаления. На 1-й и 2-й позициях отпечатков полоски фильтровальной бумаги на кровяном агаре вырастают типичные колонии микроорганизмов, β-гемолитические стрептококки под фильтровальной бумагой формируют четкие ограниченные зоны гемолиза. S. aureus имитирует такой же β-гемолиз под фильтровальной бумагой очень редко.
В случаях, когда стрептококки не обнаруживаются на первых двух участках отпечатков, но под фильтровальной бумагой выявляется гемолиз, делают пересев по крайней мере из одной зоны β-гемолиза, удалив полоску фильтровальной бумаги непосредственно перед пересевом. Для этого достаточно коснуться бактериологической петлей типичной зоны гемолиза, перенести пробу на новую чашку с кровяным агаром и засеять ее штрихом.
Если после 18-20-часовой инкубации колонии с гемолизом отсутствуют, посевы оставляют при комнатной температуре еще на 24 ч.
При окончательном учете результатов исследования целесообразно использовать полуколичественную оценку числа колоний гемолитического стрептококка, выросших на кровяном агаре при посеве с тампона или с полоски фильтровальной бумаги:
1+ — 1-10 КОЕ (колониеобразующих единиц) стрептококков на чашке;
2+ — 11-50 КОЕ на чашке;
3+ — более 50 КОЕ на чашке;
4+ — стрептококки в преобладающем количестве или в чистой культуре.
При использовании адекватных методов исследования при острых стрептококковых инфекциях глотки обнаруживаются значительные величины микробных очагов, чего не наблюдается у здоровых носителей.
Дифференциация колоний гемолитических стрептококков с гемолизирующими микроорганизмами других видов. В целях дифференциации целесообразно с материалом из подозрительных колоний поставить реакцию на выявление каталазы, которая у стрептококков, как правило, отрицательная. Из колоний, сходных со стрептококком, делают мазки, окрашивают их по Граму и микроскопируют с целью дифференциации с грамотрицательными гемофильными микроорганизмами, рост которых на кровяном иногда подобен росту гемолитических стрептококков.
Первые генерации стрептококка отличаются выраженным полиморфизмом клеток. В мазках, окрашенных по Граму, они располагаются парами, короткими цепочками из 3-4 кокков, иногда образуют скопления, напоминающие гроздья стафилококков. Наряду с шарообразными формами даже в пределах одной цепочки встречаются вытянутые в длину грубые кокки разной величины.
При выявлении в препарате парных кокков и коротких цепочек оставшийся материал колонии снимают петлей и инокулируют в 20% сывороточный бульон и среду для выделения стрептококков для последующей идентификации.
д) Третий день исследования — групповая идентификация стрептококков. Результат бактериологического исследования, ограничивающийся только выделением β-гемолитических стрептококков, недостаточен для постановки этиологического диагноза, предусматривающего определение серогрупповой (видовой) принадлежности возбудителя. Если рост на жидкой питательной среде (пристеночный и придонный, нередко с легким помутнением) не вызывает сомнений и чистота культуры подтверждена высевом на агар с кровью, приступают к идентификации вида (серогруппы). Классический метод групповой идентификации стрептококков по Ленсфилд с использованием антигенов, для приготовления которых разработано несколько методов, в практической работе клинико-диагностических лабораторий почти не применяется, так как он трудоемок и требует значительных затрат времени.
Используют препараты, содержащие группоспецифические иммунные кроличьи антисыворотки или иммуноглобулины G, связанные с латексными частицами (латекс-агглютинация) или с клеточной суспензией штамма S.aureus, имеющего А-белок (коагглютинация). При смешивании экстракта, содержащего групповой антиген, с покрытыми иммуноглобулином частицами получают агглютинацию, которая видна невооруженным глазом.
Можно использовать доступные на коммерческой основе латексные наборы реагентов для группирования стрептококков серологических групп А, В, С, D, F и G производства, например, фирмы «BioMerieux» (Франция). Могут быть использованы и коагглютинирующие наборы для экспресс-идентификации стрептококков групп А, В, С и G отечественного производства («АКВАПАСТ», Санкт-Петербург).
В состав наборов входят сорбированные на убитых клетках золотистого стафилококка специфические кроличьи антитела к групповому антигену стрептококков серогрупп А, В, С и G, отрицательный контроль (иммуноглобулины нормальной кроличьей сыворотки, сорбированные на клетках золотистого стафилококка) и положительный контроль (группоспецифический антиген соответствующих серогрупп стрептококков).
Антиген из культуры стрептококка (или непосредственно из исследуемой пробы — с тампона) получают при помощи смеси экстрагирующих растворов в количествах, указанных в «Инструкции по применению». Экстрагирование продолжают на кипящей водяной бане 1 мин при 37°С, в термостате — 15 мин, а при комнатной температуре — в течение 30 мин. Экстракт (после охлаждения, в случае получения его на кипящей водяной бане) используют в качестве антигена в реакции коагглютинации. Результат оценивают через 2 мин после перемешивания диагностикума и экстракта.
Чувствительность экспресс-методов (при использовании экстракта непосредственно из материала на тампоне), как правило, ниже таковой при классических бактериологических. В связи с этим все отрицательные результаты экспресс-тестов у больных с подозрением на стрептококковую инфекцию должны быть подтверждены культуральными методами исследования с последующим серогруппированием выделенной чистой культуры стрептококка.
е) Скрининговые методы идентификации стрептококков серологической группы А. При отсутствии дорогостоящих реагентов для серогруппирования используют ряд «ориентировочных» методов идентификации α- и β-гемолитических и негемолитических стрептококков, учитывая при этом источник выделения штаммов и их культурально-морфологические особенности при первичном высеве клинического материала на кровяной агар. В числе скрининговых тестов большое значение для дифференциации β-гемолитических стрептококков, обнаруженных в материале из носоглотки и очагов поражения кожи, имеет определение отношения выделенных культур к бацитрацину, основанное на чувствительности к низким концентрациям этого антибиотика, стрептококков серогруппы А, а также ПИР (PYR)-тест.
ж) Бацитрациновый тест. При постановке теста следует соблюдать следующие условия:
- диски, используемые для дифференцирующего теста, должны содержать 0,04-0,05 ME бацитрацина. Диски, предназначенные для определения чувствительности к бацитрацину, содержащие 10 ME антибиотика, для этого теста непригодны, так как могут дать ложноположительные результаты;
- на поверхности среды необходим густой «газон» испытуемой культуры, так как при сильно разведенном посевном материале трудно оценить истинную чувствительность культур, и может сложиться впечатление, что стрептококки, не принадлежащие к группе А, чувствительны к бацитрацину;
- тестируют только β-гемолитические стрептококки, поскольку многие a-гемолитические стрептококки и пневмококки ингибируются бацитрацином;
- исследуют только чистую культуру. Диски с бацитрацином, помещенные на первичные чашки с посевом материала из зева, позволяют идентифицировать только 50-65% стрептококков группы А;
- каждую новую партию дисков испытывают с известными штаммами стрептококков группы А, чтобы выявить стабильность препарата;
- тест считают положительным при наличии любой зоны ингибирования роста микроорганизма.
Для постановки бацитрацинового теста берут полную петлю бульонной культуры или 3-4 колонии β-гемолитических стрептококков, густо рассеивают штрихом на чашку агара с кровью, бацитрациновый диск помещают в центр штриховой зоны и прижимают его к агару стерильным пинцетом. Чашку инкубируют 18-20 ч при 35-37°С. Появление зоны ингибиции роста стрептококков вокруг диска с бацитрацином позволяет отнести штамм к группе А по бацитрацину.
Около 5% штаммов пиогенных стрептококков, принадлежащих к серогруппам В, С, G, чувствительны к бацитрацину так же, как штаммы группы А.
В дополнение к бацитрациновому тесту целесообразно определять чувствительность выделенных β-гемолитических стрептококков к ко-тримоксазолу — комбинации сульфаниламидов: триметоприму (1,25 мкг) и сульфаметазолу (23,75 мкг). Техника постановки обоих тестов аналогична. Стрептококки группы А, чувствительные к низким концентрациям бацитрацина, резистентны к ко-тримоксазолу. К этим сульфаниламидам, как правило, чувствительны β-гемолитические стрептококки с непостоянной реакцией на бацитрацин, в связи с чем выполнение обоих тестов, аналогичных по воспроизведению, повышает надежность результатов.
Чувствительные культуры также характеризуются наличием любой зоны задержки роста, резистентные — определяются при наличии роста вплоть до края диска. При этом культуры β-гемолитических стрептококков, чувствительные к бацитрацину и резистентные к ко-тримоксазолу, рассматриваются как предположительно СГА, а резистентность, отмеченная в обоих тестах, позволяет предположить, что исследованные стрептококки принадлежат к группе В. Чувствительность, выявленная в обоих тестах, или чувствительность к комбинации сульфаниламидов и резистентность к бацитрацину позволяют рассматривать выявленные стрептококки предположительно как не относящиеся ни к группе А, ни к группе В.
е) ПИР-тест основан на гидролизе L-пирролидонил-β-нафтил амида или β-нафтиламид-L-пироглутамовой кислоты (НИР) специфическим бактериальным ферментом α-пирролидонил-аминопептидазой стрептококка группы А с образованием β-нафтиламида, который улавливается при соединении его с реагентом N,N-диметил-аминоциннамальдегидом, давая при этом вишнево-красное окрашивание. Примерно 98% исследуемых штаммов СТА положительны в этом тесте. Вместе с тем некоторые представители грамположительных каталазоотрицателъных родов (Enterococcus, Aerococcus и Gemella) и видов (Lactococcus lactis) также ПИР-поло-жительны. Однако благодаря характерной морфологии они не могут вызывать ошибки при идентификации стрептококков группы А. Некоторые штаммы S.suis, стрептококков серогрупп С и G и других, редко встречающихся видов животного происхождения (S. porcinus и S. iniae), способны давать положительный результат в ПИР-тесте. Широкий спектр ПИР-положительных нестрептококковых микроорганизмов вызывает необходимость постановки этой реакции с чистой культурой. Тест, описанный в начале 80-х гг. прошлого столетия Facklam и соавт., предполагался как агаровый и позволял получить ответ через 16-20 ч. В настоящее время существует несколько модификаций ПИР-теста, существенно сокращающих время исследования и предусматривающих использование бумажных дисков или полосок фильтровальной бумаги, пропитанных ПИР, агаровой или бульонной среды с добавлением в нее ПИР. Все необходимое для осуществления ПИР-теста доступно на коммерческой основе.
ПИР-тест на фильтровальной бумаге:
1) часть колонии, подлежащей исследованию, наносят бактериологической петлей на поверхность фильтровальной бумаги или диска, пропитанных ПИР;
2) добавляют каплю выявляющего реагента N,N-диметил-аминоциннамальдегида;
3) положительный результат: появление ярко-красного окрашивания в течение 1-5 мин;
4) отрицательный результат: изменения цвета не наблюдается либо отмечается появление желтого или оранжевого окрашивания.
Определение чувствительности микроорганизмов к антибактериальным препаратам проводят в соответствии с «Методическими указаниями МУК 4.21890-04», утвержденными и введенными в действие Главным государственным санитарным врачом РФ 04.03.2004 г.
Обязательному исследованию на чувствительность к антибактериальным препаратам подлежат все микроорганизмы, выделенные из первично стерильных жидкостей, органов и тканей человека. В других случаях оценке чувствительности должна предшествовать оценка клинической значимости выделяемого микроорганизма.
Препаратом выбора для лечения инфекций, вызванных S.pyogenes, является пенициллин, достоверных случаев резистентности к которому in vitro до настоящего времени не описано. Не отмечена также устойчивость к ванкомицину. Это определяет нецелесообразность изучения в рутинной практике чувствительности к указанным антибактериальным препаратам (АБП). При наличии аллергии на эти препараты возникает необходимость определения чувствительности к другим АБП, к которым S.pyogenes нередко приобретает резистентность.
ж) Современные стандартизированные методы оценки антибиотикочувствительности включают методы серийных разведений и диффузионные.
1. Методы серийных разведений позволяют определять МПК — минимальную подавляющую концентрацию антибиотика, ингибирующую видимый рост исследуемого микроорганизма в жидкой или агаровой среде.
В рутинной практике наиболее часто используют дискодиффузионный метод (ДДМ). Он основан на регистрации диаметра зоны подавления роста исследуемого микроорганизма вокруг круглого носителя антибиотика (бумажного диска). Следует использовать только стандартизированные качественные диски.
Дискодиффузионный метод позволяет лишь косвенно судить о величине МПК. Основным результатом является отнесение микроорганизма к одной из категорий чувствительности — чувствительным, резистентным или с промежуточной чувствительностью.
Исследования по оценке антибиотикочувствительности включают:
— приготовление суспензии тестируемых микроорганизмов (инокулята), приготовление питательных сред, инокуляцию, инкубацию и учет результатов.
Оценке антибиотикочувствительности подлежат чистые культуры микроорганизмов или материал изолированных колоний с плотных питательных сред после первичного посева пробы клинического материала; при этом параллельно продолжают идентификацию культуры.
Бактериологической петлей переносят незначительное количество материала с верхушек нескольких однотипных колоний, выращенных на неселективных питательных средах, в пробирку со стерильным изотоническим раствором хлорида натрия или питательным бульоном. Концентрацию суспензии доводят точно до 0,5 стандарта мутности Мак-Фарланда (1-2х108 КОЕ/мл) при помощи спектрофотометра (денситометра) или под визуальным контролем путем добавления стерильного изотонического раствора хлорида натрия или бульонной среды. Суспензию следует использовать в течение 15 мин после приготовления.
Приготовление стандарта мутности 0,5 по Мак-Фарланду. К 0,5 мл раствора BaCl2 в концентрации 0,048 моль/л (1,175% раствор BaCl2х2H2O) медленно при тщательном перемешивании добавить 99,5 мл раствора H2SO4 в концентрации 0,18 моль/л (1%) до получения гомогенной суспензии. Правильность приготовления суспензии необходимо проверить на спектрофотометре. Поглощение при использовании кюветы шириной 1 см должно составить 0,08-0,10 при длине волны 625 нм.
Полученную суспензию разливают по 4-6 мл в пробирки с герметично закрывающимися крышками такого же диаметра, как и используемые для приготовления бактериальной суспензии. Хранить пробирки с суспензией следует в темноте при комнатной температуре. Перед использованием пробирки необходимо тщательно встряхнуть и оценить однородность суспензии. При появлении видимых частиц пробирки изымаются из употребления.
Стандарт мутности необходимо обновлять или проверять его оптическую плотность ежемесячно.
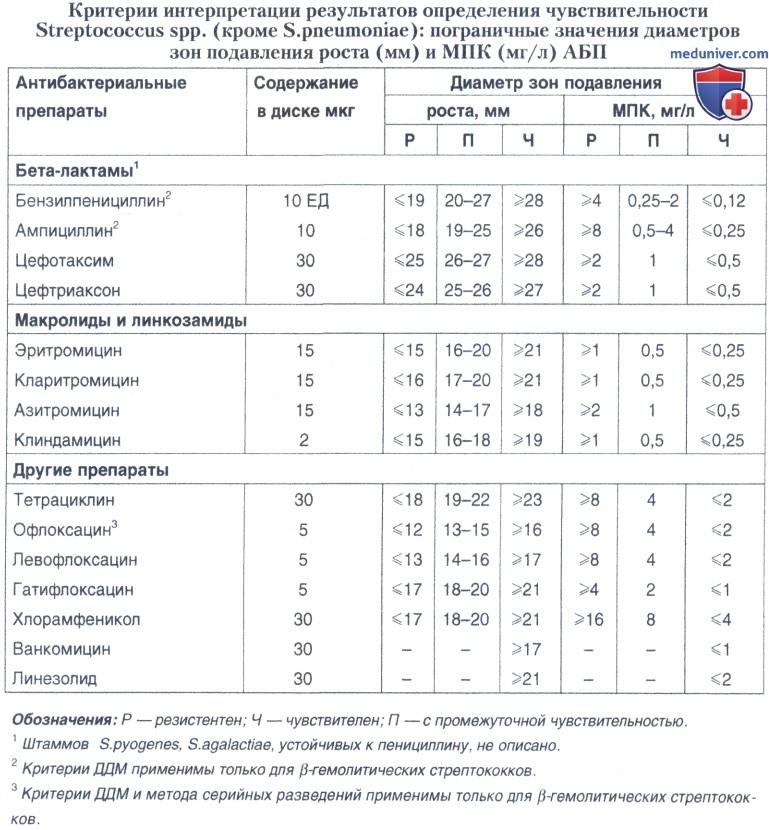
2. Приготовление чашек Петри с плотной питательной средой. Используют агар Мюллера—Хинтона с добавлением 5% дефибринированной бараньей крови. Плотную питательную среду готовят в соответствии с инструкцией изготовителя из сухой среды промышленного производства.
После автоклавирования питательную среду сразу же разливают в стерильные пробирки или колбы. При необходимости среду расплавляют на водяной бане и после остывания до 45-50°С в нее асептически вносят кровь барана, а затем разливают в чашки Петри.
Слой агара в чашке Петри должен быть высотой 4(±0,5) мм (при диаметре чашки 150 мм требуется 60 мл агара, 100 мм — 25 мл агара, 90 мм — 20 мл).
Перед заполнением расплавленной средой, чашки Петри устанавливают на строго горизонтальной поверхности, выверенной по уровню, без впадин и выпуклостей. После застывания агаровой среды при комнатной температуре чашки Петри предпочтительнее использовать немедленно. Допускается их хранение в запаянных полиэтиленовых пакетах в холодильнике при 4-8°С в течение 7-10 суток.
Перед инокуляцией материала чашки Петри необходимо подсушить в течение 10-20 мин, поместив в термостат при 35°С с приоткрытой крышкой и проконтролировать отсутствие конденсата на внутренней поверхности крышек.
Инокуляция культуры стрептококка на приготовленные чашки Петри с агаром. Существует два способа.
1) Наиболее удобно использование стерильных ватных тампонов. Готовят суспензию исследуемой культуры в соответствии со стандартом мутности 0,5 по Мак-Фарланду. Стерильные тампоны погружают в эту суспензию S. pyogenes, затем ее избыток удаляют, отжав тампон о стенки пробирки. Инокуляцию осуществляют штриховыми движениями в трех направлениях, поворачивая чашку Петри на 60°.
2) Суспензию исследуемой культуры в соответствии со стандартом мутности 0,5 по Мак-Фарланду в количестве 1-2 мл наносят пипеткой на поверхность чашки Петри с питательной средой, покачиванием равномерно распределяют инокулюм, после чего избыток его удаляют пипеткой. Приоткрытые чашки подсушивают при комнатной температуре в течение 10-15 мин. После инокуляции не позднее, чем через 15 мин на поверхность питательной среды стерильным пинцетом или автоматическим диспенсером наносят диски с АБП так, чтобы расстояние до края чашки и между дисками составляло 15-20 мм. Таким образом, на одну чашку диаметром 100 мм следует помещать не более 6 дисков с АБП. Для обеспечения равномерного контакта дисков с поверхностью агара их аккуратно прижимают пинцетом.
Непосредственно после аппликации дисков чашки Петри помещают в термостат кверху дном и инкубируют при температуре 35°С в течение 18-24 ч.
3. Учет результатов. По окончании инкубации чашки помещают кверху дном на темную матовую поверхность так, чтобы свет падал на них под углом 45° (учет в отраженном свете). Диаметр зон задержки роста измеряют с точностью до 1 мм, используя штангенциркуль или кронциркуль. При этом следует ориентироваться на зону полного подавления видимого роста, не обращая внимания на очень мелкие колонии, в пределах зоны задержки роста и едва заметный налет у края зоны.
Крупные колонии, выявляемые в пределах четкой зоны подавления роста, свидетельствуют о наличии посторонней микрофлоры или о гетерорезистентности популяции микроорганизмов и требуют повторения идентификации микроорганизма, формирующего эту колонию, и определения чувствительности этого штамма.
При каждом исследовании необходим контроль чистоты культуры инокулюма, который осуществляют, засевая часть его на чашку с неселективной питательной средой (5% кровяной агар на бульоне Тодда—Хьюитта) с учетом роста после выращивания в течение ночи. Прочие параметры контроля качества исследований на чувствительность к АБП получают в соответствии с требованиями Методических рекомендаций.
з) Серологическая диагностика стрептококковых инфекций. У лиц с инфекциями, вызванными S. pyogenes, в крови образуются антитела к экстрацеллюлярным продуктам, таким как стрептолизин-О, ДНКаза В, стрептокиназа, гиалуронидаза, и к клеточным компонентам — М-протеину и групповому А-антигену. Глоточные инфекции сопровождаются, как правило, ростом титров антител практически против всех антигенов, тогда как у больных кожными инфекциями отмечается значительное повышение титров антител только к ДНКазе В.
Серологические тесты полезны для подтверждения предшествующей недостаточно документированной стрептококковой инфекции при возникновении осложнений, таких как ревматическая лихорадка или острый гломерулонефрит, когда уже практически невозможно выделить возбудителя из первичного очага поражения, а сыворотки, полученные и через 2 мес после острой стрептококковой инфекции, могут сохранять повышенные титры антител.
Определение титров стрептококковых антител и антигенов в крови больных проводят в соответствии с наставлениями, прилагаемыми к допущенным к применению в практике коммерческим препаратам для определения этих показателей.
- Вернуться в оглавление раздела "Медицинская микробиология"
Редактор: Искандер Милевски. Дата публикации: 19.11.2019
- Скарлатина при стрептококковой инфекции
- Рожа при стрептококковых инфекции
- Гнойные поражения кожи при стрептококковой инфекции
- Ревматизм при стрептококковой инфекции
- Острый гломерулонефрит при стрептококковой инфекции
- Некротизирующий фасциит при стрептококковой инфекции
- Синдром токсического шока (СТШ) при стрептококковой инфекции
- Микробиологическая диагностика стрептококковой инфекции
- Схема бактериологического исследования на стрептококки
