Микробиологическая диагностика стрептококковой инфекции
Подозрение на стрептококковую инфекцию определяет необходимость исследования следующих клинических материалов:
- крови при явлениях септического характера и подозрении на эндокардит;
- налета и слизи с миндалин и слизистых оболочек носоглотки при ангине и скарлатине;
- серозной жидкости из ран и поражений кожи;
- гноя из очагов поражения;
- отделяемого вагины у беременных женщин;
- мокроты, бронхиальных смывов и пунктатов при поражении нижних дыхательных путей.
В большинстве случаев для отбора материала, подлежащего исследованию, используют ватные тампоны, иногда пробы получают при помощи шприца.
а) Взятие и доставка клинического материала для бактериологического исследования. При подозрении на генерализованную стрептококковую инфекцию для подтверждения этиологического диагноза требуется посев крови, который предпочтительно проводить:
— во время подъема температуры тела, в начале появления лихорадки. Для повышения результативности кровь берут по 5-10 мл в начале обследования 2-3 раза с интервалом приблизительно в 1 ч или 2-4 раза в течение суток;
— до начала специфического антибактериального лечения или по крайней мере через 12-24 ч после последнего введения больному препарата (в зависимости от скорости выведения его из организма).
Кровь для посева берут у постели больного или в процедурной с соблюдением всех правил асептики и немедленно засевают в жидкие питательные среды. Не пользуются шприцем со «стерильного стола» в перевязочной, так как на нем могут оказаться бактерии из воздуха. По этой же причине не проверяют проходимость простерилизованного шприца и иглы воздухом. Взятие крови и ее посев на питательные среды, как правило, осуществляют два человека. Пока один обрабатывает кожу больного над веной, пунктирует ее и берет кровь, другой над пламенем спиртовки открывает пробки флаконов со средой, подставляет их под струю крови из шприца, обжигает горлышко и пробки и закрывает флаконы.
Для каждой пробы используют два флакона. Кожу над пунктируемой веной обрабатывают 70% спиртом, затем 10 % настойкой йода, и, после высушивания в течение 30 секунд, снова спиртом. Если у больного имеется постоянный подключичный катетер или он подключен к капельнице, то последние используются для получения пробы только в течение первых трех дней, так как позже возникает контаминация катетера. При этом некоторому количеству крови дают свободно стечь в пробирку и используют этот образец для биохимических анализов, затем набирают кровь в шприц и тут же засевают на питательные среды.
Для преодоления естественных бактерицидных свойств крови ее инокулируют в большой объем жидкой питательной среды так, чтобы конечное соотношение составило 1:10-1:60. Желательно получить для анализа не менее 10 мл крови от взрослых и 5 мл — от детей.
Кровь, взятую во флаконы со средой, немедленно доставляют в лабораторию; при задержке доставки по каким-либо причинам она должна храниться в термостате или при комнатной температуре, но в лабораторию должна быть передана в тот же день.
б) Взятие проб из ротоглотки. При взятии материала, подозреваемого на наличие стрептококков, рекомендуется использовать ватные тампоны. Если их изготавливают в лаборатории, необходимо убедиться, что используемая вата не обладает ингибирующим действием на стрептококк. Для этого стерильную вату в количестве, необходимом для изготовления тампона, помещают в пробирку с бульоном, в которую засевают известную культуру стрептококка.
Для контроля такое же количество культуры засевают во вторую пробирку с бульоном, но без ваты. Если в пробирке с ватой рост стрептококков отсутствует, а в контрольной пробирке отмечается характерный рост известной культуры (т.е. налицо ингибирующее действие ваты на стрептококк), тампоны кипятят в буферном растворе Соренсена в течение 15 мин в соответствии с «Рекомендациями Центра ВОЗ по изучению стрептококковых инфекций». Избыток раствора стряхивают. Тампоны сушат в термостате, помещают в пробирки, закрывают их ватой или ватно-марлевой пробкой и стерилизуют в автоклаве при 120°С в течение 30 мин.
Пробы со слизистой оболочки глотки для бактериологического исследования предпочтительно брать до утреннего туалета полости рта, натощак или через 2 ч после еды. Обследуемого усаживают на стул против источника света, язык фиксируют шпателем. Полость рта освещают ярким светом. Обследуемый немного запрокидывает голову назад, глубоко дышит и произносит длинный звук «А». При этом поднимается маленький язычок, способствуя большей доступности для взятия пробы с задней стенки глотки, и отсутствует рвотный рефлекс. Тампон быстро и осторожно вводят в рот, стараясь не прикасаться к языку и зубам, и с легким надавливанием на поверхность миндалин и задней стенки глотки энергично снимают слизистое отделяемое.
в) Взятие проб из носа. Большим пальцем поднимают кончик носа, тампон вводят на глубину 1-2 см в каждую ноздрю и берут отделяемое слизистой оболочки. Если подлежащий исследованию участок поражения сухой, тампон смачивают стерильной дистиллированной водой или изотоническим раствором натрия хлорида.
Взятие проб из везикул на коже. Пробы из везикул на коже получают пунктированием с соблюдением асептики после промывания поверхности кожи 70% спиртом. При наличии корочек (импетиго) кожу вокруг обрабатывают 70% спиртом, а корочку удаляют стерильной иглой. Затем с основания этого участка берут пробу увлажненным тампоном. Можно натянуть кожу по краю корочки (не удаляя ее) и выдавить из-под нее каплю серозной жидкости. Эту каплю собирают на конец сухого тампона, не касаясь кожи. Промывание 70% спиртом участка вокруг поражения перед этой процедурой не обязательно. Предпочтительно получать материал из свежих поражений, которые содержат монокультуры стрептококка. В противном случае часто кроме стрептококка обнаруживают стафилококк.
г) Взятие материала при эритематозной роже. При рожистом воспалении с интактной поверхностью отбор материала осуществляют шприцем. С этой целью предварительно в область поражения после обработки ее 70% спиртом вводят небольшое количество (не более 0,1 мл) стерильного изотонического раствора натрия хлорида, затем жидкость немедленно отсасывают. Результативность выявления стрептококка серогруппы А при использовании этой методики невелика. Объем отбираемого шприцем материала небольшой, поэтому его сразу переносят в обогащенную жидкую среду (сывороточный или кровяной бульон) или на МПА с кровью.
д) Взятие материала при буллезной роже. При буллезной форме рожистого воспаления жидкость из образовавшегося пузыря после промывания его поверхности 70% спиртом отсасывают в шприц.
е) Взятие материала при абсцессах, гнойных синуситах, остеомиелите. При паратонзиллярном абсцессе, гнойном лимфадените, синусите, среднем отите, остеомиелите и других локализованных инфекциях, которые могут быть вызваны стрептококками серогруппы А, для отбора проб используют шприц. Гной, полученный из очагов поражения, немедленно доставляют в лабораторию. Если по каким-либо причинам сделать это невозможно, взятый на исследование клинический материал помещают в холодильную камеру при +4°С.
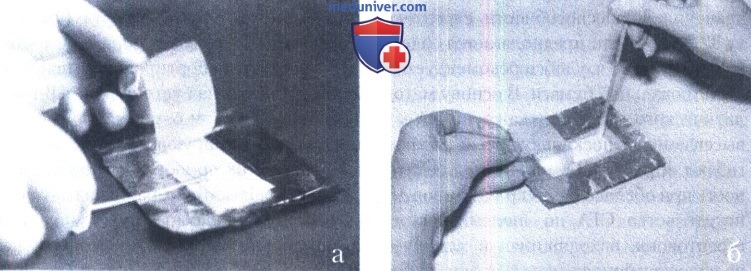
а - перекатывание тампона по полоске; б - прикосновение кончиком тампона к периферии полос.
ж) Для транспортировки проб в лабораторию, если посев нельзя осуществить в течение 2-3 ч, рекомендуется использовать коммерческие транспортные среды для сохранения жизнеспособности стрептококков, например, среду Стюарта. Если предполагается задержка посева проб из зева и поражений кожи более чем на 48 ч, удобен рекомендуемый ВОЗ способ транспортировки на полосках фильтровальной бумаги. В основу метода положена известная устойчивость β-гемолитического стрептококка группы А к высыханию.
При этом отмечено повышение высеваемости, поскольку другие микроорганизмы, колонизирующие ротоглотку, погибают, и росту С ГА ничего не препятствует. Этот метод приобретает особую ценность при обследовании коллективов детей и лиц юношеского возраста на глоточное носительство СГА по эпидемическим показаниям. При комнатной температуре стрептококк, находящийся в клиническом материале, остается жизнеспособным на полосках фильтровальной бумаги более 7-10 дней.
з) Метод полоски фильтровальной бумаги. Фильтровальную бумагу английского производства (Whatman № 1) или бумагу Лальской бумажной фабрики (ГОСТ 6246-71) либо бумагу Института бумаги (ГОСТ 1202-76) нарезают полосками размером 2x6 см. На одну сторону этой полоски наносят штрих простым карандашом. Кальку, нарезанную полосками размером 3x15 см, сгибают поперек таким образом, чтобы одна часть ее оказалась на 5 мм длиннее другой. Полоску фильтровалыгой бумаги карандашным штрихом книзу вкладывают между частями согнутой кальки так, чтобы более длинная часть ее покрывала фильтровальную бумагу сверху.
Кальку с полоской фильтровальной бумаги упаковывают в двойной слой алюминиевой фольги размером 10,5x19 см таким образом, чтобы она закрывалась со стороны более длинной части кальки на не отмеченной штрихом поверхности фильтровальной бумаги. Такие упаковки вкладывают в конверт по 20 штук и стерилизуют в автоклаве при 121°С в течение 30 мин. После высушивания полоски фильтровальной бумаги готовы к использованию.
Для транспортировки пробы в лабораторию на полосках фильтровальной бумаги материал из ротоглотки берут также стерильным ватным тампоном. Перед взятием материала на алюминиевой фольге шариковой ручкой пишут фамилию, инициалы больного и ставят дату получения пробы. Фольгу разворачивают и приподнимают верхнюю часть кальки, захватив ее кончиками пальцев за край так, чтобы не коснуться полоски фильтровальной бумаги. Затем тампон, которым предварительно взят материал для исследования, с надавливанием перекатывают по поверхности фильтровальной бумаги и его концом прикасаются в нескольких местах к периферии полоски.
Полоску фильтрованной бумаги, покрытую калькой, после нанесения на нее материала оставляют на столе на 10-15 мин до полного высыхания. После высушивания фольгу заворачивают, и упаковку отправляют в лабораторию.
ВОЗ рекомендует использовать «метод полоски фильтровальной бумаги» для длительного сохранения жизнеспособных эталонных или известных культур стрептококков, это необходимо каждой лаборатории для регулярного контроля качества питательных сред и диагностических препаратов. При температуре минус 20°С такие культуры сохраняются более одного года, а при минус 70°С — в течение нескольких лет.
Для длительного хранения 20-30 колоний свежей культуры стрептококка с кровяного агара бактериологической петлей равномерно распределяют по поверхности полоски фильтрованной бумаги. После высушивания полоски заворачивают в фольгу и оставляют при минус 20° или минус 70°С.
- Читать далее "Схема бактериологического исследования на стрептококки"
Редактор: Искандер Милевски. Дата публикации: 19.11.2019
- Скарлатина при стрептококковой инфекции
- Рожа при стрептококковых инфекции
- Гнойные поражения кожи при стрептококковой инфекции
- Ревматизм при стрептококковой инфекции
- Острый гломерулонефрит при стрептококковой инфекции
- Некротизирующий фасциит при стрептококковой инфекции
- Синдром токсического шока (СТШ) при стрептококковой инфекции
- Микробиологическая диагностика стрептококковой инфекции
- Схема бактериологического исследования на стрептококки
