Идентификация и дифференциация биоваров бруцелл (возбудителей бруцеллеза, Brucella)
Культура, выделенная одним из указанных методов, подлежит родовой идентификации (определению принадлежности к роду Brucella), тесты которой включают: микроскопию препаратов, окрашенных по Граму или Козловскому, морфологию колоний на плотной питательной среде, РИФ, реакцию агглютинации на стекле с бруцеллезной поливалентной агглютинирующей сывороткой.
Морфология микробных клеток бруцелл при бактериоскопии в окраске по Граму и Козловскому и характер роста культуры на питательных средах описаны выше.
а) Реакция агглютинации с бруцеллезной поливалентной агглютинирующей сывороткой. На предметное стекло наносят каплю бруцеллезной поливалентной агглютинирующей сыворотки, разведенной 1:25 0,9%-ным раствором натрия хлорида, в которой бактериологической петлей эмульгируют исследуемую агаровую культуру. Реакция считается положительной, если в течение 1 мин проявляется выраженная агглютинация, отрицательной, — если суспензия остается гомогенной. Для контроля исследуемую культуру эмульгируют в капле 0,9%-ного раствора натрия хлорида.
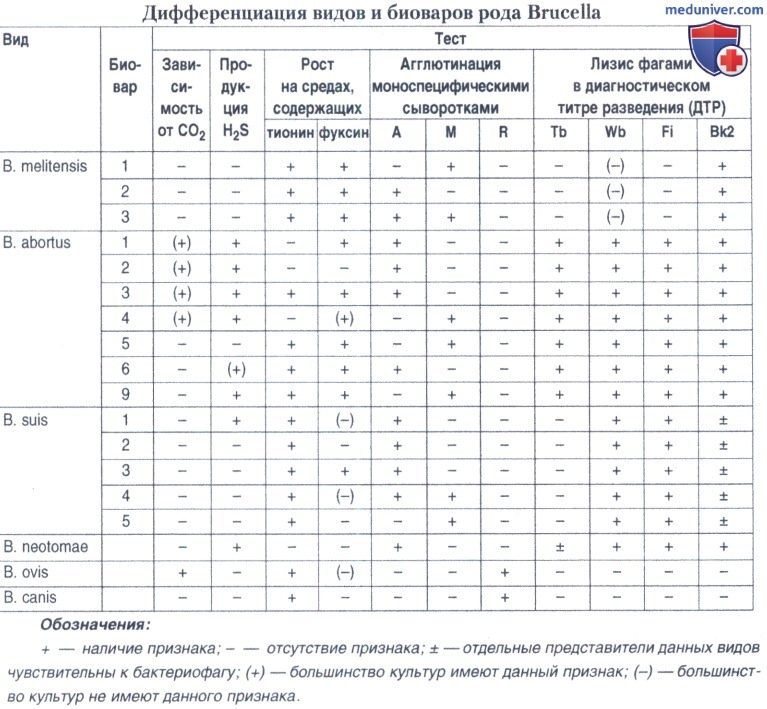
Тестами дифференциации бруцелл являются: изучение отношения культуры к избыточному содержанию CO2 в атмосфере; способность к продукции сероводорода; редуцирующая активность в отношении основных красителей (фуксин и тионин); агглютинация моноспецифическими сыворотками anti-abortus и antimelitensis; лизис бруцеллезными диагностическими бактериофагами Тб (Тбилиси), Bk2 (Berkley), Wb (Weybridge), Fi (Firenze).
В связи с тем, что критерии дифференциации штаммов-изолятов бруцелл разнообразны и свойства их колеблются в широких пределах, исследование выделенных культур проводится параллельно с исследованием референтных штаммов бруцелл биовара 1 трех основных видов: В. melitensis 16-М, В. abortus 544, В. suis 1330.
Поскольку для культур возбудителя бруцеллеза свойственно явление диссоциации, а бруцеллы видов В. ovis и В. canis в природе циркулируют в R-форме, этапу дифференциации должно предшествовать определение степени диссоциации с использованием тестов: проба с трипафлавином, реакция термоагглютинации.
б) Проба с трипафлавином. На предметном стекле ставят реакцию агглютинации исследуемой агаровой культуры с солевым (0,85%) раствором трипафлавина 1:500. У диссоциированных культур быстро (в течение 1-2 мин) наступает агглютинация с образованием хорошо выраженных хлопьев. Взвесь S-форм бруцелл остается гомогенной.
в) Реакция термоагглютинации. В 3-4 мл 0,9%-ного раствора натрия хлорида готовят взвесь двухсуточной агаровой культуры бруцелл в концентрации 1 х 109 микробных клеток/мл по отраслевому стандартному образцу мутности (ОСО 42-28-8511) ГИСК им Л.А. Тарасевича 10 единиц, пробирку подогревают на водяной бане при температуре 90°С в течение 30 мин. Результаты учитывают через 30; 60 мин и окончательно — через 24 ч пребывания при комнатной температуре. В эти сроки при наличии диссоциации наступает ярко выраженная агглютинация клеток бруцелл, тогда как суспензия бруцелл недиссоциированных S-штаммов остается гомогенной.
Дифференциации подлежат культуры бруцелл, находящиеся только в S-форме.
г) Отношение к избыточному содержанию углекислого газа. Культуры бруцелл видов В. suis и В. melitensis растут в аэробных условиях, тогда как первые генерации культур видов В. abortus и В. ovis удается выделить лишь в присутствии повышенного содержания углекислого газа в атмосфере (5-10%). При последующих пересевах культуры В. abortus утрачивают способность расти при повышенном содержании CO2 в атмосфере и растут в обычных условиях.
д) Способность к образованию сероводорода. Взвесь двухсуточной агаровой культуры бруцелл в 0,9% растворе натрия хлорида в концентрации 2x109 микробных клеток/мл по ОСО мутности (ОСО 42-28-85П) ГИСК им Л.А.Тарасевича 10 единиц засевают петлей диаметром 2 мм на агар, скошенный в пробирке. Сюда же под пробку помещают полоску фильтровальной бумаги, смоченную насыщенным раствором уксусно-кислого свинца (полоски можно заготовить заранее и высушить) так, чтобы ее свободный конец не касался посева.
Посевы инкубируют в термостате при температуре 37°С. Результаты учитывают через каждые 48 ч в течение 6 сут. Показателем образования сероводорода является почернение свободного края фильтровальной бумажки, которое измеряют в миллиметрах. При каждом учете почерневшую бумажку заменяют новой. Для окончательной оценки способности культур к образованию сероводорода все три показателя складывают. Для культур вида В. suis (биовар 1) суммарный показатель составляет примерно 12-20 мм, для В. abortus (биовар 1) — 5-7 мм, у культур В. neotomae показатель образования сероводорода равен 5-7 мм. Возбудитель бруцеллеза видов В. melitensis, В. ovis, В. canis сероводорода не образует.
Редуцирующую активность в отношении основных красителей (фуксина и тионина) определяют на плотных питательных средах. Основные растворы красок готовят в концентрации 1:1000 (0,1 г краски, 20 мл 96%-ного спирта и 80 мл дистиллированной воды). Обычно применяют красители в концентрации 20 мкг/мл среды, добавляя их перед розливом сред. Готовые среды можно хранить в холодильнике в течение 10-14 дней. Обесцвеченные среды применять нельзя.
Взвесь двухсуточной агаровой культуры бруцелл в 0,9%-ном растворе натрия хлорида концентрацией 2x109 микробных клеток/мл по ОСО мутности (ОСО 42-28-85П) ГИСК им Л.А.Тарасевича К) единиц засевают петлей диаметром 2 мм на питательный агар методом секторного посева. Посевы инкубируют при температуре 37°С. Результаты учитывают в течение 6 сут. Даже слабый рост на среде в месте нанесения культуры можно считать положительным результатом.
При этом культуры вида В. abortus биовара 1 растут на средах с фуксином; на средах с тионином рост отсутствует. Культуры вида В. suis биовара 1 растут на средах с тионином при отсутствии роста на средах с фуксином. Культуры вида В. melitensis растут на средах, содержащих оба красителя.
Для ускорения анализа можно использовать диски с красками, которые помещают на газон исследуемой культуры на плотной питательной среде.
е) Агглютинация моноспецифическими (А-, М- и R-) сыворотками. Готовят последовательные разведения моноспецифических сывороток A (anti-abortus) и М (antimelitensis) в 0,9%-ном растворе натрия хлорида в объеме 0,5 мл до их предельного титра (1:10; 1:20; 1:40 ...). В качестве антигена применяют взвесь двухсуточной агаровой культуры бруцелл изучаемых штаммов в концентрации 2x109 микробных клеток/мл по ОСО мутности (ОСО 42-28-8511) ГИСК им Л.А.Тарасевича 10 единиц в 0,9%-ном растворе натрия хлорида, которую в объеме 0,5 мл добавляют во все пробирки.
Реакцию ставят с двумя контролями: с эталонными штаммами В. abortus 544 и В. melitensis 16-М. Пробирки со смесью сыворотки и антигена выдерживают в термостате при температуре 37°С в течение 18—20 ч, а затем при комнатной температуре в течение 2 ч. Реакция учитывается визуально и считается положительной начиная с разведения 1:20, но не менее чем на 2 креста.
Культуры бруцелл вида В. melitensis (биовар 1) агглютинируются моноспецифической сывороткой anti-melitensis, культуры вида В. abortus (биовар 1) — сывороткой anti-abortus.
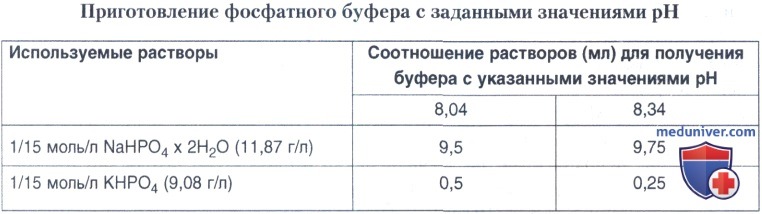
Для культур бруцелл видов В. ovis и В. canis, а также для культур других видов и биоваров ору цела, находящихся в R-форме, для реакции агглютинации используют моноспецифическую anti-R сыворотку. Техника постановки реакции аналогична, однако используют 0,9%-ный раствор натрия хлорида на фосфатном буфере (pH 8,2-8,4). Фосфатный буфер с заданным pH готовят по соответствующей схеме.
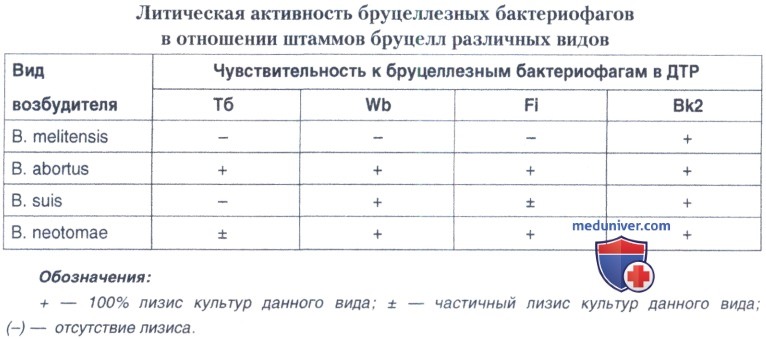
Чувствительность к бруцеллезным диагностическим бактериофагам. Используют бруцеллезные диагностические бактериофаги Тб, Bk2, Wb, Fi в ДТР. Для посева применяют взвесь двухсуточной агаровой культуры бруцелл в концентрации 2x109 микробных клеток/мл по ОСО мутности (ОСО 42-28-85П) ГИСК им Л.А.Тарасевича 10 единиц. Полученную взвесь в количестве 0,15—0,2 мл засевают либо газоном, после чего дорожкой наносят бактериофаги, либо полоской петлей 2 мм, после чего на полоску каплями наносят бактериофаги. Необходимым условием успешной постановки пробы с бактериофагами является подсушивание газона (полосок) культуры до нанесения фагов. Результаты учитываются через 36 ч инкубации посевов при температуре 37°С по четырехкрестовой системе:
- 4+ — сливной (полный) лизис;
- 3+ — полусливной лизис (незначительный рост культуры в зоне лизиса);
- 2+ — наличие в месте нанесения капли бактериофага свыше 10 негативных колоний;
- 1+ — менее 10 негативных колоний;
- отрицательный результат — отсутствие лизиса.
Положительной считают пробу при оценке не менее чем на два креста. При этом бруцеллы вида В. abortus лизируются всеми четырьмя бактериофагами, В. melitensis — только бактериофагом Вк2, В. suis — Вк2 и Wb, бактериофаг Fi лизирует культуры В. abortus, В. neotomae и частично В. suis. Культуры видов В. ovis и В. canis не лизируются бруцеллофагами.
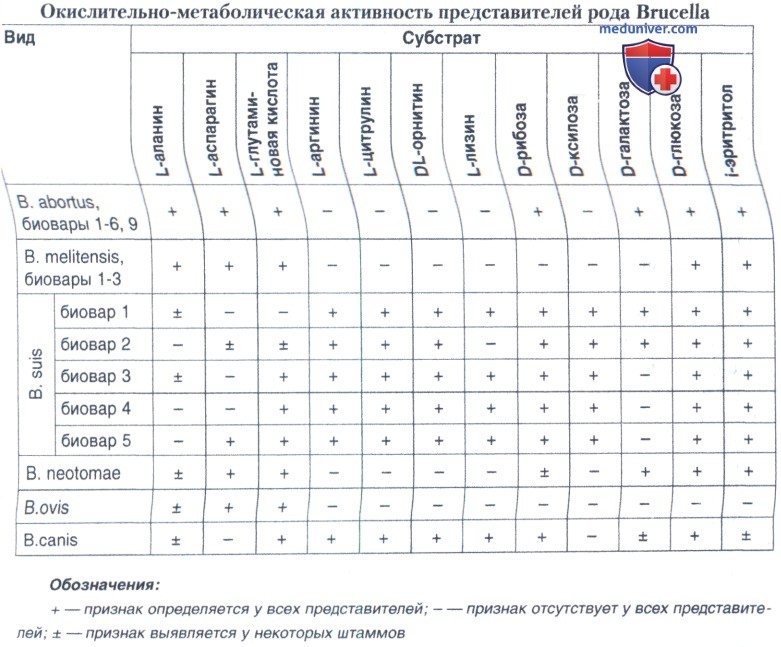
Перечисленные методы позволяют определить вид и биовар возбудителя бруцеллеза. Однако для более точного установления биовара проводится изучение окислительно-метаболической активности изучаемых культур в отношении 12 субстратов (L-аланин, L-аспарагин, L-глутаминовая кислота, L-аргинин, L-цитрулин, DL-орнитин, L-лизин, D-рибоза, D-ксилоза, D-галактоза, D-глюкоза, i-эритритол).
- Читать далее "ПЦР и выявление антигенов бруцелл (возбудителей бруцеллеза, Brucella)"
Редактор: Искандер Милевски. Дата публикации: 28.1.2020
- Бруцеллы (возбудители бруцеллеза, Brucella): морфология, культуральные, биохимические свойства
- Антигены и генетика бруцелл (возбудителей бруцеллеза, Brucella)
- Патогенез и клиника бруцеллеза
- Эпидемиология бруцеллеза
- Бактериоскопическая и бактериологическая диагностика бруцелл (возбудителей бруцеллеза, Brucella)
- Биологический метод диагностики бруцелл (возбудителей бруцеллеза, Brucella)
- Идентификация и дифференциация биоваров бруцелл (возбудителей бруцеллеза, Brucella)
- ПЦР и выявление антигенов бруцелл (возбудителей бруцеллеза, Brucella)
- Серологический метод диагностики бруцелл (возбудителей бруцеллеза, Brucella)
- Аллергологический метод диагностики бруцелл (возбудителей бруцеллеза, Brucella)
- Лечение и профилактика бруцеллеза
