Методика проведения реакции латекс-агглютинации (РЛА)
Реакция латекс-агглютинации (РЛА) является одним из видов реакции агглютинации, в которой в качестве носителя антигена или антитела используются синтетические полимерные (латексные) частицы.
Обычно иммунологически активный компонент адсорбируется на полимерных частицах (микросферах) за счет физического взаимодействия между молекулами антигенов (или антител) и поверхностью частиц, но может быть использовано и ковалентное связывание через соответствующие активные группы.
Такие сенсибилизированные латексные носители в присутствии гомологичного иммунореагента образуют агглютинат, хорошо видимый невооруженным глазом.
Впервые метод реакции латекс-агглютинации (РЛА) был предложен Severin V. и соавт. в 1956 г. и использован для определения ревматоидного фактора при помощи полистирольных латексных микросфер с узким распределением но размеру частиц, сенсибилизированных иммуноглобулином человека. Сообщалось, что взаимодействие антигенов, находящихся в сыворотке крови пациента, с иммуноглобулином, адсорбированным на поверхности гидрофобных микросфер суспензии, привело к агглютинации полимерных частиц и образованию крупных агломератов, легко различимых невооруженным глазом. В последующие годы метод РЛА получил широкое распространение как в клинических диагностических тестах, так и в биохимических и иммунологических исследованиях.
В настоящее время РЛА применяют как для определения количества антител к конкретному возбудителю, так и для диагностики наличия в биологических жидкостях бактериального, паразитарного или вирусного агента (антигена).
Для получения диагностических препаратов используют полистирольные латексные частицы, несущие на своей поверхности различные функциональные группы (карбоксильные, эпоксидные, альдегидные и др.) и полиакролеиновые, имеющие на своей поверхности альдегидные функциональные группы, способные вступать в реакцию с первичными аминогруппами. Все латексные диагностикумы (ЛД) по принципу работы делятся на две большие группы: антигенные и антительные. Антигенные ЛД на поверхности частиц латекса несут антигены возбудителя, антительные—антитела к конкретному возбудителю или группе возбудителей и используются для обнаружения последних в любых биологических жидкостях.
В нашей стране и за рубежом в настоящее время выпускают латексные коммерческие диагностические тест-системы, предназначенные как для обнаружения и идентификации микроорганизмов, так и для определения растворимых антигенов в биологических жидкостях.
Объектами исследования РЛА могут быть сыворотка крови, слюна, молозиво, моча, фекалии и др.
Многими исследователями отмечается высокая чувствительность и специфичность диагностических латексных тест-систем — перекрестные реакции, по опубликованным данным, составляют не более 1-3%. Имеются сообщения об успешном использовании латексных диагностикумов при выявлении антигенов пневмококка, гемофильной палочки и менингококка непосредственно в биологических жидкостях, стрептококков, золотистого стафилококка, антигенов синегнойной палочки, холеры, Clostridium difficile — в фекалиях, а также антигенов вируса краснухи, ротавирусов, адено- и герпесвирусов.
РЛА с использованием латексных диагностикумов ставятся как в планшетах для иммунологических реакций, так и на предметном стекле. Последние занимают мало времени и легко учитываются; они незаменимы при работе в полевых условиях и чаще всего используются для быстрого скрининга на наличие какого-либо заболевания.
РЛА особенно удобна для применения в качестве сигнального экспресс-теста для выявления антигенов в первые дни заболевания, когда еще не успел развиться иммунный ответ организма, и серологическая диагностика не дает положительного результата. К преимуществам РЛА можно отнести следующие:
— простота и быстрота выполнения;
— высокая специфичность и чувствительность;
— отсутствие необходимости в сложной аппаратуре для постановки и визуальный учет результатов;
— сведение к минимуму количества компонентов реакции;
— возможность получения инертных носителей с заданными характеристиками.
а) Постановка РЛА на предметном стекле с целью обнаружения антигена. На чистую обезжиренную стеклянную пластинку наносят по 1 капле (10-20 мкл) латексного диагностикума и исследуемого материала. В качестве контроля используют:
• культуру бактерии + гомологичный латексный диагностикум (положительный контроль);
• питательную среду для культивирования возбудителя + латексный диагностикум (отрицательный контроль);
• предметные стекла или специальные тест-пластины.
Компоненты в каждой капле тщательно перемешивают углом предметного стекла, используя каждый раз новый угол.
Учет результатов реакции проводят визуально через 2-3 мин после смешивания компонентов. В случае положительной реакции отмечают образование агглютинатов и просветление фона. При отрицательном результате реакции суспензия остается гомогенной, без хлопьев агглютината и без просветления фона.
Появление агглютината позднее, чем через 7-10 мин после постановки реакции, расценивают как неспецифический результат.

а — положительная реакция; б — отрицательная реакция (контроль).
б) Постановка РЛА с целью выявления антител в планшетах для иммунологических реакций. Для постановки реакции необходимы:
— диагностикум латексный антигенный;
— сыворотка крови обследуемых лиц;
— фосфатно-солевой буферный раствор (ФСБ), pH 7,2-7,4 или изотонический раствор натрия хлорида в качестве электролита;
— планшеты для иммунологических реакций с 96 лунками с круглым дном;
— микропипетки.
В один ряд лунок планшета (с первой по шестую) вносят по 0,05 мл ФСБ. Затем в первую лунку добавляют равное количество (0,05 мл) исследуемой сыворотки больного в разведении 1:25 (0,1 мл цельной сыворотки + 2,4 мл ФСБ), перемешивают и путем последовательных переносов титруют до пятой лунки. Из последней удаляют 0,05 мл смеси, чтобы количество разведенной сыворотки было одинаковым во всех лунках. Затем вносят по 0,05 мл 0,05% раствора известного латексного диагностикума в лунки 1-6. Контролем диагностикума на отсутствие спонтанной агглютинации служит шестая лунка, в которой содержится только диагностикум и ФСБ. Схема постановки такой реакции представлена в таблице ниже.
Планшет осторожно встряхивают и оставляют при комнатной температуре на 18-20 ч.
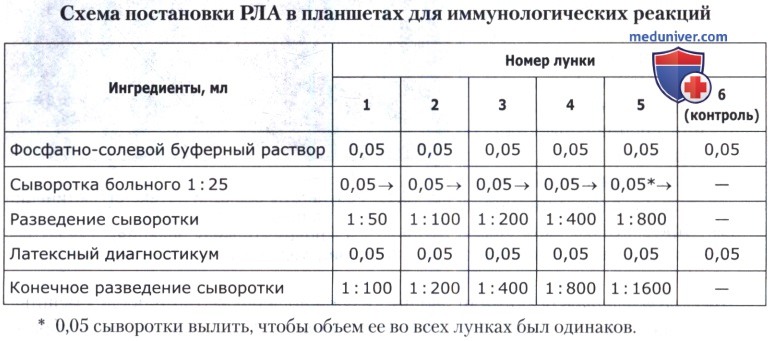
Учет результатов начинают с контролей. Затем оценивают диагностические реакции по четырехплюсовой системе:
++++ резко положительная реакция (полная агглютинация); все частицы латекса равномерно выстилают дно лунки в виде перевернутого зонтика с неровными краями;
+++ положительная реакция с неполной агглютинацией; частицы латекса покрывают дно лунки в виде слегка спавшегося перевернутого зонтика, в центре которого просматривается небольшое кольцо частиц, не вступивших в реакцию;
++ частичная агглютинация. Агглютинат в виде широкой зоны вокруг четкого кольца частиц латекса, не вступивших в реакцию;
+ слабая сомнительная агглютинация; частицы латекса, не вступившие в агглютинацию, оседают на дно лунки в виде широкого кольца, вокруг которого узкий ободок агглютината;
- отрицательная реакция; осадок частиц латекса в центре лунки в виде компактного диска (пуговки).
Титром антител считают разведение сыворотки, в котором РПГА положительна не менее чем на +++ в самом большом разведении при полном отсутствии агглютинации в отрицательном контроле.
- Читать далее "Методика проведения реакции коагглютинации (КОА)"
Редактор: Искандер Милевски. Дата публикации: 17.08.2019
- Определение функциональной активности лейкоцитов
- Оценка гуморального иммунитета
- Методы серодиагностики инфекционных болезней: реакция агглютинации
- Методика проведения реакции Кумбса (антиглобулинового теста)
- Методика проведения реакции пассивной гемагглютинации (РПГА)
- Методика проведения реакции торможения пассивной гемагглютинации (РТПГА)
- Методика проведения реакции латекс-агглютинации (РЛА)
- Методика проведения реакции коагглютинации (КОА)
- Методика проведения реакции кольцепреципитации
- Методика проведения простой (одиночной) линейной иммунодиффузии по Удену (J. Oudin, 1946)
