Патогенез инфекционного эндокардита (ИЭ)
Взаимодействие между организмом человека и микроорганизмами при инфекционном эндокардите (ИЭ) достигает кульминации и затрагивает сосудистый эндотелий, гемостатические механизмы, иммунную систему организма-хозяина, большие анатомические аномалии в сердце, поверхностные свойства микроорганизмов, энзимы и токсины, продуцируемые микроорганизмами и периферические события, которые инициируют бактериемию. Каждый компонент подвергается влиянию многих факторов.
В случае нарушения взаимодействия микроорганизмы попадают в кровоток, прилипают к поверхностям клапана и размножаются, приводя к локальному повреждению и росту вегетаций, и быстро диссеминируют гематогенным путем с эмболиями или без них. В настоящее время проходят исследования по изучению патогенеза инфекционного эндокардита (ИЭ), вызванного зеленящим стрептококком и S. aureus. Редкость эндокардита, несмотря на частую бактериемию, свидетельствует о том, что интактный эндотелий относительно устойчив к инфекции.
Существует гипотеза, что спонтанно появившиеся тромбоцитарно-фибриновые депозиты на измененных клапанах и в местах повреждения эндотелия сердца или воспаления (асептический тромботический эндокардит, АСТЭ) являются местами, к которым во время бактериемии прилипают микроорганизмы, что и способствует развитию инфекционного эндокардита (ИЭ).
а) Развитие асептического тромботического эндокардита (АСТЭ). Определяющими механизмами формирования АСТЭ являются повреждение эндотелия и гиперкоагуляция. АСТЭ, который предположительно был результатом гиперкоагуляции, обнаружен при аутопсии в 1,3% случаев. Частота АСТЭ растет с увеличением возраста больного, у пациентов со злокачественными новообразованиями, диссеминированным внутрисосудистым свертыванием, уремией, ожогами, системной красной волчанкой (СКВ), пороками клапанов сердца и внутрисердечными катетерами.
АСТЭ локализуется на линии соприкосновения створок клапана при их закрытии, на предсердных поверхностях митрального и трехстворчатого клапанов и на желудочковых поверхностях АК и клапана ЛА, мест инфицированных вегетаций у пациентов с ИЭ.
Повреждать эндотелий, способствуя развитию АСТЭ, могут три гемодинамических фактора:
(1) высокоскоростная струя крови;
(2) кровоток из полости с высоким давлением в полость с низким давлением;
(3) кровоток через узкое отверстие с высокой скоростью.
При бактериемии кровоток через суженное отверстие заносит бактерии в полость сердца с низким давлением, где они сразу оседают вследствие эффекта Venturi позади или в месте, куда попадает струя крови. Это те же места, где формируется АСТЭ в результате повреждения эндотелия или гиперкоагуляции. Развитие АСТЭ и оседание циркулирующих бактерий объясняет локализацию инфицированных вегетаций.
б) Трансформация асептического тромботического эндокардита (АСТЭ) в инфекционный эндокардита (ИЭ). Бактериемия является фактором, который способен трансформировать АСТЭ в ИЭ. Частота и степень бактериемии зависят от ежедневной активности и медицинских процедур, затрагивающих слизистые оболочки и кожу, а также от плотности колонизации бактерий, состояния кожного покрова и степени местной травмы. Степень бактериемии наивысшая в случаях повреждения слизистой полости рта, особенно десен, и возрастает при процедурах, вовлекающих мочеполовой тракт и ЖКТ. Инфицирование поверхности ассоциируется с повышенным риском бактериемии.
Для развития АСТЭ микроорганизмы должны быть резистентны к комплемент-связывающей бактерицидной активности сыворотки.
Прилипание микроорганизмов к месту локализации АСТЭ или эндотелию клапана — центральное раннее событие в развитии ИЭ. Посредниками прилипания бактерий к внеклеточному матриксу организма-хозяина или эндотелию клапана выступают молекулы бактериальной поверхности — адгезины. Адгезины — это микробиологические поверхностные компоненты, распознающие адгезивные матриксные молекулы. Стрептококки, которые продуцируют поверхностные полисахариды, называемые декстраном или глюканами, вызывают эндокардит чаще, чем другие виды, не продуцирующие декстран. В эксперименте декстран способствует прилипанию стрептококков к тромбоцитарно-фибриновым решеткам и поврежденным клапанам и облегчает развитие эндокардита.
Продукция декстрана, однако, не является универсальной среди главных причин ИЭ, вероятно, существуют и другие механизмы адгезии. Например, белок Fim А, продуцируемый Streptococcus parasanguis, принадлежит к семейству адгезинов слизистой полости рта зеленящих стрептококков и способствует прилипанию к фибрину и развитию экспериментального эндокардита.
Фибронектин — важный фактор в патогенезе инфекционного эндокардита (ИЭ) — идентифицируется на пораженных клапанах сердца и продуцируется эндотелиальными клетками, тромбоцитами и фибробластами в ответ на сосудистое повреждение. Растворимая форма фибронектина связывается с фибриногеном и фибрином, обнажая субэндотелиальный коллаген. Рецепторы для фибронектина есть на поверхности S. aureus, зеленящих стрептококков, стрептококков групп А, С и G, энтерококков, S. pneumoniae и С. albicans. Фибронектин имеет множество связывающих областей и может связывать одновременно фибрин, коллаген, клетки и микроорганизмы, облегчая прилипание бактерий к клапану в месте повреждения или к месту локализации АСТЭ. Фибронектин-связываюгцие белки А и В S. aureus участвуют в индукции экспериментального эндокардита.
При экспериментальном эндокардите фибриноген-связывающий поверхностный белок S. aureus также служит посредником адгезии этих микроорганизмов к тромбоцитарно-фибриновым тромбам или АК.
Гликокаликс или слизь на поверхности S. epidermidis, по-видимому, как адгезии не функционирует, но может делать микроорганизмы более вирулентными, увеличивая их способность избегать уничтожения защитными силами организма.
Механизм, с помощью которого вирулентные микроорганизмы колонизируют и инфицируют эндотелий интактного клапана, менее ясен. У пожилых людей склероз дегенеративно измененного клапана может сопровождаться локальным воспалением, что, в свою очередь, может способствовать экспрессии эндотелиальными клетками интегринов, которые связывают фибронектин и другие внеклеточные матриксные молекулы. Способствовать экспрессии интегринов может корпускулярный материал (материал, содержащий твердые частицы), который вводят инъекционные наркоманы. Изменения эндотелия могут способствовать прилипанию S. aureus посредством микробиологических поверхностных компонентов, распознающих адгезивные матриксные молекулы, к нормальным клапанам. Адгезию S. aureus провоцирует его собственная интернализация интактными эндотелиальными клетками.
В результате внутриклеточного размножения микроорганизмов клетки гибнут, что, в свою очередь, приводит к нарушению целостности эндотелиальной поверхности, инициирует образование громбоцитарно-фибриновых депозитов и создает дополнительные места для адгезии бактерий и развития ИЭ.
Для развития инфекционного эндокардита (ИЭ) нужно, чтобы бактерии после адгезии к месту локализации АСТЭ или эндотелию накопились и стали размножаться. Резистентность зеленящих стрептококков и S. aureus к антимикробным белкам тромбоцитов объясняет повышенную способность этих микроорганизмов вызывать экспериментальный эндокардит. Персистенция и размножение бактерий обусловливают сложный динамический процесс, в течение которого инфицированные вегетации увеличиваются в размерах за счет тромбоцитарно-фибриновой агрегации, микроорганизмы размножаются и попадают в кровоток и развиваются эмболии фрагментами вегетаций.
Поверхностные белки стафилококков и стрептококков связываются с тромбоцитами и способствуют агрегации и росту вегетаций. Микроорганизмы, способные обеспечивать связывание и агрегацию тромбоцитов, являются наиболее вирулентными в экспериментальных моделях. Кроме того, стрептококки и стафилококки повышают местную прокоагулянтную активность, индуцируя фибрин-адгезивные моноциты к выработке тканевого фактора (тканевого тромбопластина, который связывается с активированным фактором VII, запуская процесс коагуляции). S. aureus также может индуцировать продукцию тканевого фактора эндотелиальными клетками, что способствует развитию эндокардита на нормальных клапанах.
Множественное повторение цикла от прилипания до размножения и формирования ромбоцитарно-фибриновых депозитов приводит к клинически выраженному инфекционному эндокардиту (ИЭ).
Помимо общих симптомов инфекции, которые, вероятно, обусловлены цитокинами, клинические проявления ИЭ являются следствием:
(1) локальных деструктивных эффектов внутрисердечной инфекции;
(2) эмболий мягкими или септическими фрагментами вегетаций в отдаленные области, приводящих к инфаркту или инфекции;
(3) гематогенной диссеминации отдаленных областей во время продолжающейся бактериемии;
(4) ответа антител на инфицирующие микроорганизмы с последующим повреждением тканей, обусловленным отложением сформированных иммунных комплексов или взаимодействием комплекса антитело-комплемент с антигенами, отложенными в тканях.
Внутрисердечные последствия инфекционного эндокардита (ИЭ варьируют от инфицированных вегетаций без сопутствующего повреждения тканей до инфекции, разрушающей клапаны и прилежащие структуры. Последствием деформации и перфорации створок клапана, разрывов сухожильных хорд и перфорации или фистулы между полостями сердца или крупными сосудами либо между самими полостями сердца может стать прогрессирование ХСН. Инфекция может распространиться в ткань около клапанов и привести к абсцессам и постоянной лихорадке, связанной с антибиотикорезистентной инфекцией, нарушению проводимости с соответствующими признаками на ЭКГ, клинически выраженным аритмиям и гнойному перикардиту. При больших вегетациях, особенно на МК, возможны функциональный стеноз клапана и ухудшение гемодинамики.
Внутрисердечные осложнения, вовлекающие АК, развиваются быстрее, чем поражающие МК, однако прогрессирование инфекции является чрезвычайно вариабельным и непредсказуемым процессом у конкретных пациентов.
Клинически явные эмболии наблюдаются у 11-43% пациентов. Патологические признаки эмболий на аутопсии отмечаются чаще (от 45 до 65%). У инъекционных наркоманов с ИЭ трехстворчатого клапана легочные эмболии, которые часто являются септическими, диагностируют в 66-75% случаев. ИЭ, вызванный вирулентными микроорганизмами, особенно S. aureus, β-гемолитическим стрептококком или другими пиогенными микроорганизмами, чаще осложняется диссеминацией инфекции с локальными признаками и симптомами или постоянной лихорадкой на фоне проводимой терапии, чем ИЭ, вызванный авирулентными бактериями (например, зеленящим стрептококком). Предполагать наличие диссеминации особенно важно, если необходима другая терапия помимо антибиотиков, показанных для ИЭ (например, когда при абсцессе нужно дренирование или при менингите — антибиотики, проникающие в спинномозговую жидкость).


(Б) Протез Starr—Edwards, удаленный из аортальной позиции. Большая вегетация, связанная с инфекцией Aspergillus spp.,
частично суживала путь оттока и создала регургитацию, препятствующую закрытию клапана.

В центре вегетации находится тромб, закрывающий перфорацию клапана.
- Возврат в раздел сайта "кардиология"
Оглавление темы "Инфекционный эндокардит.":- Инфекционный эндокардит - эпидемиология, группы риска
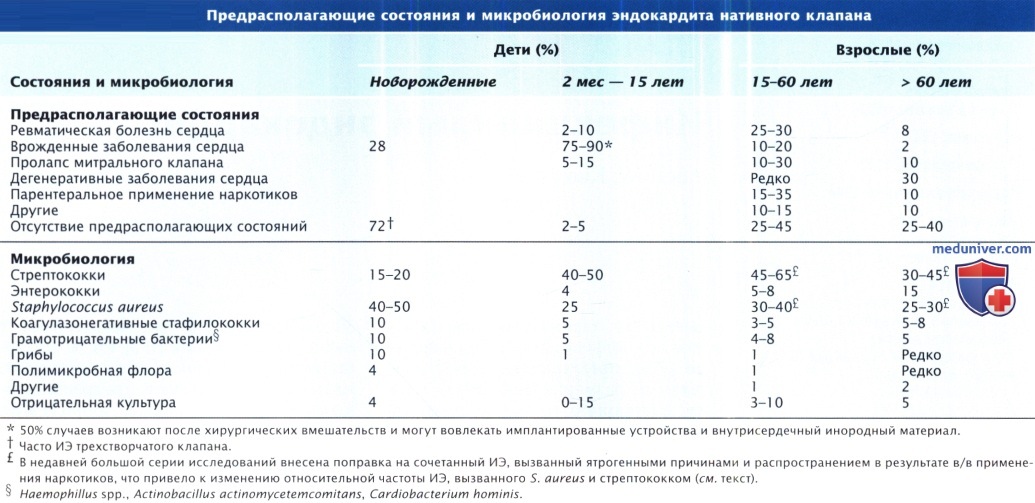
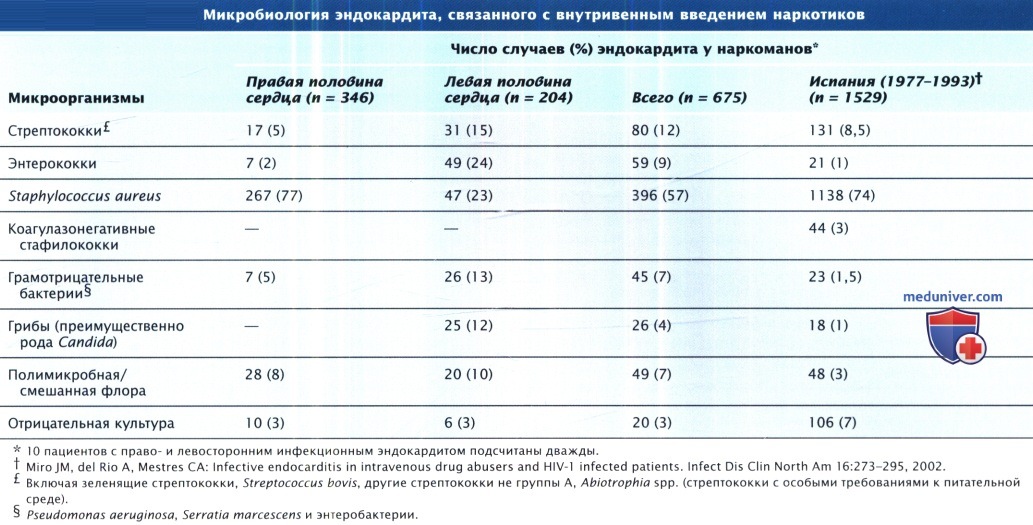
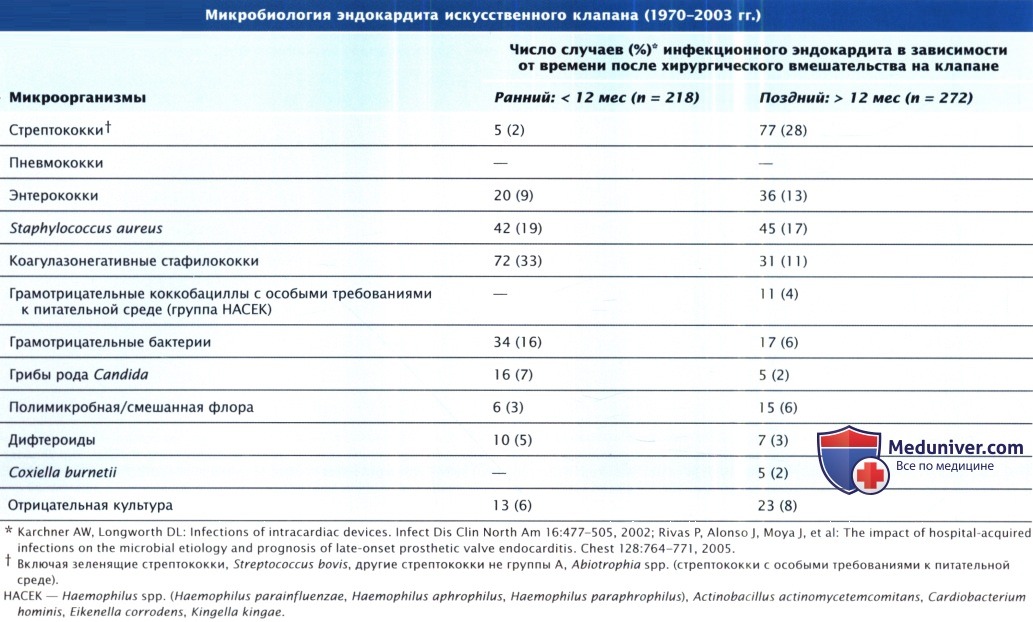
- Микробы, грибы вызывающие инфекционный эндокардит
- Патогенез инфекционного эндокардита (ИЭ)
- Симптомы и клиника инфекционного эндокардита (ИЭ)
- Анализы и алгоритм диагностики инфекционного эндокардита (ИЭ)
- Антибиотики для лечения инфекционного эндокардита (ИЭ)
- Операция на сердце при осложнениях инфекционного эндокардита
- Техника и сроки устранения внутрисердечных дефектов при инфекционном эндокардите
- Лечение внесердечных осложнений инфекционного эндокардита
- Эффективность лечения инфекционного эндокардита
- Меры профилактики инфекционного эндокардита
- Рекомендации American Heart Association по профилактике инфекционного эндокардита
