Возбудитель туляремии (Francisella tularensis): морфологические, культуральные и биохимические свойства
Туляремия — острое инфекционное заболевание зоонозной природы, эпидемический процесс при котором характеризуется обилием источников, многофакторностью путей передачи, полиморфизмом клинических проявлений. Природные очаги туляремии широко распространены на территории России, а также в других регионах мира (в пределах умеренного климатического пояса северного полушария).
Основными источниками возбудителя туляремии являются дикие грызуны, зайцеобразные; передача возбудителя инфекции осуществляется через клещей, кровососущих двукрылых, других эктопаразитов, а также через воду и различные субстраты, загрязненные возбудителем.
Туляремийные бактерии отличаются высокой экологической пластичностью и способны циркулировать среди широкого круга животных, как позвоночных, так и беспозвоночных. Они могут длительно сохраняться во внешней среде, особенно в воде, при низких температурах.
Механизмы и пути передачи возбудителя инфекции весьма разнообразны: контактный (через кожные покровы или слизистую оболочку глаза), инокулятивный, или трансмиссивный (через кожные покровы при укусе членистоногого или млекопитающего), алиментарный (через пищеварительный тракт) и аспирационный (через дыхательные пути). Отличительной особенностью туляремии является практически 100%-ная восприимчивость человека к инфекции без различия пола и возраста при небольших инфицирующих дозах, а также отсутствие контагиозности, что исключает формирование внутрибольничной патологии и не требует карантина.
Современной эпидемиологической особенностью туляремии стало появление заболеваний среди городских жителей, доля которых в общей структуре заболеваемости достигла 70-75%, а также высокий (10-30%) уровень заболеваемости детей до 14 лет — контингента, не подвергаемого специфической профилактике живой туляремийной вакциной.
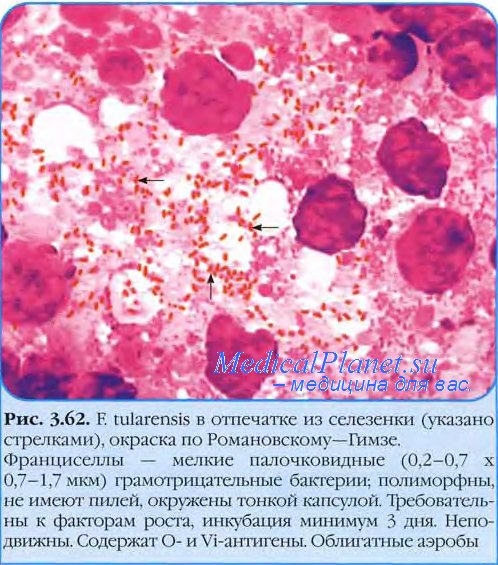
а) Морфологические, культуральные и биохимические свойства возбудителя туляремии (Francisella tularensis). Возбудитель туляремии Francisella tularensis — мелкая (0,2x0,2-0,7 мкм), грамотрицательная, неподвижная, не образующая спор коккобактерия, которая отличается полиморфизмом и является факультативным анаэробом. В окрашенных мазках из 24-48-часовой культуры на плотных питательных средах обычно обнаруживаются кокковидные клетки диаметром 0,3-0,5 мкм, располагающиеся одиночно или группами. На жидких питательных средах чаще вырастают слегка удлиненные палочки того же диаметра. В тканях животных возбудитель встречается как в виде кокков, так и коккобактерий. Электронно-микроскопические исследования подтвердили выраженный полиморфизм туляремийных бактерий: наряду с особями диаметром 0,3-0,5 мкм наблюдались более мелкие формы диаметром 0,15 мкм и мельче. Вокруг клеток выявлялся капсулоподобный слизистый покров толщиной до 60-80 нм. Возбудитель туляремии обладает гладкоконтурной внешней мембраной. Нуклеоид занимает 50-60% объема клетки. Цитоплазма представлена рибосомами, полисомами, фибриллярными и глобулярными биополимерами. Бактерии размножаются, как правило, почкованием.
Туляремийные бактерии — внутриклеточные микроорганизмы, приспособленные к строго паразитическому образу жизни; отличаются прихотливостью при культивировании на искусственных питательных средах и не растут на обычных мясопептонном агаре и бульоне, что служит одним из признаков F. tularensis при идентификации возбудителя. Рост можно получить лишь на более богатых питательными веществами средах, особенно при добавлении крови и яичного желтка. Оптимальная температура для выращивания туляремийных бактерий 36-37°С, при более низких температурах размножение бактерий замедляется, а при 20°С и ниже — прекращается. Оптимальная концентрация водородных ионов для F.tularensis находится в диапазоне 6,8-7,2.
Наиболее практичной и часто применяемой средой для выделения и культивирования туляремийного микроба является свернутая желточная среда. Посевы на нее могут быть произведены методом отпечатков кусочками органов или путем тщательного втирания кусочка органа в поверхность среды. При обильном засеве рост туляремийных бактерий появляется в виде сплошного роста уже через 18-24 ч инкубирования при 37°С, а при малом количестве бактерий отдельные колонии становятся заметными на 3-5-е сутки и позднее. Посевы следует выдерживать в термостате до 10-12 сут. По внешнему виду рост туляремийных бактерий на желточной среде резко отличается от роста большинства других бактерий: имеет вид извилистого слегка блестящего (сухого) почти бесцветного нежного налета.
Для выделения и культивирования туляремийного микроба используют также агаровую среду с добавлением желтка.
Для культивирования туляремийных бактерий применяются различные варианты агаровых сред лабораторного изготовления на рыбных, мясных, дрожжевых основах с обязательным добавлением цистина (цистеина) — 0,1%, глюкозы — 1%, дрожжевого экстракта (источник витамина В). Чувствительность агаровых сред можно повысить добавлением дефибринированной кроличьей или лошадиной крови (5-10%). На свежей агаровой среде приживаются единичные бактерии; при этом формируются колонии, которые становятся заметными через 2-3 сут. инкубации, редко в более отдаленные сроки. Посевы следует выдерживать при 37"С до 10-12 сут. При посеве взвеси из тканей животного агаровые среды позволяют обнаруживать единичные бактерии.
Разработаны и используются на практике коммерческие питательные сухие агаровые среды, содержащие все необходимые факторы роста и не требующие добавления крови или желтка: питательная среда, элективная, для выделения возбудителя туляремии, сухая (АДЭТ) производства Ростовского-на-Дону НИПЧИ; питательная среда для культивирования и выделения туляремийного микроба (FT); основа питательной среды для культивирования туляремийного микроба, сухая, производства НИПЧИ Сибири и Дальнего Востока (Иркутск).
б) Биохимические свойства возбудителя туляремии (Francisella tularensis). Туляремийные бактерии относительно слабо ферментируют сахара и спирты с образованием кислоты, но не газа. Для определения ферментативной активности применяют жидкие среды специального состава. Все штаммы F. tularensis ферментируют глюкозу, мальтозу, маннозу, левулезу, фруктозу, галактозу и не ферментируют сахарозу (исключение — F. tularensis subsp.novicida), лактозу, ксилозу, арабинозу, рибозу, рамнозу, маннит и др.). Отличительной особенностью F. tularensis subspp. tularensis, novicida, mediasiatica является способность ферментировать глицерин. Этот признак используется для дифференциации подвидов возбудителя.
в) Устойчивость к факторам внешней среды, антибиотикам возбудителя туляремии (Francisella tularensis). Возбудитель туляремии обнаруживает значительную устойчивость во внешней среде, особенно при низких температурах. Так, бактерии вирулентных штаммов выживали в стерильной речной воде при температуре 1°С до 9 мес., при 4°С — до 5 мес., а при 20-25°С — до 2 мес. Во влажной почве бактерии сохраняют жизнеспособность при 23-25°С до 2,5 мес., а при 4°С — свыше 4 мес. При подсыхании почвы сроки сохранения бактерий сокращаются до 10 сут. В замороженных трупах животных возбудитель сохраняется 6 мес.; с повышением температуры эти сроки сокращаются, и при температуре 20-25°С возбудитель обнаруживается на протяжении не более 10 сут.
Солнечные лучи убивают туляремийные бактерии при прямом воздействии в течение 20-30 мин, тогда как при рассеянном свете микробы сохраняются в течение нескольких дней. Ультрафиолетовая радиация, ионизирующее излучение, а также кипячение убивают туляремийные бактерии за несколько минут как в культуре, так и в инфицированных тканях животных.
Туляремийные бактерии нестойки к дезинфицирующим веществам: 2-3%-ный раствор лизола, 3-5%-ный раствор фенола, 1-3%-ный раствор хлорамина и др. убивают бактерии во взвеси в течение 2-5 мин. Однако трупы экспериментальных животных следует погружать в эти растворы на 1 сут. после чего подвергать автоклавированию и сжиганию. Формальдегид обладает сильным бактерицидным действием на возбудитель туляремии: 0,1% раствор формалина убивает густые взвеси за 2 ч и используется для инактивации бактерий при приготовлении туляремийных диагностикумов. Весьма чувствительны туляремийные бактерии к этиловому спирту: в 40-96%-ной концентрации он вызывает гибель бактерий во взвеси в течение 1-5 мин.
Возбудитель туляремии обнаруживает высокую чувствительность ко многим антибактериальным препаратам: стрептомицину, биомицину, тетрациклину, гентамицину, амикацину, рифампицину, циклофлоксацину, доксициклину. Пенициллин, ампициллин, полимиксин, линкомицин, а также сульфаниламиды не оказывают антибактериального действия на возбудитель туляремии, поэтому указанные препараты с успехом добавляют в селективные питательные среды с целью подавления роста сопутствующей микрофлоры.
г) Биологические модели. При изучении различных аспектов туляремийной инфекции — патогенеза, иммунитета, лабораторной диагностики в качестве экспериментальных моделей широко используют лабораторных животных (мышей, морских свинок, белых крыс, кроликов). Выбор экспериментальной модели осуществляют в соответствии с задачами исследования, исходя из степени восприимчивости и чувствительности к туляремии лабораторных животных. Так, мыши и морские свинки обладают высокой чувствительностью к туляремии (первая группа). Инфекционный процесс у этих животных протекает остро и приводит, как правило, к летальному исходу даже при заражении единичными бактериями.
Это делает их незаменимыми животными для биопроб и определения вирулентности вновь изолируемых штаммов. Особенности течения туляремии у морских свинок позволяют моделировать патогенез инфекции при различных способах заражения (накожном, подкожном, алиментарном, аэрогенном) и получить экспериментальное обоснование классификации клинических форм этого заболевания. Крысы и домашние кролики восприимчивы, но малочувствительны к туляремии (вторая группа), погибают лишь при заражении массивными дозами возбудителя (DCL ≥ 109 мк).
Возможность воспроизведения у кроликов инфекционного процесса, заканчивающегося выздоровлением, делает их удобной моделью при изучении динамики иммунологических реакций, получении иммунных сывороток к различным штаммам и антигенам. Морские свинки и крысы — общепринятые биологические модели для иммунологических исследований — изучения особенностей иммунитета при вакцинации живой туляремийной вакциной, определения клеточного и гуморальногшо иммунитета. Морских свинок используют также для оценки эффективности профилактических (вакцина) и диагностических (тулярин) препаратов. Имеются данные о моделировании легочной туляремии на обезьянах.
- Читать далее "Факторы патогенности и генетика возбудителя туляремии (F. tularensis)"
Редактор: Искандер Милевски. Дата публикации: 28.1.2020
- Возбудитель туляремии (Francisella tularensis): морфологические, культуральные и биохимические свойства
- Факторы патогенности и генетика возбудителя туляремии (F. tularensis)
- Клинические проявления туляремии
- Иммунитет при туляремии
- Эпидемиология туляремии
- Аллергические методы диагностики туляремии
- Серологические методы диагностики туляремии
- Бактериологический метод диагностики туляремии
- Биологический метод диагностики туляремии
- Эпизоотологические исследования туляремии
- Лечение и профилактика туляремии
