Выявление и определение количества бактерий группы кишечных палочек (колиформных бактерий) в пищевых продуктах
ГОСТР 50474-93 (идентичен ГОСТу 30518-97) Продукты пищевые. Методы выявления и определения количества бактерий группы кишечных палочек (колиформных бактерий);
ГОСТ 29184-91 Методы выявления и определения количества бактерий семейства ENTEROBACTERIACEAE;
ГОСТ 7702.2.2-93 Мясо птицы, субпродукты и полуфабрикаты птичьи. Методы выявления и определения количества бактерий группы кишечных палочек (колиформных бактерий родов Escherichia, Citrobacter, Enterobacter, Klebsiella, Serratia);
ГОСТ 9958-81 Колбасные изделия и продукты из мяса. Методы бактериологического анализа;
ГОСТ 9225-84 Молоко и молочные продукты. Методы микробиологического анализа;
ГОСТ 30364.2-96 Продукты яичные. Методы микробиологического контроля.
ГОСТ 21237-75 Мясо. Методы бактериологического анализа. ГОСТ 20235.2-74 Мясо кроликов. Методы бактериологического анализа.
ГОСТ 30425-97 Консервы. Метод определения промышленной стерильности.
Методические указания МЗ СССР 4.2.012-82.
ГОСТ 30518-97/Р 50474-93 Продукты пищевые. Методы выявления и определения количества бактерий группы кишечных палочек (колиформных бактерий).
ГОСТ 30726-2001 Продукты пищевые. Методы выявления и определения количества бактерий вида Escherichia coli.
а) Выявление колиформных бактерий в определенной навеске продукта. Для посева используется то количество продукта, в котором, в соответствии с установленными нормами, предусматривается отсутствие бактерий группы кишечных палочек (БГКП). При определении присутствия (отсутствия) колиформных бактерий в определенной навеске продукта или его эквивалентном разведении эту навеску (или разведение) вносят в одну из следующих питательных сред (бульон лактозный с бриллиантовым зеленым и желчью, бульон Мак-Конки, среда Кесслера) в двух повторностях. В ряде случаев, помимо перечисленных сред, допускается использование сред Хейфеца (при исследовании яичных продуктов, колбасных изделий и изделий из мяса, мяса птицы, субпродуктов и полуфабрикатов птичьих). При посеве соотношение между количеством высеваемого продукта (или его разведением) и питательной средой должно составлять 1:9, а для сред двойной концентрации—1:1.
При анализе очень кислых продуктов возможно существенное снижение pH питательной среды (на 0,5 и более единиц), обусловленное внесением в нее такого продукта (или его разведения). Поэтому в подобных случаях pH среды обязательно доводят до допустимого значения при помощи стерильного раствора гидроокиси натрия (100 г/дм3).
Посевы культивируют при 36(±1)°С в течение 24-48 ч. Через 24(±3) ч проводят предварительный учет и отмечают положительные посевы. Окончательный учет проводят через 48(±3) ч. Положительными считают посевы, в которых отмечены признаки интенсивного роста микроорганизмов — помутнение среды, образование газа, изменение цвета среды, свидетельствующее о ее подкислении. При отсутствии признаков роста (газообразования или изменения цвета среды) делают заключение о соответствии исследуемого продукта нормативу.
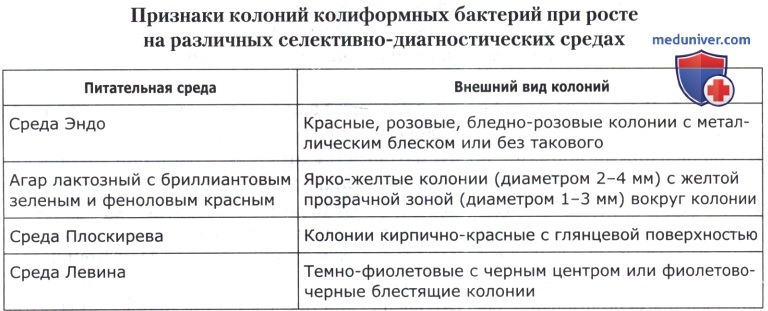
При необходимости для подтверждения принадлежности выделенных микроорганизмов к колиформным бактериям производят высев из жидких сред штрихами на поверхность агаризованных селективно-диагностических сред (агар лактозный с бриллиантовым зеленым и феноловым красным, среда Эндо). В ряде случаев помимо перечисленных сред допускается также использование сред Левина (при исследовании мяса, мяса кроликов, колбасных изделий и продуктов из мяса, мяса птицы, субпродуктов и полуфабрикатов птичьих) и Плоскирева (при исследовании мяса, мяса кроликов, колбасных изделий и продуктов из мяса). Описание колоний, характерных для колиформных бактерий, приведено в таблице ниже. Из посевов отбирают не менее чем по пять характерных колоний.
Из каждой выбранной колонии готовят мазки и окрашивают их по Граму. К колиформным бактериям относятся аэробные и факультативно-анаэробные, не образующие спор грамотрицательные палочки, сбраживающие лактозу с образованием кислоты и газа. Результат считают положительным при обнаружении хотя бы одной колонии колиформных бактерий.
б) Определение количества колиформных бактерий посевом на агаризованные селективно-диагностические среды. Метод используется для анализа пищевых продуктов, содержащих в 1 г твердого продукта более 1500 либо в 1 см3 жидкого продукта (или смыва) более 150 КОЕ колиформных бактерий.
1. Первый способ. По 0,1 или 0,2 см3 навески продукта или его разведения (либо смыва) наносят на поверхность подсушенной плотной селективно-диагностической среды (агар лактозный с бриллиантовым зеленым или среда Эндо), разлитой в две параллельные чашки Петри. Посевной материал немедленно равномерно растирают по поверхности среды стеклянным шпателем. Засеянную поверхность подсушивают, выдерживая чашки в горизонтальном положении в течение 15 мин.
Затем чашки переворачивают дном вверх и инкубируют при температуре 36(±1) °С в течение 24-48 ч. По окончании срока инкубации посевы просматривают и отмечают рост характерных колоний. Отбирают для дальнейшего анализа чашки, на которых выросло от 15 до 150 характерных колоний. Для подтверждения принадлежности выделенных микроорганизмов к колиформным бактериям отбирают не менее чем по пять подозрительных колоний. Из каждой отобранной колонии готовят мазки и окрашивают их по Граму. Колиформные бактерии являются грамотрицательными палочками. Если подтверждается, что из выбранных пяти колоний не менее четырех характерных колоний (т. е. не менее 80 %) можно отнести к колиформным бактериям, то считают, что все характерные колонии на чашке Петри принадлежат к этим бактериям. В остальных случаях количество колиформных бактерий определяют исходя из процентного отношения подтвержденных колоний к общему количеству характерных колоний, взятых для подтверждения.
Пересчет количества колиформных бактерий на 1 г (см3) продукта осуществляют по формуле:
M = NC/m.
где М—количество микроорганизмов в 1 г (см3) продукта;
N — степень разведения навески;
m — количество инокулята, внесенное для посева в чашку Петри;
С — округленное среднеарифметическое значение числа колоний.
Конечный результат вычисления выражают числом от 1,0 до 9,9x10n.
2. Второй способ. Используют метод мембранных фильтров. Подготовка указанных фильтров и аппарата для фильтрования, а также сама техника фильтрования описаны в разделе, посвященном определению ОКБ и ТКБ воды.методом мембранных фильтров. Если анализу подвергают растворы, содержащие антимикробные вещества, или растворы с высоким осмотическим давлением, то после осаждения микроорганизмов на фильтре его промывают стерильной дистиллированной водой (или пептонно-солевым раствором). Фильтры с осевшими на них бактериями, не переворачивая, переносят на поверхность лактозного агара с бриллиантовым зеленым или среды Эндо.
При этом важно, чтобы между средой и фильтром не было пузырьков воздуха. В дальнейшем ход анализа аналогичен описанному выше. Для пересчета количества колиформных бактерий на 1 г (или 1 см3) продукта число колоний, выросших на фильтре (даже если их число меньше 15), умножают на степень разведения и делят на объем профильтрованной жидкости.
в) Определение количества колиформных бактерий посевом в агаризованные селективно-диагностические среды. Метод используется для исследования пищевых продуктов, содержащих в 1 г твердого продукта более 150 или в 1 см3 жидкого продукта (смыва) более 15 КОЕ колиформных бактерий.
По 1 см3 навески продукта или его разведения вносят в две параллельные стерильные чашки Петри. Не позднее, чем через 15 мин чашки заливают 15-20 мл расплавленной и охлажденной до 45(±1)°С селективно-диагностической среды (лактозный агар с бриллиантовым зеленым или среда Эндо). Содержимое чашек немедленно осторожно перемешивают круговыми движениями. После застывания среды чашки переворачивают вверх дном. В дальнейшем анализ проводят как описано в выше.
г) Определение количества колиформных бактерий методом наиболее вероятного числа. Метод предназначен для пищевых продуктов, содержащих в 1 г твердого продукта менее 150 или в 1 см3 жидкого продукта (смыва) менее 15 клеток колиформных бактерий.
Высевают три последовательные навески продукта и (или) его разведения, отличающиеся по количеству продукта в них в 10 раз. Каждую навеску (разведение) в трехкратной повторности высевают в колбы или пробирки с селективной средой (бульон лактозный с бриллиантовым зеленым и желчью, или бульон Мак-Конки, или среда Кесслер). Соотношение между посевным материалом и питательной средой 1:9, а для сред двойной концентрации—1:1. Посевы культивируют при 36(±1 )°С в течение 24-48 ч.
В дальнейшем ход анализа аналогичен описанному выше. НВЧ определяют по количеству колб (пробирок) с положительным результатом, используя при этом специальные таблицы. Положительными считают посевы, в которых отмечены признаки роста в жидкой среде, и при последующем пересеве которых на плотные среды и подтверждении характерных колоний хотя бы одна из них отнесена к колиформным бактериям.
д) Выявление колиформных бактерий при определении промышленной стерильности пастеризованных газированных фруктовых соков и напитков. Перед анализом необходимое количество сока или напитка отбирают в стерильную колбу с ватной пробкой. Затем колбу с продуктом помещают в водяную баню температурой 30-35 °С и, встряхивая колбу, освобождают продукт от углекислоты. Отсутствие выделения пузырьков газа свидетельствует о завершении процесса. После этого продукт нейтрализуют до pH 7,0(±0,3) стерильным раствором гидроокиси натрия массовой концентрацией 100 г/дм3. Значение pH контролируют по индикаторной бумаге или при помощи рН-метра.
Если продукта из одной упаковочной единицы недостаточно для определения, то объединяют две или более единицы в одну.
Подготовленный описанным выше образом продукт высевают в одну из селективных сред (бульон лактозный с бриллиантовым зеленым и желчью, бульон Мак-Конки, среда Кесслер). При этом высевают: три объема по 100 см3 — во флаконы (колбы), содержащие по 100 см3 среды двойной концентрации; три объема по 10 см3 — в пробирки, содержащие по 10 см3 среды двойной концентрации; три объема по 1 см3 — в пробирки, содержащие по 10 см3 среды нормальной концентрации. В дальнейшем анализ проводят как описано выше.
е) Выявление и определение количества Е. coli. При исследовании на наличие Е. coli в определенном продукте необходимую навеску последнего или его эквивалентное разведение высевают на среду Кесслер с лактозой. Посевы инкубируют при 44(±1) °С в течение 24-48 ч и затем регистрируют образование газа. Из положительных посевов производят посев штрихом на поверхность плотной селективно-диагностической среды (среда Эндо и др.) с таким расчетом, чтобы получить изолированные колонии. Посевы культивируют 18-24 ч при 36(±1) °С.
По три характерных колонии каждого типа пересевают в пробирки со скошенным МПА и инкубируют 18-24 ч при 36(±1)°С. Одновременно из каждой выбранной колонии готовят мазки и окрашивают их по Граму, определяют наличие оксидазы.
Дальнейшую дифференциацию выделенных культур (оксидазоотрицательных, грамотрицательных палочек) проводят по тестам ИМАЦ (реакции на индол, метил-рот, ацетилметилкарбинол и цитрат), утилизации глюкозы, сорбита, целлобиозы, способности к образованию сероводорода.
1. Тест на индол. Культуру со скошенного МПА петлей пересевают в пробирку с 5 см3 мясопептонного бульона с триптофаном и инкубируют 24 ч при 36(±1)°С. Выявление индола проводят так же, как описано в разделе 5.2.8.4.
2. Тест на ацетилметилкарбинол (ацетоин) — реакция Фогес-Проскауэра. Культуру со скошенного МПА петлей пересевают в пробирку с 5 см3 мясопептонного бульона с глюкозой и инкубируют 48 ч при 36(±1)°С. Выявление ацетоина проводят так же, как описано в отдельной статье на сайте.
3. Тест с метил-рот проводят параллельно с постановкой теста Фогес-Проскауэра. В пробирку с культурой, выращенной на мясопептонном бульоне с глюкозой, после отбора культуральной жидкости для реакции на ацетилметилкарбинол, добавляют 4-5 капель индикатора метил-рот. Если реакция положительная (имеет место образование кислоты из углеводов), то появляется красное окрашивание.
4. Тест на утилизацию цитрата. Культуру со скошенного МПА петлей пересевают на цитратную среду Козера или на среду Симмонса. Посевы инкубируют 96 ч при 36(±1) °С. Отсутствие роста и изменения цвета среды свидетельствуют об отрицательной реакции. При положительной реакции наблюдается наличие роста и изменение окраски среды с оливково-зеленого цвета на васильковый.
Для выявления способности к сбраживанию глюкозы, целлобиозы и сорбита используют соответствующие среды. Посевы инкубируют 24 ч при 36(±1)°С. Изменение цвета среды вследствие кислотообразования свидетельствует о том, что исследуемые микроорганизмы способны к ферментации субстрата, входящего в состав среды. Е. coli, сбраживают глюкозу и сорбит, но не ферментируют целлобиозу.
Для определения способности образовывать сероводород культуры с МПА высевают методом укола в столбик среды Кристенсена и инкубируют при 36(±1)°С в течение 24-48 ч. Микроорганизмы, образующие сероводород, окрашивают среду в черный цвет.
Обобщают все полученные результаты. К Е. coli относят аэробные и факультативно-анаэробные не образующие спор грамотрицательные палочки, оксидазоотрицагельные, образующие газ из лактозы при 44(±1)°С, дающие положительную (или отрицательную реакцию на индол), положительную реакцию с метил-рот, отрицательную реакцию на цитрат и отрицательную реакцию Фогес-Проскауэра, ферментирующие глюкозу и сорбит и не ферментирующие целлобиозу. Е. coli не образует сероводород. Бактерии, не сбраживающие сорбит и целлобиозу, но по другим биохимическим признакам показавшие типичные для Е. coli реакции, относят к сорбитотрицательным штаммам Е. coli.
Если при подтверждении характерных колоний не менее двух из выбранных трех колоний (т. е. не менее 66%) можно отнести к Е. coli, то считают, что все характерные колонии на чашке Петри принадлежат к Е. coli. В остальных случаях количество Е. coli определяют исходя из процентного отношения подтвержденных колоний к общему количеству характерных колоний, взятых для подтверждения. Количественный учет Е. coli в 1 г (или 1 см3) продукта можно производить методом НВЧ по количеству положительных посевов в жидкую среду (принцип метода).
При необходимости выявляют также способность дезаминировать фенилаланин (Е. coli не дезаминирует фенилаланин) и способность расщеплять мочевину (Е. coli не расщепляет мочевину).
Для определения способности бактерий дезаминировать фенилаланин производят обильный посев суточной культуры, выращенной на МПА, в пробирки со скошенным фенилаланиновым агаром. Посевы культивируют в термостате при 36(±1)°С в течение 4-24 ч, после чего на поверхность скошенного агара с культурой вносят по 4-5 капель раствора хлорного железа (FeCl3*6H2O) массовой концентрацией 100 г/дм3. При дезаминировании фенилаланина среда окрашивается в зеленый цвет.
Для установления способности расщеплять мочевину культуру высевают на среду Кристенсена с мочевиной и инкубируют при 36(+1)°С в течение 24 ч. При наличии бактерий, расщепляющих мочевину, среда становится резко щелочной и приобретает малиновый цвет.
- Вернуться в оглавление раздела "Медицинская микробиология"
Редактор: Искандер Милевски. Дата публикации: 10.10.2019
- Микрофлора яиц и яичных продуктов
- Микрофлора овощей и фруктов
- Микрофлора кондитерских изделий
- Микрофлора консервов
- Методика и правила отбора проб пищевых продуктов
- Подготовка проб пищевых продуктов к исследованию
- Методика отбора навесок пищевых продуктов и приготовление разведений
- Определение количества мезофильных аэробных и факультативно-анаэробных микроорганизмов в пищевых продуктах
- Определение плесневых грибов и дрожжей в пищевых продуктах
- Выявление и определение количества бактерий группы кишечных палочек (колиформных бактерий) в пищевых продуктах
