Остеомиелит как гнойно-воспалительное заболевание и осложнение
Термин «остеомиелит» (греч. osteon — кость, myelo — костный мозг, itis - воспаление) означает воспаление костного мозга. Однако под этим с самого начала подразумевали гнойную инфекцию, поражающую все элементы кости: костный мозг, собственную костную ткань, надкостницу и окружающие кость мягкие ткани. Попытки некоторых авторов заменить «остеомиелит» другими терминами в зависимости от глубины и многокомпонентности поражения кости, например, периостит, остит, миелит, паностит, не прижились в литературе. Большинство специалистов по настоящее время придерживаются первоначального термина «остеомиелит», введенного в 1831 г. П. Рейно для обозначения воспалительного осложнения травматических повреждений костей и А. Нелатоном (1834) в случае развития гематогенного остеомиелита.
Существует несколько теорий патогенеза остеомиелита. Все они пытаются объяснить механизм остеонекроза при остеомиелите. Нарушение кровообращения в кости при остеомиелите Е. Lexer (1894), A. Wilensky (1934) и J. Trueta (1959) связывали с микробной эмболией сосудов, особенно в эпиметафизарных областях трубчатых костей, В. А. Башинская (1959) — со спазмом сосудов с последующим их тромбированием, С. М. Дерижанов (1940), И. С. Венгеровский (1964) — с аллергическими реакциями сенсибилизированного организма или действием микробных экзотоксинов. М. В. Гринев (1977) считает, что в основе остеонекроза при остром гематогенном остеомиелите лежит не внутрисосудистые нарушения кровообращения (эмболом, тромбом, в результате спазма), а внесосудистая окклюзия вследствие сдавления сосудов воспалительным инфильтратом периваскулярной клетчатки. Воспалительный процесс в кости отличается от воспаления в мягких тканях тем, что оно развивается в ригидной, неподатливой ткани, и это приводит к неизбежному сдавлению отечной жидкостью сначала вен, а затем и артерий. Значительно повышается внутрикостное давление. Наступает резкое ухудшение, а затем прекращение кровообращения в кости с развитием ишемического некроза.
Колонии микроорганизмов располагаются в межтрабекулярных миелоидных тканях, где развивается гнойное воспаление. Изменения pH, локальный отек и активность лейкоцитов могут приводить к омертвению ткани, но одним из наиболее важных факторов является, вероятно, сосудистая обструкция. Костные трабекулы гибнут и фрагментируются в условиях нарушения кровоснабжения. Нагноение распространяется на соседние участки кости через гаверсовые и питательные каналы, и большие участки костной ткани подвергаются ишемическому некрозу вследствие воспалительного тромбоза артерий и вен, проходящих через эти каналы. Так образуются секвестры, которые могут полностью отделиться от окружающей кости и свободно располагаться в полости абсцесса. Гной, достигая поверхности кости, скапливается под надкостницей, где нарушает кровоток. Активность остеобластов в краевой части повреждения вызывает новое костеобразование на сохранившихся трабекулах. Живые ткани в стенке гнойного очага и особенно приподнятая периостальная мембрана образуют новую кость, и зона остеомиелита оказывается заключенной в костную раковину. Там, где наблюдается относительно медленное развитие деструктивного процесса, активность остеобластов на поверхности старых трабекул может привести к их значительному утолщению, что может вызвать образование аномально плотных секвестров. Значительная масса восстановленной кости в области костного мозга вместе с кортикальным утолщением усложняет рентгенологическую интерпретацию и может быть ошибочно принята за опухоль кости.
Вышеприведенные теории патогенеза касаются механизма возникновения острого гематогенного (эндогенного) остеомиелита. Применительно к остеомиелиту экзогенного (посттравматического, послеоперационного, огнестрельного) характера можно сказать, что нарушение кровообращения в кости происходит уже в момент травмы. Кровообращение кости при ее повреждении страдает как из-за повреждения надкостницы с ее развитой сосудистой сетью, так и вследствие разрыва собственных артерий кости. Кроме того, чем сильнее повреждаются мягкие ткани, тем больше страдает кровоснабжение кости. В еще большей мере это относится к огнестрельному остеомиелиту. Современное огнестрельное оружие, которое придает ранящему снаряду (пуля, осколок) огромную кинетическую энергию, вызывает в тканях значительные разрушения, особенно в мышцах. Мышечная ткань страдает не только из-за прямого разрушения, но и от разрыва сосудов, а также молекулярного сотрясения клеток вокруг раневого канала, в результате чего она погибает и некротизируется. Это сказывается на кровоснабжении надкостницы.
Таким образом, если гематогенный остеомиелит можно определить как гнойнонекротический процесс, то посттравматический, особенно огнестрельный, вернее было бы назвать некротически-гнойным процессом. Наиболее характерным для экзогенного остеомиелита является проникновение инфекции в кость извне экзогенным путем при травматических повреждениях. При гематогенном остеомиелите инфекция попадает в кость эндогенным путем, через кровяное русло, лимфатическую систему. Экзогенный остеомиелит может возникнуть в любом возрасте, гематогенный остеомиелит обычно наблюдается в детском и раннем юношеском возрасте, сравнительно редко у взрослых.
Возбудителем инфекции при гематогенном остеомиелите чаще всего бывает золотистый стафилококк, реже стрептококк, кишечная палочка, протей и др. При экзогенном остеомиелите инфекция обычно полиморфная.
По этиологическому принципу остеомиелиты делят на:
• неспецифический остеомиелит:
— с участием аэробных микроорганизмов:
а) в монокультуре;
б) в ассоциациях;
— с участием облигатных анаэробов:
а) в монокультуре;
б) в ассоциациях анаэробов;
— с участием анаэробно-аэробных ассоциаций микроорганизмов.
• специфический остеомиелит (туберкулезный, бруцеллезный, сифилитический).
Возбудителями гематогенного остеомиелита в 40-60% случаев являются S. aureus в монокультуре и ассоциациях, S. epidermidis — около 5%, в 10-15% — грамотрицательные бактерии. В единичных случаях — Р. aeruqinosa и анаэробные микроорганизмы.
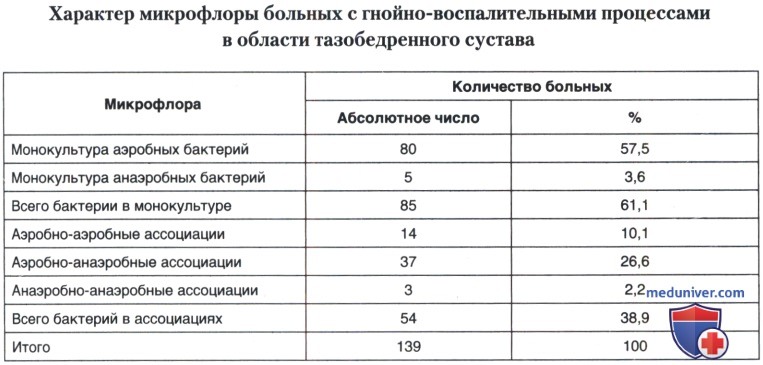
При анализе результатов микробиологических исследований материала 139 больных, оперированных в ГУН ЦИТО им. Н. Н. Приорова по поводу остеомиелита костей, составляющих тазобедренный сустав, получены следующие данные. Микрофлора в монокультуре обнаружена у 61,1% больных: у 57,5% монокультура аэробных бактерий, у 3,6% — анаэробных; различные ассоциации выделены у 38,9%, из них аэробно-аэробные ассоциации — у 10,2%, аэробно-анаэробные — 26,1%, анаэробно-анаэробные — 2,3%.
Анализ этиологической структуры, проведенный на основе результатов изучения видового состава выделенной микрофлоры, показал следующее. Всего изучено 139 образцов материала из патологического очага, выделено 216 культур микроорганизмов. Грамположительные аэробные бактерии обнаружены у 121 (56,01%) больного, при этом в 49,07% случаев выявлены стафилококки, в 6,94% — стрептококки.
Грамотрицательная аэробная микрофлора составила 16,7% от общего числа изолированных культур, среди них синегнойная палочка — 4,17%.
Всего количество аэробных микроорганизмов составило 72,7% от общего числа выделенных культур (216): 50,96% — в монокультуре, 18,5% — в аэробно-аэробных ассоциациях, 30,6% — в аэробно-анаэробных ассоциациях.
Обнаружено 59 (27,3%) штаммов анаэробных микроорганизмов. Среди них в монокультуре — 5 (2,3%), в анаэробно-аэробных ассоциациях — 48 (22,2%), в анаэробно-анаэробных ассоциациях — 6 (2,8%) штаммов.
Основой для разработки рациональной тактики антимикробной терапии разных форм гнойной патологии и послеоперационных инфекционных осложнений является изучение чувствительности выделенных штаммов к антибиотикам.
По результатам исследований, проведенных в ЦИТО, удельный вес метициллин-резистентных изолятов при стафилококковой инфекции у травматолого-ортопедических больных сравнительно невелик — не более 15,9% для S. aureus и 11,1% для коагулазонегативных стафилококков. Эти штаммы характеризуются устойчивостью ко всем р-лактамным антибиотикам: пенициллинам, аминопенициллинам, цефалоспоринам, монобактамам, карбапенемам. Они сохраняют чувствительность лишь к ванкомицину и в 60-80% случаев к рифампицину. По отношению к метициллин-чувствительным стафилококкам наиболее высокая активность отмечена у защищенных пенициллинов, цефалоспоринов первого-второго поколений, а также у ципрофлоксацина и, в несколько меньшей степени, у линкомицина. Это определяет достаточно широкий выбор препаратов для лечения инфекции, вызванной указанным микроорганизмом.
Энтерококки, в отличие от стафилококков, характеризуются резистентностью к более широкому спектру химиопрепаратов. Наибольшей активностью обладает ванкомицин, 2/3 штаммов сохраняют чувствительность к аминопенициллинам.
В отношении большинства грамотрицательных аэробных изолятов наиболее активными препаратами являются имипенем и нетилмицин, а также амикацин, ципрофлоксацин и цефтазидим. Вместе с тем у энтеробактерий отмечается высокий уровень резистентности к ингибиторнезащищенным пенициллинам, а у неферментирующих бактерий — к гентамицину, что не позволяет рассматривать эти антибиотики в качестве препаратов выбора для лечения инфекционных поражений костей и суставов, вызванных грамотрицательными аэробными бактериями.
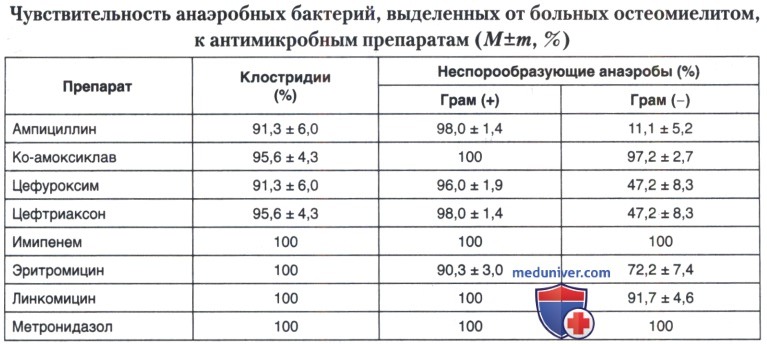
Применительно к анаэробным микроорганизмам универсальную активность (свыше 95% чувствительных штаммов) сохраняет метронидазол, карбапенемы, коамоксиклав и линкомицин.
Выделяют следующие обстоятельства, ведущие к росту гнойно-септических осложнений у хирургических и травматолого-ортопедических больных:
• увеличение доли тяжелой травмы в общей структуре травматических повреждений;
• значительное расширение показаний к хирургическим методам лечения;
• малообоснованное и бесконтрольное применение антибиотиков, приведшее к появлению устойчивых госпитальных штаммов возбудителей раневой инфекции;
• развитие иммунодефицитного состояния и недостаточный учет иммунного статуса пострадавших и отсутствие адекватной иммунокоррекции.
В ЦИТО у 121 больного с различными формами остеомиелита проанализировано состояние различных звеньев иммунитета. Выявлено, что наиболее значимые изменения клеточного иммунитета у этих пациентов получены по следующим показателям: у 53% больных снижено абсолютное содержание Т-хелперов, у 50,4% — абсолютное содержание естественных киллеров, у 35% — процентное содержание естественных киллеров, у 30,6% — абсолютное количество В-лимфоцитов, у 26,4% — абсолютное содержание Т-лимфоцитов. При анализе уровня содержания сывороточных иммуноглобулинов (IgA, М, G) установлен повышенный уровень IgA у 19% обследованных. Количество IgM и IgG находилось в пределах нормальных значений.
Фагоцитарная активность нейтрофилов у этих больных была изменена следующим образом: спонтанная люминолзависимая хемилюминесценция (ЛЗХЛ) — снижена у 17,3%, стимулированная — у 6,6% обследованных. Следовательно, у большинства обследованных лиц резких нарушений фагоцитарной активности нейтрофилов не выявлено.
Таким образом, анализ индивидуальных значений иммунологических показателей, характеризующих клеточное (лимфоцитарное, фагоцитарное) и гуморальное звенья иммунитета у травматолого-ортопедических больных с гнойно-воспалительными процессами, выявил наиболее значительные изменения в клеточном звене иммунитета (53% пациентов имело снижение содержания Т-хелперов, естественных киллеров). Как известно, недостаточность клеточного звена иммунитета, которое является регуляторным и эффекторным, приводит к хронизации, утяжелению течения гнойно-воспалительного процесса и низкой эффективности традиционной терапии. Полученные нами результаты обосновывают необходимость проведения иммунокорригирующей терапии у всех пациентов со сниженным клеточным звеном иммунитета в комплексном лечении больных с гнойными процессами.
Остеомиелиты длинных трубчатых костей довольно часто сочетаются с различными нарушениями консолидации переломов в виде несросшихся переломов, ложных суставов, дефектов костей, а также рубцовыми изменениями и трофическими нарушениями мягких тканей пораженной конечности. Такие сочетанные поражения конечностей характеризуются тяжелым, длительным течением и не всегда благоприятным исходом лечения. Это обусловлено многокомпонентностью повреждений, многоэтапностью традиционных методов лечения, предусматривающих на первом этапе ликвидацию гнойного очага, на последующих (через 6-12 мес.) — вмешательства, направленные на восстановление целостности кости и кожных покровов, восстановление функции конечности. Процесс лечения продолжается многие месяцы и годы.
Лечение всех многокомпонентных повреждений и их гнойно-воспалительных осложнений рекомендуется проводить в один этап, т.е. параллельно с ликвидацией нагноительного процесса выполняются мероприятия по замещению дефектов кости и мягких тканей, восстановлению целостности кости и функции конечности. Данная методика комплексная, ее составляющими являются:
• радикальная фистулсеквестрнекрэктомия гнойного очага вплоть до выполнения обширных сегментарных резекций;
• адекватный стабильный моно-, би-, полилокальный остеосинтез с применением спицевых, стержневых аппаратов внешней фиксации или их комбинаций (при наличии несросшихся переломов, ложных суставов, дефектов длинных трубчатых костей);
• различные виды кожной пластики (при необходимости);
• оптимизация остеогенеза с применением биокомпозиционного гидроксиапатитсодержащего препарата Коллапан;
• общая и местная целенаправленная антибактериальная терапия, профилактика рецидива гнойного процесса;
• адекватное дренирование в послеоперационном периоде;
• коррекция гомеостаза, иммунного состояния, метаболитная терапия;
• адекватное реабилитационно-восстановительное лечение.
Анализ результатов лечения показывает, что описанное комплексное одно-этапное лечение позволяет более чем в 2 раза уменьшить число послеоперационных гнойных осложнений, а также сокращает длительность лечения в 1,5-2 раза по сравнению с традиционной многоэтапной методикой лечения данной тяжелой категории больных.
- Читать далее "Инфекция протезированного сустава как гнойно-воспалительное заболевание и осложнение"
Редактор: Искандер Милевски. Дата публикации: 15.7.2020
- Фурункул и карбункул как форма острой инфекции мягких тканей
- Раневые внутрибольничные инфекции (ВБИ)
- Причины раневой инфекции (этиология и патогенез)
- Возбудители оппортунистических инфекций в травматолого-ортопедических клиниках
- Лечение, профилактика инфекций у травматологических и ортопедических пациентов
- Инфекционный бурсит как гнойно-воспалительное заболевание и осложнение
- Инфекционный артрит как гнойно-воспалительное заболевание и осложнение
- Остеомиелит как гнойно-воспалительное заболевание и осложнение
- Инфекция протезированного сустава как гнойно-воспалительное заболевание и осложнение
- Группы оппортунистических микроорганизмов вызывающие инфекции при ожоговой травме
